体外新霉素损伤HEI-OC-1细胞的作用和机制研究
2021-09-01刘文孙士平王丹韩淼淼刘永亮李勇管明
刘文孙士平王丹韩淼淼刘永亮李勇管明*
1山东第一医科大学附属淄博市中心医院耳鼻咽喉头颈外科(淄博255036)
2浙江大学医学院附属杭州市第一人民医院耳鼻咽喉头颈外科(杭州310006)
氨基糖苷(Aminoglycoside,AG)抗生素治疗常用于治疗需氧革兰氏阴性细菌感染[1]。AG也是导致听力损失和前庭系统功能障碍的第一种耳毒性物质[2-4]。已有研究表明,活性氧(Reactive oxygen species,ROS)在AG耳毒性中起一定作用,AG可在内耳内产生类ROS自由基(包括氧自由基和氮自由基)。因此,它促进线粒体通透性孔的开放,继而导致毛细胞(Hair cells,HCs)和神经元的永久性损伤,最终导致哺乳动物不可逆的损伤[1,3,5-7]。然而,由于可获得的内耳耳蜗有限以及药物对动物模型的副作用,药物耳毒性的细胞和分子机制的研究一直受到阻碍[8-12]。House耳研所建立和鉴定了HEI-OC-1细胞(House Ear Institute Organ of Corti 1cells),这些细胞表达许多耳蜗毛细胞的标志物,包括calbin‐din、calmodulin、math1、myosin7a、prestin 9[13-16]。目前,HEI-OC-1细胞系因其简单易行而被广泛应用于许多听觉研究中[17-21]。然而,在听觉研究中,HEI-OC-1细胞系是否提供了一种细胞模型系统来筛选新的药理药物潜在的耳毒性或保护耳朵的特性,仍有待于进一步的研究。本研究以新霉素为毒剂诱导HEI-OC-1细胞死亡,探讨新霉素对HEI-OC-1细胞的损伤机制。根据我们的结果,新霉素以浓度和时间依赖的方式诱导HEI-OC1细胞死亡。此外,氧化应激参与了HEI-OC-1细胞的凋亡和坏死,新霉素作用后,HEI-OC-1细胞的抗氧化-促氧化平衡被破坏,促进线粒体ROS积累,诱导线粒体膜电位(mitochondrial transmembrane po‐tential,MMP)丢失,进而诱导HEI-OC-1细胞死亡。这种机制与新霉素在体内的损伤耳蜗毛细胞的机制相似。因此,我们认为HEI-OC1细胞系可以提供一种细胞模型系统来研究新霉素等耳毒性药物对耳蜗毛细胞的损伤机制。
1 材料与方法
1.1 细胞培养
加州大学洛杉矶分校大卫·格芬医学院听觉细胞生物学实验室的费德里科·卡内奇博士亲切地赠送了HEI-OC-1细胞系。HEI-OC-1细胞系在用于实验之前进行了RT-PCR和免疫组织化学检测,细胞株仍表达多种HCs标记,如Myosin7a和Myo‐sin6a。HEI-OC-1细胞5在含10%胎牛血清和100 IU/ml青霉素的 DMEM(Sigma-Aldrich,St.Louis,USA)中37°C和5%CO2条件下培养。
1.2 细胞活力测定
采用细胞计数试剂盒CCK-8(碧云天,中国)评估细胞活力。在96孔板上用新霉素1~ 20 mM处理HEI-OC-1细胞1~ 24 h,每孔加入CCK-8溶液(10μl),37℃孵育0.5 h,在450 nm BIO-RAD 450 nm波长处测定光密度值。
1.3 免疫荧光
采用 TMRE(Sigma-Aldrich,St.Louis,USA)和Mito-Sox Red(Life Technologies,Waltham,USA)分别测量MMP和ROS。将HEI-OC-1细胞暴露于10 mM新霉素中24 h,然后在新霉素和无血清培养基中继续培养24 h,然后丢弃培养皿中的培养液,用PBS洗涤样品,并在37°C添加TMRE或Mito-Sox Red的DMEM中孵育10 min,染色后,细胞在预温的PBS中洗涤,用共聚焦显微镜(LSM700;Zeiss,Heidenheim,Germany)拍照。TUNEL试剂盒(Roche,Indianapolis,IN,USA)检测凋亡细胞,完成分组实验后,HEI-OC-1贴壁细胞,4%PFA室温固定1 h,封闭液室温封闭1 h。现配TUNEL反应体系:取出100μl label solution作为阴性对照(2个),将enzyme solution 50 μl加入剩下的450 μl label solution中混匀。配好的反应液加入到四孔板中,50 μl/孔,37℃孵育1h。去除反应液,PBST洗,加入DAPI染色,室温20-30 min。PBST洗。封片后荧光显微镜观察拍片,100-200倍,5个视野计数统计。
1.4 实时定量PCR(qRT-PCR)
用Trizol试剂(碧云天,中国)提取定量实时PCR(qRT-PCR)总 RNA,用 Revertaid First Strand cDNA合成试剂盒(Thermo Fisher Scientific,Waltham,USA)反转录制备cDNA。然后,用Bios‐systems CFX96实 时 PCR 仪(Bio-RAD,Hercules,USA)和 SYBR Green(Roche,Basel,Switzerland)进行qRT-PCR。表1显示引物序列。qPCR条件如下:95°C下20 s;95°C下15 s,62°C下1 min,40个循环,然后在72°C下延伸20 s,mRNA表达水平归一化到GAPDH的水平。

表1 PCR引物序列。Table 1 PCR sequences used in the experiments
1.5 流式细胞仪分析
用Annexin V-FITC和碘化丙啶(PI)(BD,San Jose,USA)分析细胞凋亡。将HEI-OC-1细胞胰酶消化,用冷PBS洗涤两次,再以1×106个/ml的浓度悬浮在1倍结合缓冲液中,然后加入5µl Annexin V-FITC和5 µl PI,与100µl细胞轻轻混合,然后在黑暗中RT孵育15 min。随后,向试管中加入400µl 1倍结合缓冲液。为进行TMRE和Mito-Sox分析,将HEI-OC-1细胞胰酶消化,收集,在含TMRE或Mito-Sox的预温(37°C)溶液中悬浮10 min,并用PBS洗涤。随后,用流式细胞仪(FACSCanto,BD,San Jose,USA)对样本进行分析。
1.6 HEI-OC-1细胞对新霉素作用浓度敏感检测
将HEI-OC-1细胞接种于48孔板中,分别加入0 mM、1 mM、2 mM、5 mM、10 mM和20 mM的新霉素作用24 h,每组设置3个复孔,用光镜进行塑料贴壁细胞计数。将HEI-OC-1细胞接种于96孔板中,分别加入0 mM、1 mM、2 mM、5 mM、10 mM和20 mM的新霉素作用24 h,每组设置3个复孔,采用CCK-8评估细胞活力。
1.7 HEI-OC-1细胞对新霉素作用时间敏感检测
将HEI-OC-1细胞接种于96孔板中,分别加入10 mM和20 mM的新霉素诱导HEI-OC-1细胞死亡,诱导时间0 h、4 h、8 h、12 h、24 h,每组设置3个复孔,采用CCK-8评估细胞活力。
1.8 新霉素损伤后凋亡细胞和坏死细胞百分比测定
将HEI-OC-1细胞接种于6孔板中,加入0 mM、10 mM新霉素作用24 h每组设置3个复孔。用Annexin V-FITC和PI分析细胞凋亡和坏死。将HEI-OC-1细胞接种于48孔板盖玻片中,加入0 mM、10 mM新霉素作用24 h,每组设置3个复孔,用TUNEL染色检测新霉素损伤后HEI-OC-1细胞的凋亡情况。
1.9 经新霉素处理后HEI-OC-1细胞的MMP和ROS检测
将HEI-OC-1细胞接种于48孔板盖玻片中,加入0 mM、10 mM新霉素作用24 h,每组设置3个复孔,采用TMRE和Mito-Sox Red分别测量MMP和ROS。
1.10 新霉素损伤后,HEI-OC-1细胞的抗氧化-促氧化检测
将HEI-OC-1细胞接种于6孔板中,加入0 mM、10 mM新霉素作用24 h,每组设置3个复孔,采用qRT-PCR定量分析促氧化因子Alox15和抗氧化因子Gsr和Sod1。
1.11 统计分析
所有数据均以均值±标准差表示,统计分析采用Microsoft Excel和GraphPad Prism 6。对于每个实验,n代表重复次数。两组间比较采用twotailed,unpaired Student’st检验,多组间比较采用单因素方差分析和Dunnett多重比较检验。P<0.05认为具有统计学意义。
2 结果
2.1 HEI-OC-1细胞对新霉素作用浓度敏感
为探讨HEI-OC-1细胞对新霉素的敏感性,将HEI-OC-1细胞以递增剂量的新霉素作用24 h后,用光镜和CCK-8试剂进行塑料贴壁细胞计数,测定细胞存活率。结果发现,当新霉素剂量超过5 mM时,HEI-OC-1细胞的可塑性贴壁率迅速下降(图 1A,B)。此外,CCK-8 检测结果还表明,HEIOC-1细胞对新霉素剂量敏感。随着新霉素剂量的增加,细胞存活率显著降低,1 mM、2 mM、5 mM、10 mM和20 mM处理24 h后,存活率分别为82.7±5.1%、77.2±3.1%、71.9±5.1%、56.3±7.3% 和47.2±5.8%(图1C)。新霉素在10 mM-20 mM作用24 h后,HEI-OC-1细胞出现50%死亡率(图1B,C)。
2.2 HEI-OC-1细胞对新霉素作用时间敏感
选用10 mM和20 mM的新霉素诱导HEI-OC-1细胞死亡,诱导时间0~ 24 h。CCK-8检测结果显示,HEI-OC-1细胞对新霉素作用时间敏感。10 mM新霉素作用4 h、8 h、12 h、24 h后,细胞存活率分别为 88.0±9.8%、84.8±4.5%、76.9±7.3%、56.3±7.3%。在20 mM新霉素处理4 h、8 h、12 h和24 h后,细胞存活率分别为77.8±5.0%、65.7±7.1%、50.8±8.8%、65.7%±7.1%、50.8±8.8%、65.7%±7.1%、50.8±8.8%和56.3%±7.3%(图1D)。
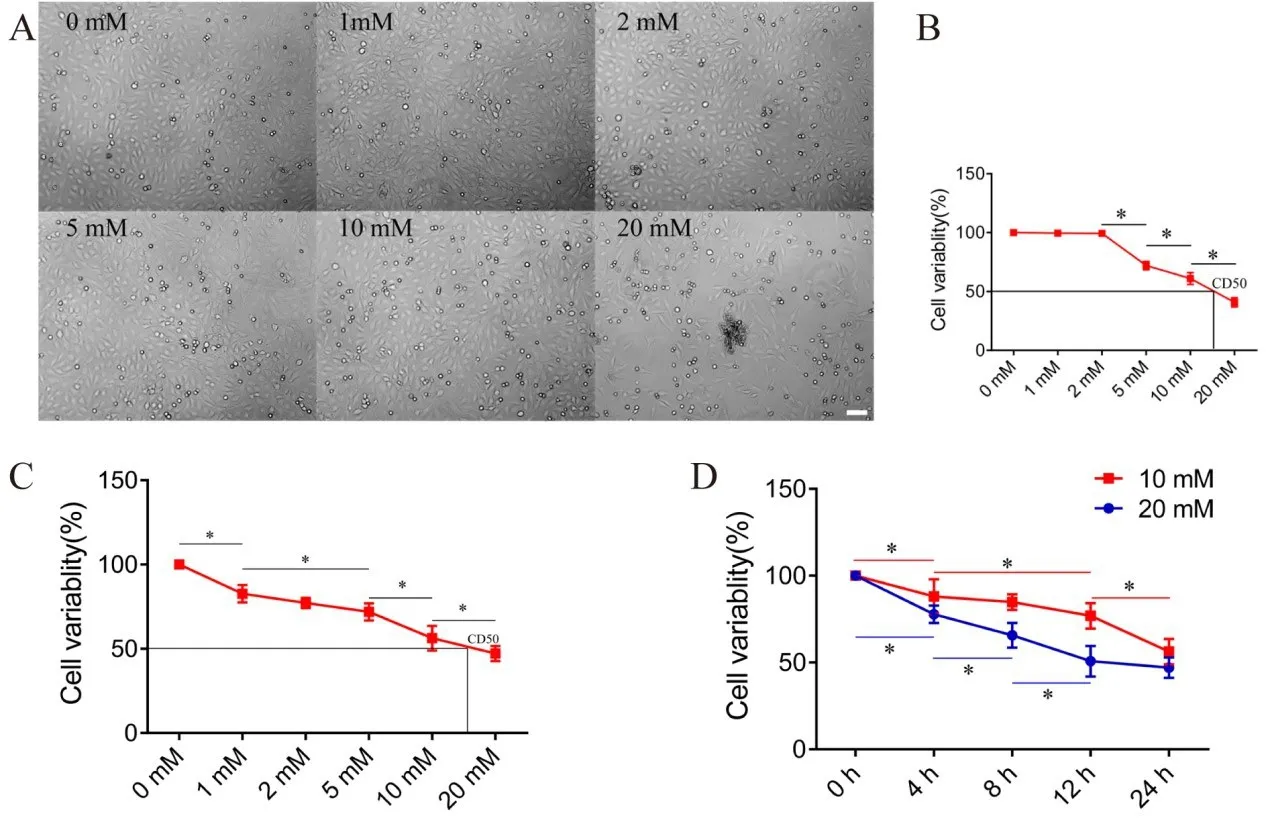
图1 HEI-OC-1细胞存活率随新霉素作用浓度和时间的增加而降低。(A)光镜下细胞计数显示,5 mM以上的新霉素处理后,可塑贴壁的HEI-OC-1细胞明显减少。(B)5mM、10mM、20 mM新霉素作用24h后,HEI-OC-1细胞存活率分别为72±3.5%、61.1±5.1%、40.8±3.9%,CCK-8检测结果显示,随着新霉素剂量的增加,细胞存活率下降。新霉素在10mM-20 mM作用24 h后,HEI-OC-1细胞出现50%死亡率。(C)CCK-8实验结果显示,HEI-OC-1细胞的存活率随新霉素作用浓度的增加而降低。1 mM、2 mM、5 mM、10 mM和20 mM作用24 h后,CCK-8实验结果显示细胞存活率分别为82.7±5.1%、77.2±3.1%、71.9±5.1%、56.3±7.3%和47.2±5.8%。新霉素在10mM-20 mM作用24 h后,HEIOC-1细胞出现50%死亡率。(D)CCK-8实验结果显示,HEI-OC-1细胞的存活率随新霉素作用时间的延长而降低。10 mM新霉素作用4 h、8 h、12 h和24 h后,HEI-OC-1细胞的存活率分别为88.0±9.8%、84.8±4.5%、76.9±7.3%和56.3±7.3%,20 mM新霉素作用4 h、8 h、8 h和24 h后,细胞存活率分别为77.8±5.0%、65.7±7.1%、50.8±8.8%和47.2±5.8%。*P<0.05。比例尺=100μm.Fig.1 The survival rate of HEI-OC-1 cells decreased as the neomycin treatment dose and time increased.(A)Cell count‐ing under light microscope showed that the plastic adherent HEI-OC-1 cells significantly decreased after neomycin treat‐ment at a dose of over 5 mM.(B)The survival rates of HEIOC-1 cells were 72±3.5%,61.1±5.1%and 40.8±3.9%,respec‐tively,after neomycin treatments at 5 mM,10 mM and 20 mM for 24 h.And neomycin treatments at 10-20 mM for 24 h led to CD50 of HEI-OC-1 cells.(C)Results of CCK-8 assay showed that the survival rate of HEI-OC-1 cell decreased with the increase in neomycin dose.That the survival rates of HEI-OC-1 cells were 82.7±5.1%,77.2±3.1%,71.9±5.1%,56.3±7.3%and 47.2±5.8%,respectively,after neomycin treat‐ments at 1 mM,2 mM,5 mM,10 mM and 20 mM for 24 h.And neomycin treatments at 10-20 mM for 24 h led to CD50 of HEI-OC-1 cells.(D)Results of CCK-8 assay showed that the survival rate of HEI-OC-1 cells decreased as the neomy‐cin treatment time increased.The statistical chart showed that the survival rates of HEI-OC-1 cells were 88.0±9.8%,84.8±4.5%,76.9±7.3%and 56.3±7.3%,respectively,after 10 mM neomycin treatments for 4 h,8 h,12 h and 24 h.Additionally,the survival rates of HEI-OC-1 cells were 77.8±5.0%,65.7±7.1%,50.8±8.8%and 47.2±5.8%,respectively,after 20 mM neomycin treatments for 4 h,8 h,12 h and 24 h.Data are shown as mean±S.D.*P<0.05.Scale bars=100 μm.
2.3 新霉素损伤后凋亡细胞和坏死细胞百分比增加
不同的有害刺激可通过坏死、凋亡或两者兼而有之的方式诱导死亡。为了解新霉素诱导HEIOC-1细胞死亡的确切途径,我们用10 mM新霉素作用于HEI-OC-1细胞24 h,流式细胞仪Annexin-V/PI分析显示,与未损伤对照组相比,新霉素处理后凋亡和坏死细胞百分率显著增加(图2A-D)。为了验证这一发现,进一步用TUNEL染色检测新霉素损伤后HEI-OC-1细胞的凋亡情况。结果,新霉素处理组的TUNEL阳性细胞百分率明显高于未损伤对照组(图2E,图4F)。以上结果表明,新霉素损伤可导致HEI-OC-1细胞凋亡和坏死。
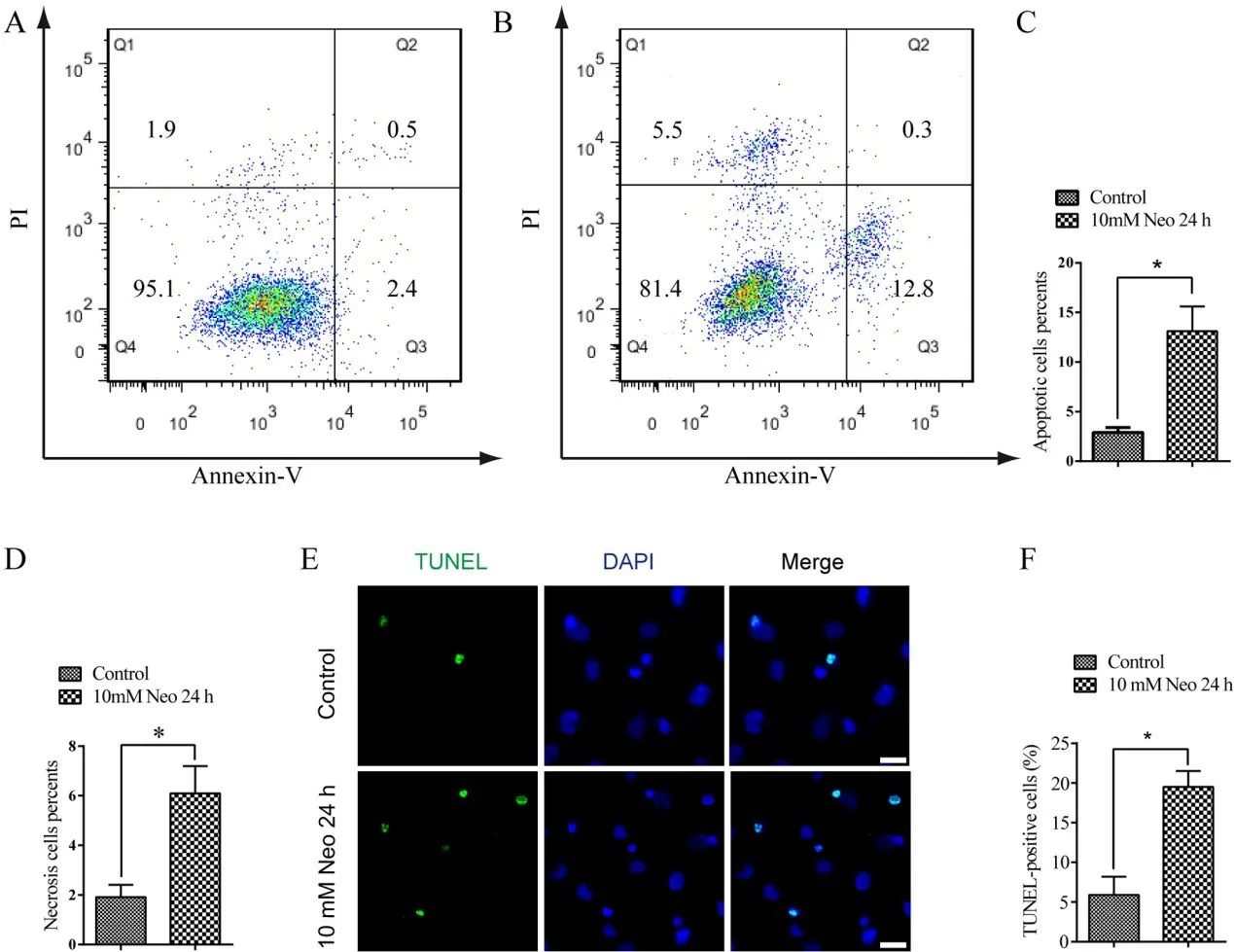
图2 新霉素处理后凋亡和坏死的HEI-OC-1细胞百分比增加。(A-D)流式细胞仪分析显示,10 mM新霉素作用24 h后,凋亡细胞和坏死细胞的百分率均明显高于未损伤对照组。(E和F)TUNEL染色显示,10 mM新霉素作用24 h后,TUNEL阳性凋亡细胞百分率明显高于未损伤对照组。*P<0.05。比例尺=20μm。Fig.2 The percentages of apoptotic and necrotic HEI-OC-1 cells increased after neomycin treatment.(A-D)Flow cyto‐metric analysis indicated that the percentages of both apoptot‐ic and necrotic cells significantly increased after 10 mM neo‐mycin treatment for 24 h relative to the undamaged controls.(E and F)TUNEL staining demonstrated that the percentage of TUNEL-positive apoptotic cells significantly increased af‐ter 10 mM neomycin treatment for 24 h relative to the undam‐aged controls.Data are shown as mean±S.D.*P<0.05.Scale bars=20 μm.
2.4 经新霉素处理后,HEI-OC-1细胞的MMP降低
线粒体是负责氧化应激反应的主要细胞器,而MMP的减少是线粒体功能障碍的主要特征本研究利用TMRE试剂盒定量检测HEI-OC-1细胞MMP的变化。免疫荧光结果显示,与未损伤对照组相比,10 mM新霉素处理24 h后,TMRE强度降低,同时流式细胞仪分析证实,新霉素处理组的MMP明显低于未损伤对照组(图3A-C)。以上结果表明,新霉素可降低HEI-OC-1细胞的线粒体膜电位。
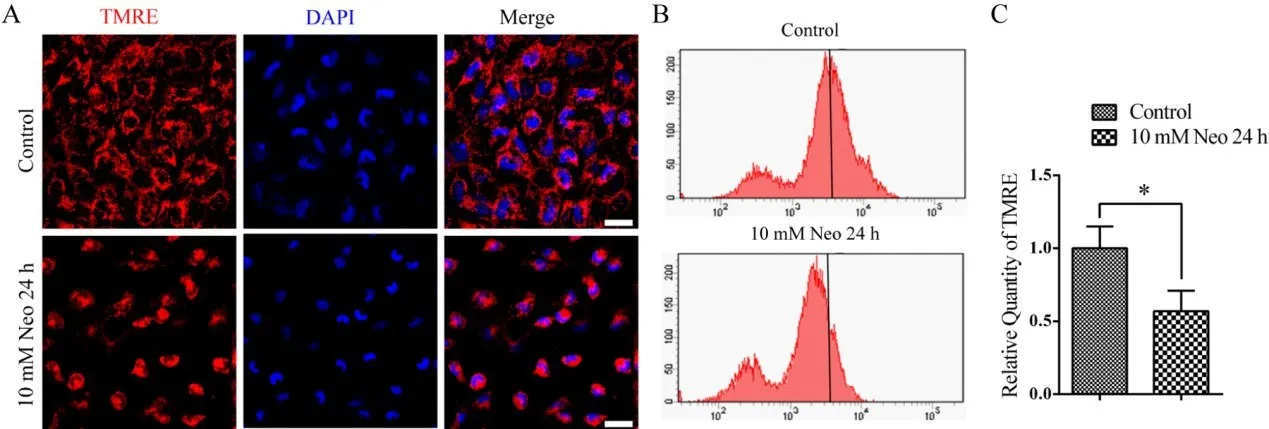
图3 新霉素处理后HEI-OC-1细胞的MMP降低。(A)免疫荧光结果显示,10 mM新霉素处理组与未损伤对照组相比,MMP明显降低。(B和C)流式细胞仪分析证实,10 mM新霉素作用24 h后,与未损伤对照组相比,MMP明显降低。*P<0.05。比例尺=20μm。Fig.3 The MMP decreased in HEI-OC-1 cells after neomy‐cin treatment.(A)The immunofluorescence results showed that the MMP significantly decreased in 10 mM neomycin treatment groups compared with the undamaged controls.(B and C)Flow cytometric analysis confirmed that the MMP sig‐nificantly decreased after 10 mM neomycin treatment for 24 h compared with the undamaged controls.Data are shown as mean±S.D.*P<0.05.Scale bars=20 μm.
2.5 经新霉素处理后,HEI-OC-1细胞ROS水平升高
活性氧促进线粒体通透性孔道开放,导致线粒体膜电位丢失。用氧化还原荧光载体Mito-Sox Red选择性检测线粒体超氧化物歧化酶(SOD),检测10 mM新霉素作用24 h后HEI-OC-1细胞线粒体ROS水平的变化,免疫荧光分析显示,10 mM新霉素作用24 h后,HEI-OC-1细胞线粒体ROS水平较未损伤对照组明显升高(图4A,B),流式细胞仪检测结果证实,与未损伤对照组相比,新霉素处理组细胞内ROS水平显著升高(图4C,D)。这些结果表明,新霉素可促进HEI-OC-1细胞中ROS的积聚,进而导致HEI-OC-1细胞中MMP的丢失。
2.6 新霉素损伤后,HEI-OC-1细胞的抗氧化-促氧化平衡被破坏
抗氧化-促氧化平衡在细胞氧化还原动态平衡中起着重要作用,其失衡可能导致活性氧的积累。在此,我们用qPCR方法分析了6个氧化还原相关基因的mRNA表达水平。结果,与未损伤的对照组相比,新霉素处理组的促氧化因子Alox15和抗氧化因子Gsr和Sod1的表达水平均上调(图4E)。

图4 新霉素处理后HEI-OC-1细胞内ROS水平升高,抗氧化因子和促氧化因子的正常表达水平受到干扰。(A和B)免疫荧光分析显示,10 mM新霉素作用24 h后,细胞内ROS水平较未损伤对照组升高。流式细胞术(C和D)结果证实,10 mM新霉素处理组与未损伤对照组相比,MMP升高。(E)RT-qPCR分析结果显示,10 mM新霉素处理组与未损伤对照组相比,促氧化因子Alox15表达上调。同时,10 mM新霉素作用24 h后,Gsr、Sod1等抗氧化因子也明显上调。*P<0.05。比例尺=20μm。Fig.4 The ROS level increased in HEI-OC-1 cells after neo‐mycin treatment,and the normal expression levels of both an‐ti-oxidative factors and prooxidantive factors were disrupted after neomycin treatment.(A and B)Immunofluorescence analysis demonstrated that the ROS level increased after 10 mM neomycin treatment for 24 h compared with the undam‐aged controls.(C and D)Results of flow cytometry verified that the MMP increased in 10 mM neomycin treatment groups compared with the undamaged controls.(E)Results of RT-qP‐CR analysis showed that the pro-oxidative factor Alox15 was up-regulated in the 10 mM neomycin treatment groups com‐pared with the undamaged controls.Meanwhile,the anti-oxi‐dative factors such as Gsr and Sod1 were also up-regulated af‐ter 10 mM neomycin treatment for 24 h.Data are shown as mean±S.D.*P<0.05.Scale bars=20 μm.
3 讨论
HEI-OC-1细胞株已被用于研究药物的耳毒性和耳保护的作用和确切机制[15,16,22,23]。然而,HEIOC-1细胞系能否提供模拟体内药物处理后耳蜗毛细胞病理生理变化的细胞模型体系,还有待进一步研究。本研究以新霉素作为耳毒性药物诱导HEIOC-1细胞死亡,以阐明新霉素对HEI-OC-1细胞的药物耳毒性及其损伤机制,并与体内耳蜗毛细胞的损伤机制进行比较。我们的研究表明,新霉素以浓度和时间依赖的方式诱导HEI-OC1细胞死亡。新霉素(1~ 20 mM)作用于HEI-OC-1细胞24 h后,细胞存活率明显下降。此外,10 mM、20 mM新霉素作用于HEI-OC-1细胞1~ 24 h后,细胞存活率也逐渐下降。研究发现10 mM新霉素作用24 h后,HEI-OC-1细胞死亡约50%~ 60%。我们选择这种条件来研究新霉素对HEI-OC-1细胞的损伤作用及其机制。
新霉素主要通过在内耳产生ROS诱导毛细胞死亡[2,3,24-26]。在新霉素作用下,ROS的积累触发线粒体去极化,从而进一步导致MMP的丢失[27-28]。本研究还表明,新霉素可提高HEI-OC-1细胞线粒体ROS水平,降低MMP,提示新霉素通过氧化应激诱导HEI-OC-1细胞死亡,与体内机制相似。在生理条件下,由于ROS的产生和清除之间的平衡,ROS水平被维持在一定的范围内,这种平衡是在众多相互协调的基因的作用下保持的[12]。一旦这种平衡被打破,细胞内的ROS水平就会增加[29,30]。本研究还发现,与未损伤对照组相比,新霉素处理组的促氧化因子和抗氧化因子如Alox15、Gsr和Sod1的表达均增加,这种干扰也可能是导致ROS水平升高的原因之一。
综上所述,我们的结果表明,新霉素以浓度和时间依赖的方式诱导HEI-OC-1细胞死亡,氧化应激参与了HEI-OC-1细胞的凋亡和坏死。新霉素损伤后,HEI-OC-1细胞的抗氧化-促氧化平衡被破坏,促进线粒体ROS积累,诱导MMP丢失,进而诱导HEI-OC-1细胞死亡。这种机制与新霉素在体内的损伤机制相似。因此,我们认为HEI-OC1细胞系可以提供一种细胞模型系统来研究新霉素等耳毒性药物对耳蜗毛细胞的损伤机制。
