植物液泡加工酶研究进展
2021-08-11苏雨李宗芸韩永华
苏雨 李宗芸 韩永华
(江苏师范大学生命科学学院 江苏省系统发育与比较基因组学重点实验室,徐州221116)
植物液泡加工酶(vacuolar processing enzyme,VPE)是一种半胱氨酸蛋白酶,又称天冬酰胺酰基 内 肽 酶(asparaginyl endopeptidase,AEP)或legumain[1],主要定位于植物液泡中,能够调节植物液泡蛋白成熟和参与程序性细胞死亡(PCD)。1987年人们最早在成熟的南瓜种子中发现了一类蛋白酶[2],这类蛋白酶主要负责将蛋白前体加工成熟;随后成功地从蓖麻[3]中分离纯化出这种天冬酰胺特异性的半胱氨酸蛋白酶,因其参与不同液泡蛋白的水解和激活过程而被命名为液泡加工酶。VPE属于Peptidase C13蛋白酶超家族,由于VPE具有类似caspase蛋白的α/β折叠[4],因此将它们归类为Peptidase CD家族成员。
通过分析VPE的激活机制,发现VPE本身是一种具有长C末端自抑制域的前体蛋白[5],并且含有参与催化的二联体半胱氨酸(Cys)和组氨酸(His)残基,通过水解天冬氨酸残基C末端的肽键[6],激活下游相关的底物蛋白,导致细胞结构和代谢的改变,最后引起细胞程序性死亡[7]。因此,VPE又被称为植物细胞中的类caspase蛋白酶。虽然植物VPE的亚细胞定位与动物caspase完全不同,但具有caspase-1活性的VPE在诱导植物某些类型的PCD过程中发挥重要作用。
根据已有研究表明,VPE在植物生长发育、PCD、应答生物与非生物胁迫反应等很多方面都发挥着重要的作用[8]。例如,VPE在烟草(Nicotiana benthamiana)中的沉默可减少病毒感染后的PCD[9];烟叶中的VPE识别caspase-1底物(YVADMCA),而不识别caspase-3底物(DEVD-MCA),进一步分析表明VPE是PCD过程中液泡塌陷的重要参与者[10]。近年来,研究发现,VPE具有肽连接活性[11-17],能够在植物中形成有毒环状肽(Cyclotides),对于植物的防虫具有重要作用。本文总结了植物VPE的现有知识、最新发展,以及对未来研究领域的展望,以便更好地了解VPE在植物中的功能和作用。
1 VPE的生化特性
1.1 VPE的成熟与活化
在植物中,VPE是液泡蛋白成熟和激活的关键酶[18],VPE的成熟和活化过程在拟南芥和蓖麻中已有深入研究。Kuroyanagi等[5]将拟南芥γ型VPE在昆虫细胞中表达,发现VPE能够进行自我催化。VPE首先在内质网上以较大的无活性前前体形式(preproprecursor VPE,ppVPE)合成,ppVPE由信号肽(signal peptide,sp)、N端前肽(N-terminal propeptide,NTPP)、成熟蛋白酶结构域和C端前肽(C-terminal propeptide,CTPP)构成(图1)[19]。ppVPE在内质网上通过剪切信号肽和糖基化转变成无活性的VPE前体(precursor VPE,pVPE),随后被转运到溶解型液泡中,经过自我催化转化为有活性的VPE中间体(intermediate VPE,iVPE),然后再转变为VPE成熟体(mature VPE,mVPE)[5]。剪切掉CTPP的iVPE与mVPE具有基本相同的酶活性,但从iVPE剪切掉NTPP对于该酶的激活却不是必须的,由此可见CTPP对于VPE酶活性的调控具有非常重要的作用[20]。进一步研究表明,CTPP是一个自我抑制结构域,它遮盖了VPE的催化位点,抑制VPE的活性。因此,C末端的“前结构域”又被称为Legumain稳定和活性调节(legumain stabilization activity modulation,LSAM)结构域。
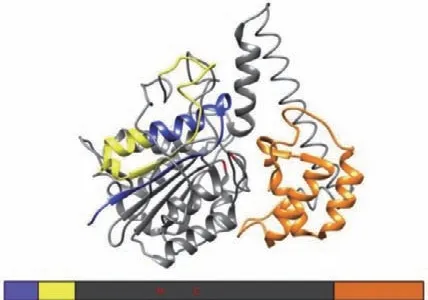
图1 VPE的主要三维结构Fig. 1 Main three-dimensional structure of VPE
VPE的底物对Asn和Asp残基具有特异性[20],它们具有与哺乳动物caspase-1相似的结构和酶性质,表现出与YVADase/caspase-1类似的切割活性[21]。这种严格的切割专一性意味着它们适合对蛋白质进行有限的蛋白质水解,然而,与其他蛋白酶的蛋白质水解引起的底物蛋白质构象的改变会暴露额外的Asn位点,导致VPE进一步降解[4]。
1.2 VPE具有肽连接活性,产生防御蛋白
植物VPE被认为是植物“免疫”系统的重要组成部分,因为它们可以参与环肽的生成,是抵御病原体的重要防御物。肽连接活性广泛分布于植物中,VPE不仅催化肽绑定位点的裂解反应,同时也催化多肽片段连接和转肽反应。来自向日葵种子的一个前体蛋白经过多肽片段连接和转肽反应生成主链环化蛋白(kalata B1)[12],该环肽通过抑制生长而达到防御害虫的目的。
多种具有抗生素活性的不同环肽[22]聚集在一些植物中,它们的产生需要肽连接步骤,其中,肽连接酶介导在前体蛋白的羧基和氨基末端之间形成新的肽键[23]。洋刀豆(Canavalia ensiformis)的刀豆蛋白A[11,24]的翻译后处理和肽连接需要β型VPE[25-26];蝶 豆(Clitoria ternatea)的γ型VPE (Butelase 1)具有肽连接活性[13],可产生环肽;链球菌(O. affinis)的γ型VPE(OaAEP1)在前体蛋白的连接过程中介导了环氧化物的产生[15,27];向日葵γ型VPE(HaVPE1)处理前体多肽PawS1后产生充当胰蛋白酶抑制剂的环肽(SFTI-1),表明HaVPE1介导肽酶和肽连接反应[14,28]。VPE的肽连接活性差异很大,一些表现出高的连接活性,而另一些则没有,说明在环肽的进化过程中,针对不同的VPE,肽连接活性水平已得到优化[17,29-31]。
2 VPE参与程序性细胞死亡的机制
PCD是一种高度调节的生理过程,对真核生物的发育至关重要。植物细胞与动物细胞不同,由于细胞壁的存在,植物细胞在PCD期间不会被相邻细胞吞噬[32]。VPE负责液泡膜的裂解,使蛋白酶释放到细胞质中并启动蛋白水解级联反应,导致细胞程序性死亡[33]。研究表明,VPE参与了许多不同类型的PCD(表1)。
2.1 VPE参与由病原体引起的生物应激诱导的PCD
植物一直在不断与环境中各种各样的病原体接触,如病毒、细菌、真菌,虽然植物体内没有特定的免疫细胞,但植物针对不同的病原体进化出了不同的防御策略[57],其中一种策略就是产生超敏反应(hypersensitive response,HR),能够快速地导致局部的细胞超敏性死亡,它是PCD的一种形式。某些病原菌引起的超敏细胞死亡是由液泡介导的,通常有2种不同途径,即非破坏性途径和破坏性途径[19](图2)。
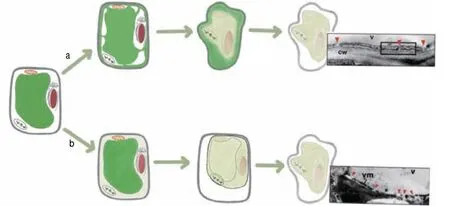
图2 液泡介导细胞死亡的两种不同途径Fig. 2 Two different ways of vacuole-mediated cell death
非破坏性途径是由于液泡膜和质膜融合使液泡与细胞质膜外部空间相互连接,导致液泡中的水解酶排到细胞外基质,导致细胞死亡,此过程不涉及液泡膜破裂。当植物受到细菌病原体感染后,液泡内的防御蛋白会发生聚集,由于液泡质膜的融合使得液泡防御蛋白被释放到细菌增殖的细胞外空间,从而阻止细菌的生长。破坏性细胞死亡途径是由液泡膜破裂直接导致液泡中的水解酶释放到细胞质中,降解细胞质成分,进而引起快速直接的细胞死亡。当植物受到病毒感染后,由于大部分防御蛋白并不能阻止病毒繁殖,于是细胞采用液泡膜裂解机制,通过自杀行动抵制病毒的繁殖和扩散,保护其他部分以及整个植物体的存活。VPE依赖性细胞死亡通过破坏液泡膜有效地清除细胞内的病毒,因此,VPE在病毒诱导细胞死亡的早期阶段显然是必不可少的。
植物液泡内包含多种水解酶和防御蛋白,是植物体内的溶解细胞器,液泡蛋白在翻译后被加工成成熟形式或在VPE的作用下被降解[58]。烟草叶片中VPE的失活导致烟草花叶病毒(tobacco mosaic virus,TMV)诱导的PCD水平降低[9],同时检测到caspase-1活性降低,这是首次直接证明VPE所具有的caspase-1活性是导致细胞程序性死亡的基础[59]。通过使用caspase抑制剂抑制VPE活性,从而能够抑制植株被细菌或病原体侵染后引起的PCD[42]。类似地,通过沉默VPE基因,使得缺乏VPE的烟草植株中的病毒诱导的HR得到抑制[34]。近年来,在苹果叶片中发现VPE与梨火疫病菌(Erwinia amylovora)诱导的超敏反应有关[51]。另外,VPE依赖性细胞死亡也参与了真菌毒素诱导拟南芥敏感细胞的死亡[46]。因此,VPE既作为植物防御策略介导了超敏细胞死亡,又作为一种病原策略介导了毒素诱导的细胞死亡。
2.2 VPE参与植物发育阶段的PCD
PCD在不同发育阶段包括种皮形成、侧根出现、芽的发育与衰老、糊粉细胞降解、花粉自交不亲和性、叶片和花瓣衰老中都有发生[60]。已经证明大麦的VPE参与大麦种子(包括核与果皮)中母体组织的降解,从而也影响种子颗粒的大小[61-63]。葡萄的(Vitis vinifera)VvβVPE在胚珠成熟和发芽过程中具有重要作用[64];在木质部发育过程中,马铃薯块茎顶芽分生组织的分化及顶端优势的出现[50],根瘤的发育和衰老[62,65],叶和花瓣衰老[46,61]和花粉发育[66]中也发现了VPE参与PCD的证据。野生烟草和转基因烟草的异种间F1杂交系中幼苗阶段出现了杂交致死现象,杂交幼苗死亡是由于液泡膜的破裂导致的[67],抑制VPE活性后PCD水平有所降低,由此发现液泡膜的破裂与VPE的活性有关。
2.3 VPE参与由非生物胁迫引起的PCD
VPE参与由非生物胁迫引起的PCD,一般来说,非生物胁迫(如干旱)可以诱导多种形式的半胱氨酸蛋白酶,这些蛋白酶在自然衰老期间可能不会表达[68]。拟南芥γVPE在保卫细胞中强烈表达并参与水胁迫反应[69],当γVPE突变时,γVPE敲除的突变株降低了气孔开度,拟南芥植物更耐旱,表明该类型VPE对气孔运动具有调控作用。水稻OsVPE2和OsVPE3可能与过氧化氢和盐胁迫诱导的PCD有关,其中,H2O2胁迫导致OsVPE2和OsVPE3表达量上调;抑制OsVPE3的表达使得PCD期间液泡破裂减少以及叶宽和气孔保卫细胞长度降低,增强了水稻的耐盐性[70]。在重金属铝胁迫下,caspase抑制剂抑制番茄悬浮细胞中PCD,首次证实了类caspase活性与铝诱导的PCD有关[71],近期研究发现液泡膜破裂早于细胞死亡,表明VPE介导的液泡破裂在铝胁迫诱导的PCD中起关键作用。另外,一些植物激素(如乙烯、水杨酸和茉莉酸),以及一氧化氮等都能使VPE基因表达上调[21]。
3 VPE的分类
从苔藓、蕨类植物到种子植物的进化过程中,VPE总是扮演着重要角色。植物VPE类似于哺乳动物caspase,都参与调控PCD途径[72]。两者的不同之处在于,在动物中编码同一种型的蛋白,并且成熟的酶位于胞质溶胶中[73];然而,在高等植物液泡中,经常会发现几种不同类型的VPE,例如拟南芥基因组包含4种类型VPE(αVPE、βVPE、γVPE和δVPE)。根据氨基酸序列和表达模式分析将其 划 分 为3大 类[20]:营 养 类(α型VPE和γ型VPE)[74-76]、种子类(β型VPE)[76]和新型(δ型VPE)[48]。将VPE分为种子类和营养类的这种分类方式与将液泡分类为蛋白质储存型液泡和裂解型液泡有关,蛋白质储存型液泡含有大量种子萌发和生长过程中需要的防御和储存蛋白,而裂解型液泡则含有大量水解酶。另外一种新型δ型VPE在种子发育早期种皮的2个细胞层中特异、短暂地表达。
随着研究的进步,由于这些类型的VPE之间没有实质的序列差异,不能为每个成员分配特定的功能与特点,而且也不能排除VPE在其他组织或发育阶段具有的表达活性。例如,在拟南芥αVPE、βVPE和γVPE三重突变体中检测到种子贮藏蛋白的前体,没有成熟的贮藏蛋白,而在αVPE、γVPE单突变体以及αVPE、γVPE双重突变体中检测到成熟的贮藏蛋白,表明种子β型VPE在种子成熟期胚胎中发挥重要作用;βVPE、γVPE双重突变体比βVPE单突变体积累了更多的存储蛋白前体和较少的成熟形式,说明营养型VPE(α VPE和γ VPE)的表达也参与了种子贮藏蛋白的加工,并且在胚胎成熟过程中补充了β型VPE的活性[77-78]。在烟草中,NtVPE3是一种与δVPE高度同源的VPE基因,但在叶片和根部以及成熟的种子中也检测到该基因的表达[79]。
Kenji等[80]从进化的角度分析不同植物不同类型VPE蛋白构建的系统发育树(图3),认为被子植物的VPE主要起源于γ型VPE和β型VPE[81]。由于在植物进化过程中蔷薇亚纲出现了蔷薇超目和菊超目的分离,因此,α型VPE逐渐从γ型VPE中分离出来,蔷薇超目中十字花目的出现使得δ型VPE从γ VPE中分离出来,该研究推测造成这些类型VPE基因的差异可能是由于植物进化过程中的全基因组复制[80]。目前,虽然对于VPE的分类仍存在争议,但在对VPE进行分类时仍然遵循将VPE分为营养型和种子型的分类方式。

图3 植物液泡加工酶系统进化树Fig. 3 Phylogenetic tree of vacuolase system in plants
4 不同类型VPE的生物学功能
4.1 β型VPE对种子贮藏蛋白成熟具有重要作用,且在胚胎、胚乳及花粉中特异表达
种子贮藏蛋白包括白蛋白和球蛋白,在种子成熟过程中积累。在液泡中,通过VPE裂解贮藏蛋白前体,从而使种子贮藏蛋白成熟[24]。在水稻和拟南芥中,βVPE突变导致种子贮藏蛋白前体部分积累[26-27,82-83],表明其参与了种子贮藏蛋白的成熟过程。并且除了β型VPE外,γ型VPE在蛋白质加工中也起作用,但β型VPE在这一过程中起主要作用。βVPE在种子成熟期广泛表达,此时种子贮藏蛋白大量积累;αVPE和γVPE在种子发育早期表达,表达水平低于βVPE[24],这些差异表明β型VPE是种子贮藏蛋白加工的主要贡献者。
β型VPE广泛存在于被子植物中,在被子植物进化过程中,β型VPE最早与其他类型VPE分离,这种分离与双受精系统(双受精系统涉及胚乳的发育)的发展相一致[84]。最早发现的是蓖麻中的βVPE,它主要在种子中表达。拟南芥β型VPE直接参与半胱氨酸蛋白酶在空泡降解前的成熟,间接参与了毡层的降解和花粉的发育[66];番茄SlVPE4的启动子在成熟胚中显示出很高的活性水平[85];栽培烟草βVPE(NtVPE2)在胚胎发育后期和花粉中都有表达[79];葡萄VvβVPE在胚珠发育过程中有特异表达[64]。总之,βVPE在种子成熟过程中的胚胎和胚乳以及花粉中都有特异性表达。
4.2 δ VPE在种皮中特异表达
被子植物种子的种皮包裹着胚和胚乳,在种皮发育成完全的种皮前,胚和胚乳是由内外两层细胞层(内种皮、外种皮)组成的,细胞层在受精后开始发育,形成了种皮的具体化结构。在种子发育的早期阶段,具有caspase-1活性的δ型VPE在这些细胞层中表达导致PCD,从而减少细胞层的厚度并形成种皮。δ型VPE最初是从拟南芥种皮的外层中鉴定[48],由于δVPE缺失突变株中PCD过程显示下降水平,并且拟南芥种子成熟过程中外层细胞层在整个胚胎形成期都保存着原有的厚度,证明δ型VPE在种皮的形成阶段主要是通过PCD来控制细胞层的厚度。其他物种中的δ型VPE也扮演着重要角色,如番茄SlVPE2在种皮中特异表达[85];烟草NtTPE8在种子外皮绒毡层中表达,并且下调NtTPE8的表达,诱导胚胎流产[86];大麦HvVPE2a位于珠心的细胞壁,在谷物发育过程中降解细胞壁[87]等。
除此之外,δVPE在植物营养组织中还具有其他功能。例如,拟南芥δVPE在种子萌发胚根伸出期间瞬时表达,一旦幼苗建立,其表达水平就会下降[88]。与野生型拟南芥相比,δVPE缺失突变株表现出叶片卷曲和坏死、蚜虫种群的快速聚集,表明δVPE功能丧失,对植物自身的基础防御会造成一定影响[89]。虽然δVPE可能表现出特定的表达模式,但它们的一般功能与γVPE相似,因为它们参与了营养组织中液泡蛋白的加工或PCD的控制。
4.3 α VPE、γ VPE主要在衰老细胞中表达
VPE不仅在逆境胁迫下或细胞超敏反应中的表达量增加,而且在植物衰老过程中,VPE的表达量也会上调。拟南芥αVPE在新生侧根、紧贴死亡细胞的内层细胞内表达,而γVPE在花粉发育末期的花粉囊中层衰老的细胞中表达,γVPE催化了植物液泡蛋白酶AtCPY的成熟,并且γVPE参与拟南芥衰老组织中液泡转化酶AtFruct4的分解[90],表明γVPE在植物组织老化的PCD过程中具有降解蛋白质的作用[91]。无论是αVPE启动子还是γVPE启动子都不能在新生的且未受损伤的组织中起作用,只能在老化组织中启动下游基因表达[24]。营养型VPE在高等植物中各种类型的PCD中发挥作用,乙烯、水杨酸处理和创伤都能使αVPE和γVPE表达上调,茉莉酸能使γVPE表达轻微上调[90],推测营养型VPE可能参与营养组织中各种溶解型液泡蛋白质成熟的过程,成熟的液泡蛋白质可能在植物细胞中液泡介导的病毒诱导细胞死亡、衰老等过程中发挥作用。
5 结论与展望
目前,关于VPE的研究仍然落后于其他半胱氨酸蛋白酶,尽管已在植物VPE基因组学、表观遗传学和生物信息学等[92]方面取得了一些进展,但在应激条件下阐明VPE的功能以及VPE在植物防御信号传导中可能的作用方面仍鲜见报道。江苏师范大学生命科学学院重点实验室在近期研究中发现,在拟南芥中异源过表达甘薯VPE基因,对于拟南芥的发育、衰老、开花时间、叶片大小和数量以及衰老表型具有重要的调控作用[78]。因此,迫切需要开展更广泛的VPE突变体工作以及沉默VPE工作,从而研究VPE基因在植物发育及对生物和非生物胁迫反应方面的作用。
研究表明,通过降低VPE基因表达,从而降低半胱氨酸蛋白酶诱导的蛋白质降解,导致叶子和种子中更高的蛋白质含量,半胱氨酸蛋白酶抑制剂的共表达可以增加烟草中重组蛋白的产生,这对提高一些农作物的蛋白含量提供了重要的理论依据。未来研究的一个方向是半胱氨酸蛋白酶抑制剂在2种蛋白酶(Caspase-1(木瓜蛋白酶样)和Caspase-13(VPE))之间的相互作用中发挥特殊作用。关于抑制剂的表达时间、特异性及相互作用的类型仍然是一个尚未开发的研究领域。另外,VPE产生的环状产品可能具有控制害虫的潜力,这对某些食草动物的防治具有重要的指导作用。在未来关于VPE将有越来越多的新发现,有助于完善植物发育和防御的机制。