氮肥减施对茶园土壤细菌群落结构的影响研究
2021-08-11向芬李维刘红艳银霞曾泽萱周凌云
向芬 李维 刘红艳 银霞 曾泽萱 周凌云
(湖南省农业科学院茶叶研究所,长沙 410125)
氮肥投入是提高茶树产量的有利保障,但过量长期施用氮肥反而会造成茶叶减产,土壤板结等问题,亦会对土壤微生态造成较大的影响[1],进而影响土壤微生物的活性与群落结构[2]。土壤微生物参与土壤有机质分解和养分转化[3-4],间接促进了土壤物质养分循环[5-6],是土壤环境质量早期评价的指标[7]。
不同品种茶园的根际土壤细菌种类数、个体数各不相同[8]。茶园不同施肥模式比较发现,与不施肥对照比较,施肥模式的根际土壤细菌、真菌、放线菌等微生物数目增加,根际土壤微生物量碳、氮和土壤酶活性亦增加[9],虽然N肥的施用能显著提高非根际土壤微生物量碳氮含量[10-11],有机肥施用能提高茶园土壤微生物区系的多样性[12],但对于不同减氮模式处理下的茶园土壤细菌的活性及群落结构鲜见报道,而土壤中90%微生物为细菌[13],可能与土壤中细菌种类繁杂,分离培养周期长,难以比较全面的检测土壤细菌的类别有关[14-15]。研究者前期对不同减氮模式下茶园土壤理化性质、茶园产量、氮肥农学效率进行了研究[16],发现减氮处理B能保证产量,氮肥农学效率最高,土壤养分利用率高。基于宏基因组的高通量测序方法无需单独对细菌分离培养,可对样本中所有细菌种类进行分析,现已被广泛应用于土壤微生物群落研究[1,14,17]。为了探究不同减氮模式对茶树地下部分细菌菌群组成的影响,本文通过高通量测序方法测定不同施氮量茶树地下部分的细菌结构及组成,为进一步明确氮代谢相关细菌活动规律及田间氮肥用量标准提供参考。
1 材料与方法
1.1 材料
试验地位于湖南省茶叶研究所马坡岭基地茶园,地理位置113°04.512′ E,28°12.397′ N,地势平坦,试验地土壤为第四纪红壤,土层深厚,茶园土壤0-20 cm土层基本情况:全碳15.9 g/kg,全氮1.7 g/kg,碱解氮162 mg/kg,有效磷44.8 mg/kg,有效钾264 mg/kg,碳氮比为9.35。
1.2 方法
1.2.1 试验设计 茶园连续4年管理水平保持一致,于2013年10月18日-2016年10月18日对茶园连续4年进行不同施氮量处理,试验设16 kg/667 m2(减氮55.6%处理A),26 kg/667 m2(减氮27.8%处理B),36 kg/667 m2(常规施肥处理C)、不施氮(CK)4个处理水平,每个处理小区200 m2,每个处理3次重复。具体施肥时以菜籽饼、硫酸钾型复合肥为基肥,尿素为追肥的方式进行施用,施用方式见表1。
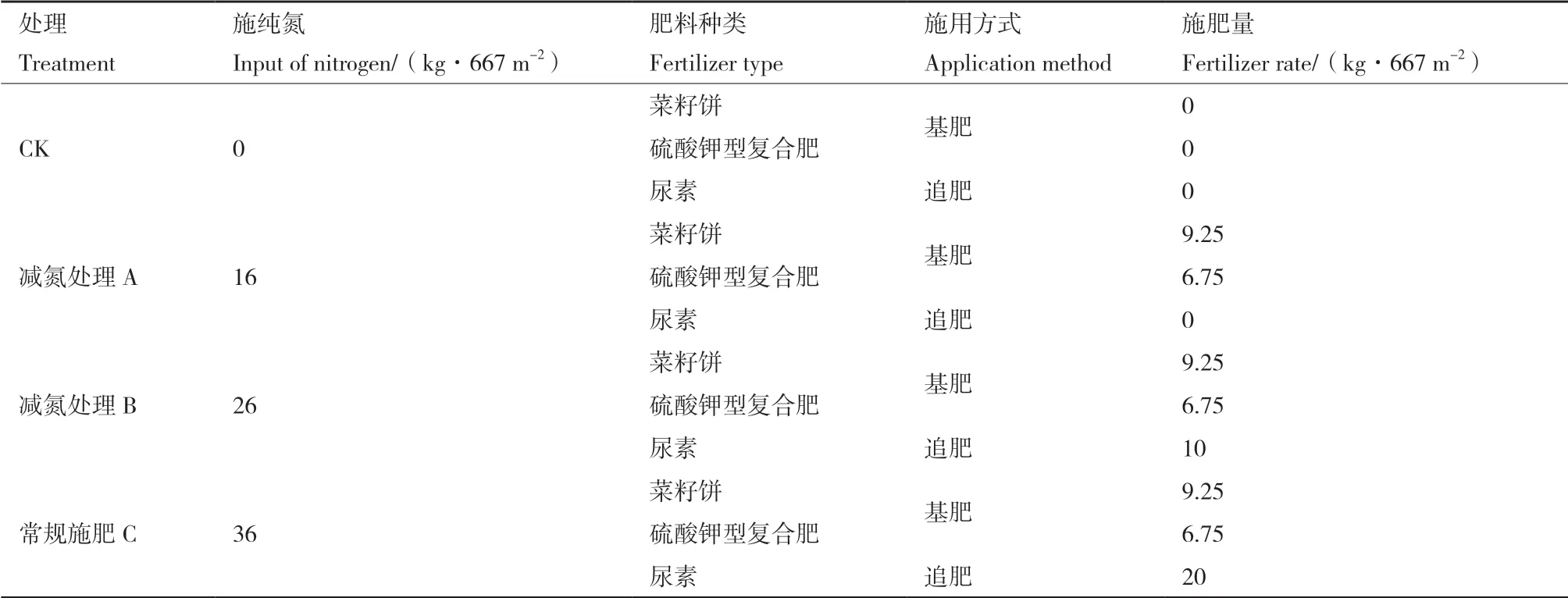
表1 试验茶园施肥方式Table 1 Fertilizer application methods in tea garden
1.2.2 样品采集 从茶园施肥处理第4年开始进行样品采集,非根际土壤样品、根际样品采集于2017年10月8日进行,用土钻(直径2.5 cm)在每个小区按Z型5个点(非根际0-20 cm土壤,非根际20-40 cm土壤)进行取样,每个处理3个重复,非根际土壤样品在24 h内去除茶树根系,置于-4℃保存,用于非根际土壤细菌菌落结构的测定。离茶树根颈部25-45 cm处,深0-40 cm,宽50 cm挖取茶树吸收根,尽量减少对根系的损伤,用软毛刷清扫根系上的土壤,即根际土。
1.2.3 样品测定 叶面积指数于2017年4月采用LAI-2200C冠层分析系统对各减氮处理叶面积指数进行测定。土壤碳通量:于2017年5月采用Soilbox-343 便携式土壤呼吸系统(VAISALA,芬兰)进行测定。将待测区域内植被地上部全部清理干净,并拣去较多的枯枝落叶。将非透明呼吸室罩在待测区域,呼吸室与土壤的接触边缘用干土密封,每小区随机选取3 个点进行测定。根据单位时间箱内CO2浓度的变化计算土壤呼吸速率[18]。
将茶园茶树根际土壤、非根际0-20 cm土壤、非根际20-40 cm土壤使用TIANamp Bacteria DNA kit核酸提取试剂盒提取样本中总DNA。对细菌16S rRNA基因V3-V4高变区进行PCR扩增(Bio-rad T100 梯度PCR仪),引物序列为:341F:CCTAYGGGRBGCASCAG,806R:GGACTACNNGGGTATCTAAT。酶和缓冲液:使用 New England Biolabs 公 司 的 Phusion® High-Fidelity PCR Master。PCR 扩 增 体 系(30 μL):2×taq PCR mix 15 μL,Primer F(10 μmol/L)3 μL,Primer R(10 μmol/L):3 μL,gDNA 2.5 μL,H2O 6.5 μL。PCR反应程序:95℃预变性 5 min;34个循环包括(94℃,1 min;57℃,45 s;72℃,1 min);72℃最后延伸10 min。将产物送交北京诺禾致源生物信息科技有限公司采用IonS5TMXL高通量测序平台进行测序。先对 PCR产物进行纯化与定量,再使用 Thermofisher 公司的 Ion Plus Fragment Library Kit 48 rxns 建库试剂盒进行文库的构建,构建好的文库检测合格后,使用Thermofisher 的Ion S5TMXL 进行上机测序。
1.2.4 序列数据处理与数据分析 基于IonS5TMXL测序平台,利用单端测序(Single-End)的方法,构建小片段文库进行单端测序。通过对Reads剪切过滤,操作单元分类数(Operational taxonomic units,OTUs)聚类,并进行物种注释及丰度分析,可以揭示样品物种构成,应用VENN图可以用来统计样本中共有的和独有的OTUs数目,采取BLAST将代表序列与GreenGene数据库比对,对每个OTU进行物种分类注释,分别在门、纲、目、科、属的分类水平上统计样本的菌群组成,进一步的α多样性分析(Alpha Diversity)及β多样性分析(Beta Diversity)可以挖掘样品之间的差异。为进一步挖掘分组样品间的群落结构差异,选用T-test统计分析方法对分组样品的物种组成和群落结构进行差异显著性检验。采用DPS7.05软件进行微生物丰富度指数与多样性指数统计分析。
2 结果
2.1 减氮处理对茶树冠层的影响
茶树为叶用经济作物,叶面积指数能较好的反应作物产量。从图1可以看出随着施氮量的增加茶树叶面积指数增加,与对照不施肥比较,减氮处理B、常规施肥C的叶面积指数显著、极显著增加,但减氮处理B与常规施肥C的叶面积指数无显著性差异。
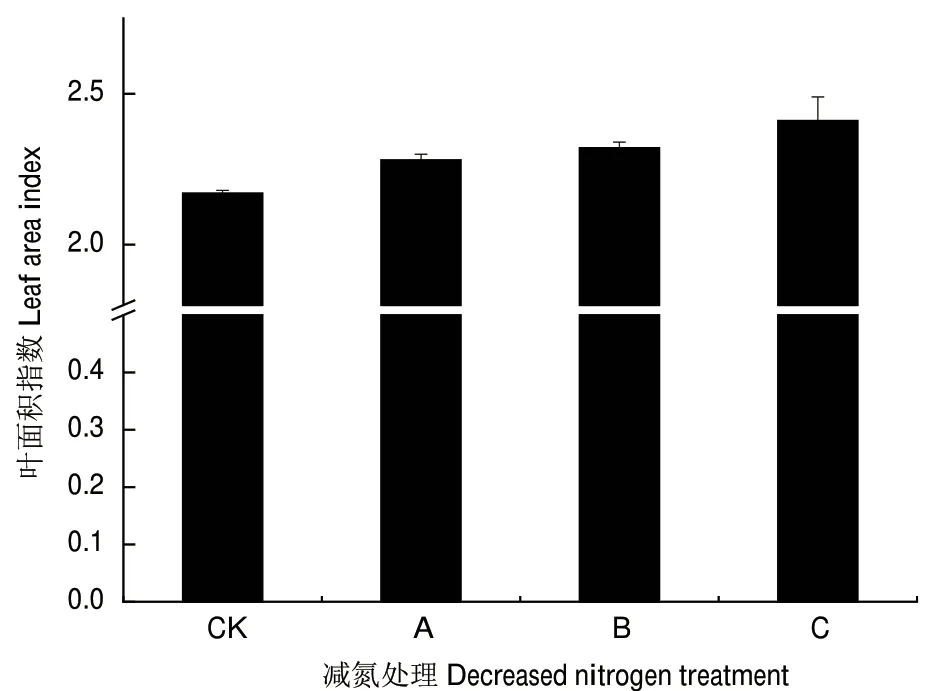
图1 减氮处理对茶树叶面积指数的影响Fig.1 Effect of nitrogen reduction on tea leaf area index
2.2 测序结果质量分析
根据图2稀释性曲线看出,各样品的序列数据量达到30 000条时,OTUs基本趋于饱和,表明测序获得了足够多的数据量,样本的测序数据量基本覆盖所有类群的信息。图3根际样品曲线在横轴上的跨度最小,表示物种的丰富度最小,而非根际土壤细菌的代表曲线相对更平缓,表示其中分布的物种更均匀。
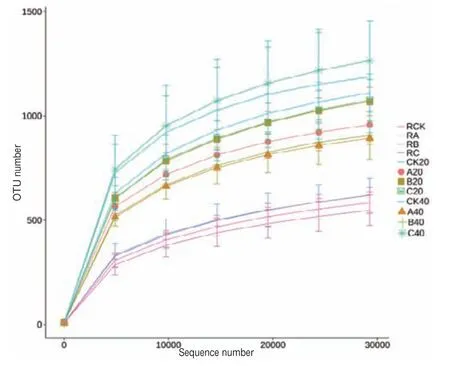
图2 不同土壤样品测序稀释曲线图Fig.2 Rarefaction analysis of 16S libraries from different soil samples
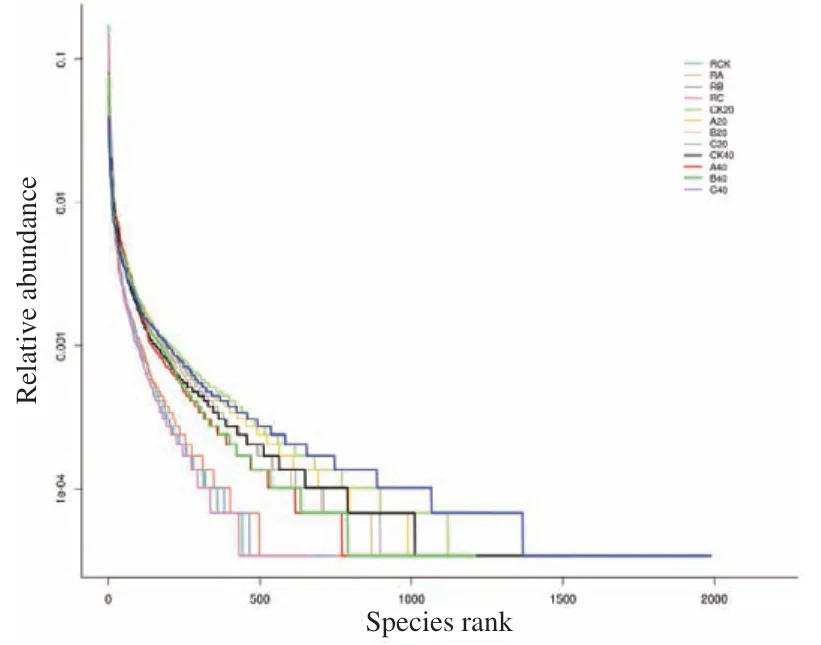
图3 不同土壤样品的Rank Abundance曲线Fig.3 Rank Abundance curves of different soil samples
2.3 减氮处理对各土层中细菌多样性指数的影响
Chao1指数和Ace指数是衡量样品中物种丰度的重要指标,而香农(Shannon)指数和辛普(Simpson)指数常用来衡量样品物种多样性,Shannon指数值越大,Simpson指数值越小,则说明样品中物种群落多样性越高。由表2可知,与对照比较,施肥处理的茶树根际土壤中的细菌物种丰度增加;而非根际土壤中细菌菌落的多样性和丰度降低,细菌种群数在非根际土壤中比根际土壤高出44.50%-131.08%,非根际土壤中施肥处理以常规施肥处理的土壤细菌丰度较高,并以减氮较多的处理A最低,而根际土壤细菌丰度则以常规施肥处理(36 kg/667 m2)最低,减氮处理B(26 kg/667 m2)最高,但差异不显著。其中细菌多样性指标Shannon指数显示减氮处理B的土壤细菌多样性在根际土壤与非根际0-20 cm土壤中最高,而在非根际20-40 cm土壤则是常规施肥处理C的细菌多样性显著增加(P<0.05)。
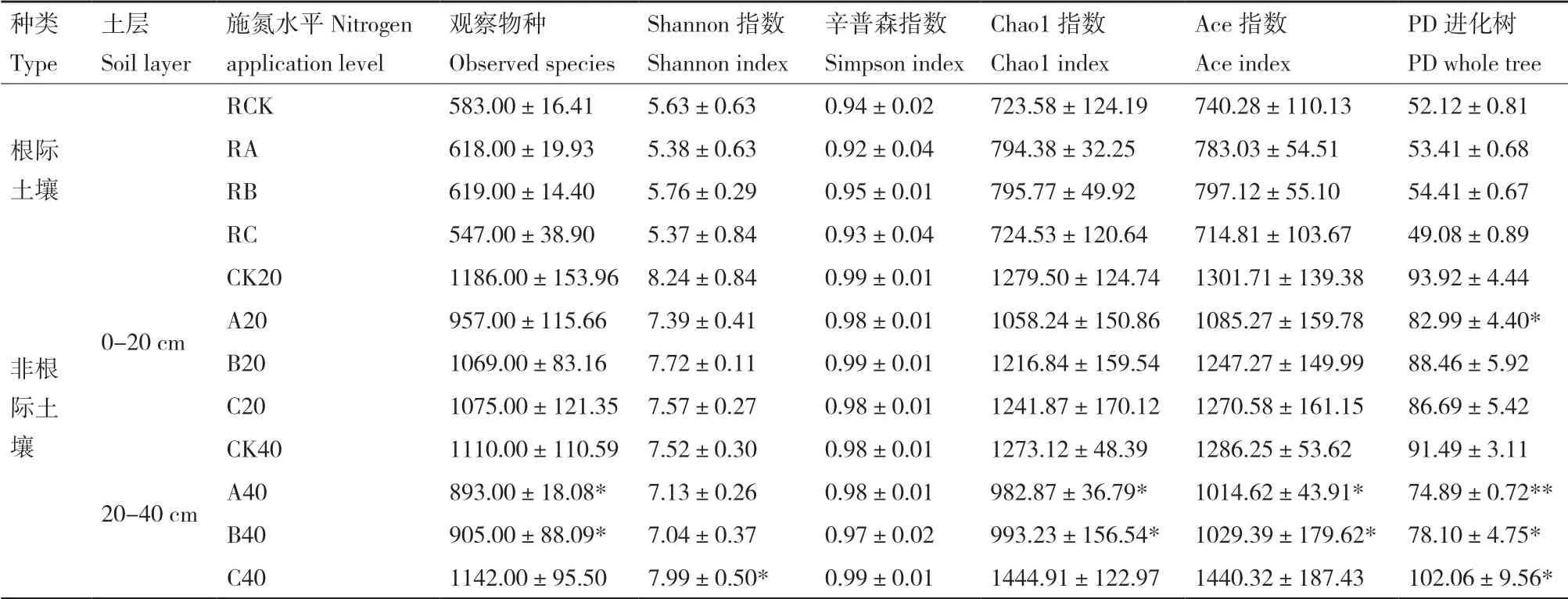
表2 各土壤样品微生物丰富度指数与多样性指数Table 2 Diversity and richness index of bacteria from twelve samples
2.4 各减氮处理土壤样品细菌的Venn图比较
根际土壤、非根际0-20 cm土壤及非根际20-40 cm土壤共有OTUs分别为505、854及835个。其中根际土壤、非根际0-20 cm土壤、非根际20-40 cm土壤的OUTs分布随着施氮量增加逐渐降低,其中非根际20-40 cm土壤各处理分别占31.58%、27.86%、26.23%(图4)。由图5可知,茶树地下部分各样品在门水平上的优势菌基本为氮代谢相关菌类。其中共有3个优势类群,分别为变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi),其中相对富集在根际的优势菌为蓝藻菌门(Cyanobacteria);非根际土壤中的则为酸杆菌门(Acidobacteria),另外3种分别为拟杆菌门(Bacteroidetes)、芽单胞菌门(Gemmatimonadetes)、糖化菌门(Saccharibacteria)。在属的水平上(图6),根际与非根际土壤细菌优势菌差异明显,其中根际为旁氏伯克霍尔德菌(Burkholderia Paraburkholderia)、放线菌(Actinospica)、热孢子丝菌(Thermosporothrix)3种,而非根际土壤则为水蛭杆菌(Mizugakiibacter)、嗜酸栖热菌属(Acidothermus)2种。并发现常规施肥处理C在非根际0-20 cm土壤与非根际20-40 cm土壤有两个特异菌,分别为克罗斯耶拉菌(Crossiella)与罗尔斯顿菌(Ralstonia)。并从图7的组间硝化螺旋菌门显著性差异比较发现,非根际0-20 cm土壤的硝化螺旋菌门丰度较高,与对照比较,根际土壤各处理之间无显著性差异;根际土壤的各施肥处理与非根际0-20 cm土壤的CK处理差异极显著;非根际0-20 cm土壤的减氮处理A、B与CK差异极显著,非根际20-40 cm土壤的减氮A、B处理与非根际0-20 cm土壤CK处理差异极显著。
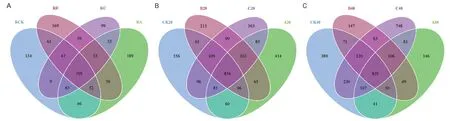
图4 不同土壤样品OTUs分布的Venn图Fig.4 Venn diagrams of OTUs distribution of different soil samples
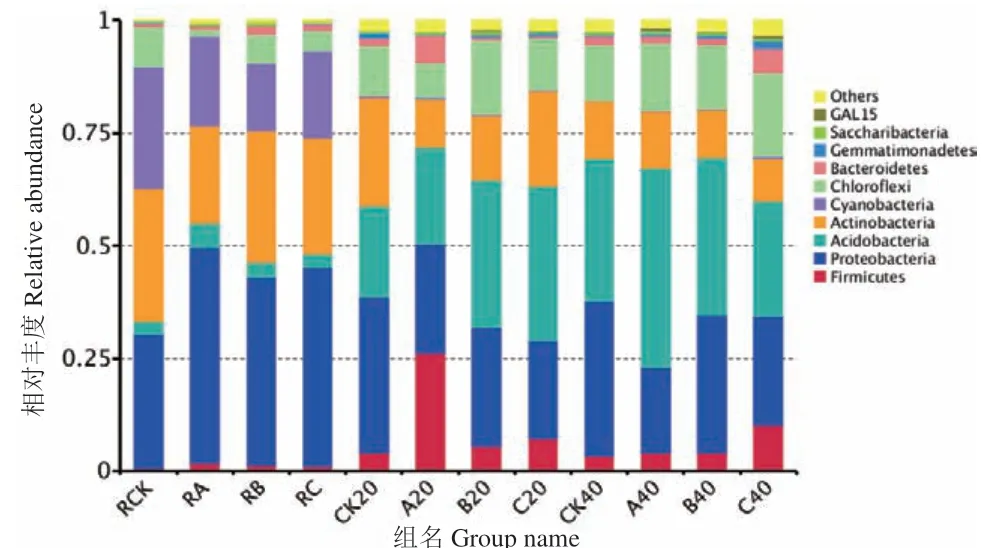
图5 门水平的细菌组成聚类堆积图Fig.5 Cluster stacking graph of bacteria composition at phylum level
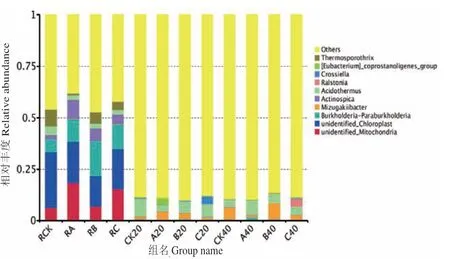
图6 属分类水平的细菌组成聚类堆积图Fig.6 Cluster stacking graph of bacteria composition at genus level
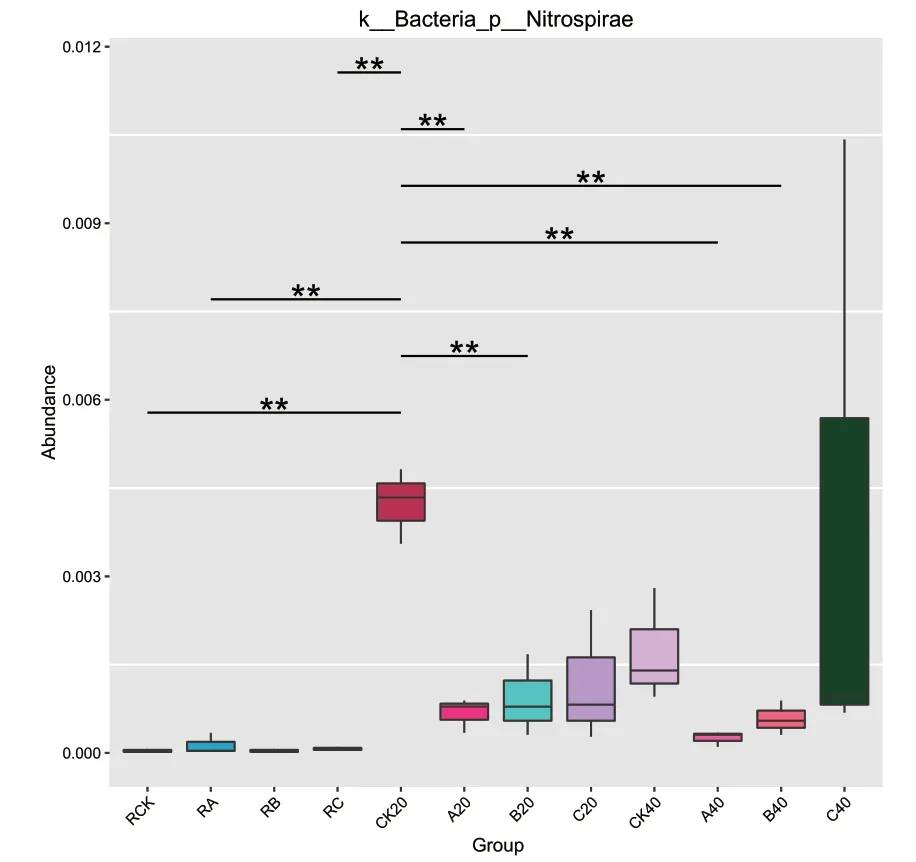
图7 组间硝化螺旋菌门显著性差异统计图Fig.7 Statistical chart of significant difference with Nitrospirae between groups
2.5 减氮处理土壤样品细菌群落结构的相似性 分析
采用主坐标分析方法对各处理组土壤样品的细菌在属分类水平上进行分析,评估细菌群落间的差异。从图8可以看出,主成分1(PC1)和主成分2(PC2)对固氮细菌群落结构变异的解释量分别为35%和19.34%,A20、CK20与C40、CK40样本相较与其他样本而言分布较为分散,样品间距离较远。
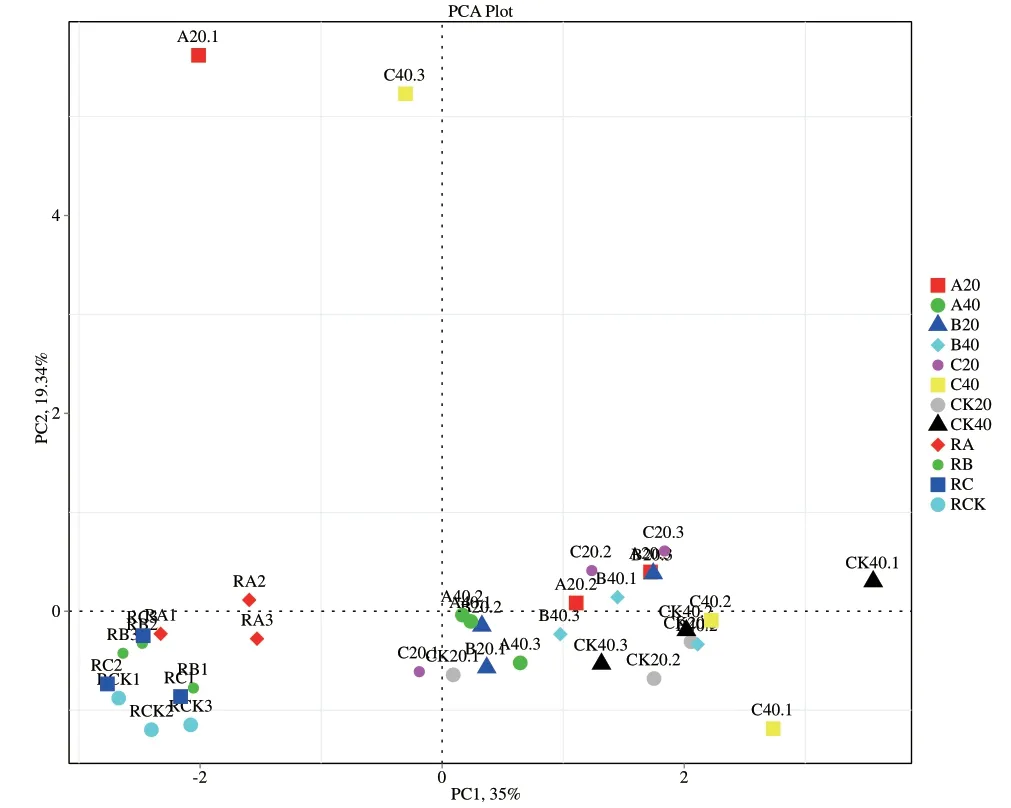
图8 各土壤样品细菌群落主坐标分析Fig.8 PCoA analysis of bacteria in different soil samples
2.6 减氮处理对茶园土壤碳通量的影响
土壤碳通量变化与土壤微生物变化密切相关,对不同减氮处理后茶园的土壤碳通量进行测定,结果如图9所示。以减氮处理B的土壤碳通量较高,为2.70 μmol/m2/s;常规施肥 C 处理次之,为2.63 μmol/m2/s;对照处理最低,为2.02 μmol/m2/s;各处理间差异不显著。
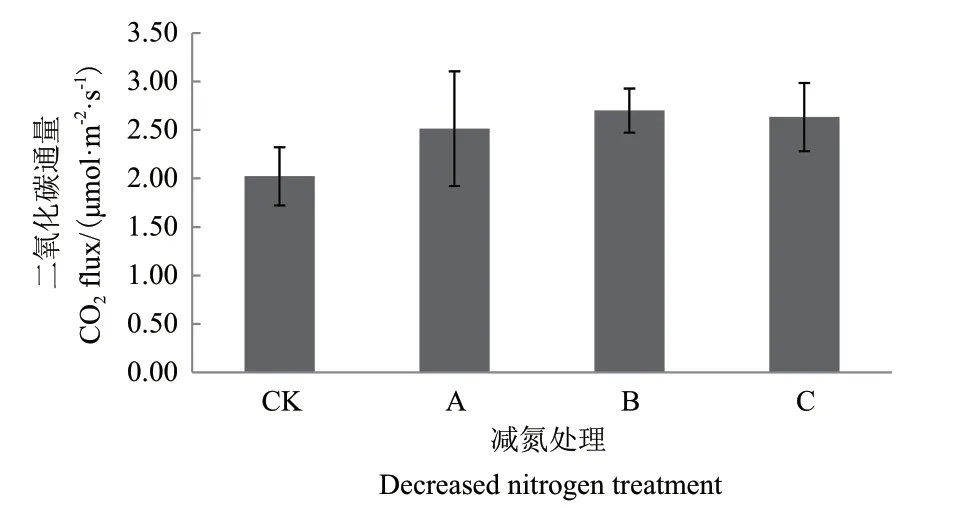
图9 减氮处理对茶园土壤碳通量的影响Fig.9 Effect of nitrogen reduction on soil carbon flux in tea garden
3 讨论
Illumina Miseq测序技术能够克服传统检测方法的缺陷,具有通量高、错误率低、成本低、流程自动化、速度快等优势。已被广泛用于微生物群落结构研究。本研究采用高通量Illumina Miseq测序技术对茶树地下部分微生物进行系统分析,能真实全面地了解土壤及根际微生物的组成情况。施氮能促进茶树生长,茶叶叶面积指数增加,提高茶叶产量,本研究结果表明施氮能提高茶树的茶叶叶面积指数。同时发现减氮处理B的茶园土壤固氮细菌组成增加,茶树地下部分的根际微生物多样性增加。从而推测施氮量为26 kg/667 m2(减氮处理B)的处理有利于土壤中氮素循环平衡与氮素固定[19],也有利于维持土壤微生物平衡。本研究结果表明施肥处理后茶园非根际土壤细菌多样性与丰度均降低,推测氮素促使茶园土壤的变形菌门数量变多,从而改变了土壤的细菌群落构成,这与李凤霞等[20]的研究结果一致。各施肥处理茶树地下部分在门水平上的优势菌基本为氮代谢相关菌类,如优势类群之一的变形菌门以及在根际的优势菌蓝藻菌门(Cyanobacteria)[1]。其中施氮量为26 kg/667 m2(减氮处理B)的处理的Chao1指数、Ace指数和Shannon 指数结果表明0-20 cm土壤中细菌丰度较高,尤其是多样性最高,而在非根际20-40 cm土壤中则是施氮量36 kg/667 m2(常规施肥C处理)的细菌多样性显著增高,这说明适量施氮的茶园土壤细菌种类较多,并主要集中在养分利用的根际及周边的土壤中,与吴海宁等[1]的结果一致,亦能和研究者课题组前期研究结果减氮处理B能保证常规施肥的产量,各施肥处理中以减氮处理B氮肥农学效率最高,土壤养分剩余较少,氮肥的利用效率较高[16]相互印证。进一步印证合理施氮条件下茶园土壤微生物的种群构成、分布与数量及土壤养分具有良好的调节作用[21]。而施氮量36 kg/667 m2(常规施肥C处理)在非根际20-40 cm土壤中的多样性较高,可能是由于在其非根际土壤中多了两种特异菌:克罗斯耶拉菌与罗尔斯顿菌。主成分分析结果显示CK40、C40样本相较与其它样本而言分布较为分散,样品间距离较远,表明该土层携带更为丰富的物种多样性,与Shannon指数的结果一致,其余样品间的点距离比较近,说明它们的固氮细菌群落结构比较相似。
组间硝化螺旋菌门显著性差异统计情况表明,非根际土壤的硝化螺旋菌门较根际土壤丰度高,非根际土壤中以0-20 cm土壤的硝化螺旋菌门丰度较高,可能是由于茶园常年耕作的深度在20 cm左右,茶园土壤0-20 cm的土层较疏松,同时茶园的养分施用也集中在此土层,所以该土层的土壤微生物特别是固氮微生物较多。与对照比较,根际土壤各处理之间无显著型差异;根际土壤的各施肥处理与非根际0-20 cm土壤的CK处理差异极显著;非根际0-20 cm土壤的减氮处理A、B与CK差异极显著,非根际20-40 cm土壤的减氮A、B处理与非根际0-20 cm土壤CK处理差异极显著,而非根际土壤的常规施肥处理C与对照差异不显著,亦说明常规施肥处理C的土壤中丰度较高,可能是由于硝化螺旋菌门较多,说明可能常规施肥处理C硝化作用较多,而茶树偏好铵态氮[22],不利于其养分的有效利用。土壤碳通量的结果显示以减氮处理B的土壤二氧化碳通量指数最高,与高通量测序结果土壤细菌多样性指数分析的结果基本一致。
4 结论
本研究利用高通量测序技术明确减氮处理B下的细菌种类较多,细菌丰度较高,并主要集中在养分吸收利用的根际及周边土壤中,有利于茶园养分的吸收,土壤二氧化碳通量结果基本一致。虽然常规施肥处理C下的非根际20-40 cm土壤中细菌多样性较多,但其中一部分为克罗斯耶拉菌与罗尔斯顿菌以及促进硝化作用的硝化螺旋菌门,不利于养分的吸收与转化,长期过量施用氮肥对茶园土壤生态系统不利。这为进一步探讨氮肥施用效率机制及开发微生物肥料奠定了基础。