糖酵解调控鸡体外PGCLC形成的功能研究
2021-08-11张晨左其生邹艺琛赵娟娟张亚妮李碧春
张晨 左其生 邹艺琛 赵娟娟 张亚妮 李碧春
(扬州大学农业科技发展研究院 教育部农业与农产品安全国际合作联合实验室 扬州大学动物科学与技术学院,扬州 225009)
原始生殖细胞(primordial germ cell,PGC)的形成需要多种因素的参与,从遗传的角度来说,基因表达、信号传导、表观遗传修饰等都对PGC的形成具有调控作用。不仅如此,Brinster等[1]提出PGC (小鼠)具有特别的能量代谢方式——偏爱丙酮酸氧化而不能氧化葡萄糖。因此代谢变化也可能参与PGC的形成。
相比遗传和表观遗传因素的调控,代谢方式的变化对表型变化的影响更为直接和明显。研究发现能量代谢方式在不同细胞中并不相同,大多的癌细胞中[2]能量代谢方式主要以糖酵解途径为主,氧化磷酸化途径不参与癌症发生过程;而正常细胞通常以线粒体氧化磷酸化产能,而不依赖糖酵解途径[3]。在PGC细胞中也同样表现为氧化磷酸化为主的能量代谢模式[4];在精原干细胞(spermatogonial stem cell,SSC)中,为了维持其自我更新能力,细胞通常利用糖酵解途径进行产能[5]。这种现象提示我们能量代谢模式的改变可能影响细胞的命运决定。重编程过程印证了这一猜想,体细胞的氧化磷酸化代谢转变为iPS的糖酵解依赖代谢模式是多能性获得的基础[6]。因此代谢组的重组可能是引起细胞分化的原因。然而代谢途径的变化在PGC形成中的调控研究尚不明确。
甲萘醌VK3可通过单电子还原反应,产生半醌基团;或通过双电子还原得到氢醌。通过醌的氧化还原循环可产生活性氧簇等,增加氧化还原反应[7]。研究表明,VK3可作为丙酮酸激酶PKM2的专一性抑制剂,而不抑制PKL和PKM1,有效抑制糖酵解途径[8]。然而对VK3功能的研究主要集中在对癌症的抑制效果上[9-10],在细胞分化中的调控作用还未有研究。相反,研究表明[11-12]DASA58可靶向激活PKM2,PKM2是参与糖酵解过程的糖酵解酶,可催化合成丙酮酸和ATP,因此DASA58被认为是糖酵解途径的激活剂,在癌症发生和免疫过程的研究中较为常见,其在细胞分化中的功能还不得而知。
为了研究PGC形成机制,本研究前期建立了BMP4体外诱导模型[13],BMP4能够通过BMP4信号促进体外鸡胚胎干细胞(embryonic stem cells,ESC)向原始生殖细胞样细胞(primordial germ cell,PGCLC)的分化,而BMP4信号抑制糖酵解途径关键激活剂 GSK的功能[14],因此推测糖酵解可能参与PGC的形成。本研究对体外诱导过程中糖酵解相关基因的表达进行检测;在添加糖酵解激活剂和抑制剂后,qRT-PCR检测了相关基因的表达及类胚体/PGC-like的形成,以期为深入研究代谢系统在PGC形成中的调控机制奠定研究基础和提供理论依据。
1 材料与方法
1.1 材料
细胞及主要试剂 新鲜受精蛋来自中国农业科学院家禽研究所试验禽场如皋黄鸡。ESCs由实验室分离所得。高糖DMEM、Knockout培养基、胎牛血清、鸡血清、丙酮酸钠购自Gibco公司(美国);β-巯基乙醇、L-谷氨酰胺、非必需氨基酸、bFGF、hSCF购自Sigma(美国);mLIF 购自millipore(德国);BMP4购自ProSpec(以色列)、VK3购自Macklin(中国)、DASA58购自MCE(美国)。
青链霉素购自(北京)索莱宝科技有限公司;TRNzol Universal 总 RNA 提取试剂、反转录试剂盒、定量试剂盒购自天根生化科技(北京)有限公司;DDX4购自Abcam。
ESC因子培养基:Knockout DMEM+10%胎牛血清+0.1 mmol/L β-巯基乙醇+1 mmol/L丙酮酸钠+2 mmol/L的L-谷氨酰胺+1%非必需氨基酸+1 000 IU/mL LIF+10 ng/mL bFGF+5 ng/mL SCF+1×青链霉素+2%鸡血清。
BMP4诱导培养基:高糖DMEM+1×非必需氨基酸+0.1 mmol/L β-巯基乙醇+1×青链霉素+1 mmol/L丙酮酸钠+ 10 ng/mL LIF+40 ng/mL BMP4+50 ng/mL EGF。
1.2 方法
1.2.1 ESC细胞诱导 收集0 d的种蛋,药匙法获得鸡胚胚盘,ESC因子培养基吹散成细胞悬液,经400目滤布过滤后收集细胞,接种至60 mm培养皿,差速培养12 h,收集上清,接种至24孔板,体外扩增、传代、备用[15-16]。将传至第2代的ESCs以2×105个/孔接种于24孔板中,更换培养基为BMP4诱导培养基,接种至24孔板中,培养6 d,每隔2 d添加200 μL培养基。实验分组为:BMP4组,BMP4+VK3组,BMP4+DASA58组。
1.2.2 细胞形态观察 在细胞诱导的第6天观察细胞形态,分别记录20×10和40×10倍镜下的细胞形态变化并进行拍照。利用Image J对20×10倍镜下的类胚体数量进行统计。
1.2.3 RNA提取 将收集的细胞置于1.5 mL无酶管中,加入1 mL Trizol进行裂解,用移液器吹匀细胞,在室温静置5 min。加入200 mL氯仿,盖紧盖子后,剧烈振荡15 s,室温静置2 min。冷冻离心机中4℃ 12 000×g离心15 min。小心打开管盖,缓慢吸取400 μL上清,加入等体积异丙醇,轻轻混匀,在室温静置10 min。冷冻离心机中4℃ 12 000×g离心10 min,弃去上清。加入1 mL 75%的乙醇,轻轻混匀,此时可见白色RNA沉淀。冷冻离心机中4℃ 7 500×g离心5 min,弃去上清。晾干RNA,加入20 μL无酶水溶解。置于60℃促溶10 min,获 得RNA。
1.2.4 qRT-PCR 分别收集诱导2 d、4 d和6 d的细胞,Trizol裂解后提取RNA。利用天根反转录试剂盒将RNA反转录为cDNA,参照天根实时荧光定量PCR试剂说明书进行定量检测目的基因的表达。引物序列参照表1。
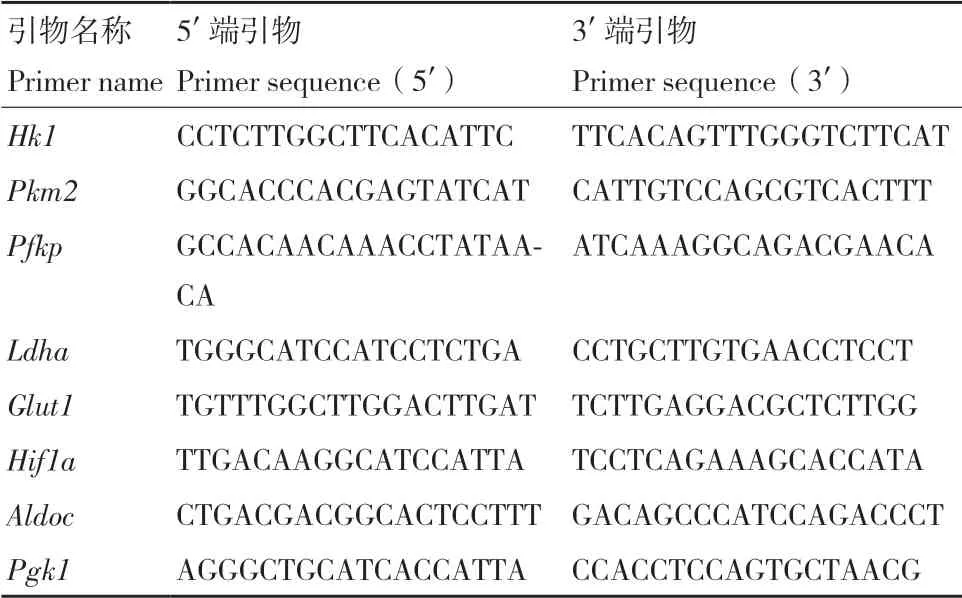
表1 qRT-PCR引物Table 1 Primers used for qRT-PCR
1.2.5 流式细胞分析 收集诱导至6 d细胞,PBS清洗后,加入10%FBS的PBS 37℃封闭2 h,PBS清洗3次后,用一抗进行孵育,37℃孵育2 h或4℃过夜。PBS清洗3次后,用对应的二抗进行孵育,37℃孵育2 h。PBS清洗3次后,上机检测。
1.2.6 数据分析 利用SPSS统计软件建立数据库并处理数据,数据组间差异用单因素方差分析,采用LSD法进行多重比较,试验数据以P<0.05为差异显著,P<0.01为差异极显著。结果以平均值形式表示。
2 结果
2.1 鸡PGC-like细胞形成中糖酵解相关基因低 表达
在体外鸡ESC诱导形成PGC-like的不同时间点对糖酵解过程相关基因的表达进行检测,qRTPCR检测结果显示,诱导第6天时,糖酵解相关基因Pgk1的表达显著降低(P<0.05),Hk1、Pkm2、Ldha、Glut1、Pfkp和Aldoc的表达极显著降低(P<0.01)(图1)。以上结果说明在PGC-like形成过程中糖酵解过程被抑制。
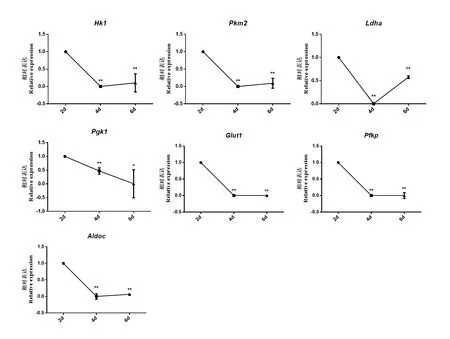
图1 PGC-like形成中糖酵解相关基因的表达Fig. 1 Expression of glycolysis-related genes in the formation of PGC-like
2.2 糖酵解激活剂/抑制剂调控糖酵解过程
为研究糖酵解过程在PGC-like形成中发挥的作用,本研究将糖酵解抑制剂VK3和糖酵解激活剂DASA58加入PGC-like诱导体系中,分别在不同诱导时间点检测糖酵解相关基因的表达。qRT-PCR检测结果显示在诱导第2天时,添加VK3后,糖酵解相关基因Hk1、Pkm2、Glut1、Pfkp、Aldoc表达极显著降低(P<0.01),而添加DASA58后,Ldha和Pfkp表达显著升高(P<0.05),Hk1和Pgk1表达极显著升高(P<0.01)。而在诱导第4天时,添加VK3后,Hk1、Pkm2、Ldha、Glut1、Pfkp、Aldoc和Pgk1表达极显著降低(P<0.01)。诱导第6天时,添加DASA58后,Glut1、Pfkp和Pgk1表达极显著升高(P<0.01)(图2)。以上结果说明糖酵解抑制剂VK3和激活剂DASA58可调控糖酵解过程。
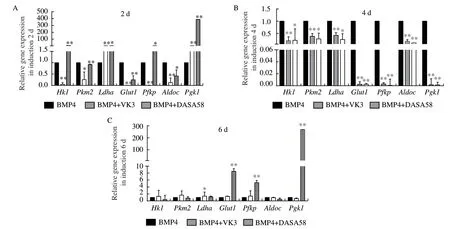
图2 体外诱导过程中糖酵解抑制剂/激活剂对糖酵解相关基因的影响Fig. 2 Effects of glycolysis inhibitors/activators on glycolysis-related genes during the induction in vitro
2.3 糖酵解途径抑制类胚体形成
本研究在BMP4诱导体系中添加VK3和DASA58,并在第6天观察其对类胚体形成的影响。细胞形态学观察显示BMP4诱导后,出现带有囊腔形态的典型类胚体特征细胞,且细胞发生聚团生长的现象;在此基础上,添加VK3后,带有囊腔形态的类胚体数量增加并大量聚团(P<0.01);而添加DASA58后,无典型的类胚体样细胞形成(图3)。以上结果说明抑制糖酵解途径促进类胚体的形成。
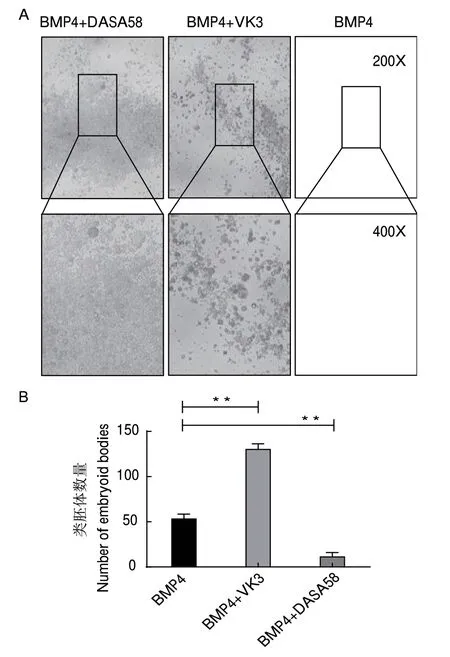
图3 体外诱导过程中糖酵解抑制剂/激活剂对类胚体形成的影响Fig.3 Effect of glycolysis inhibitor/activator on embryoid body formation during the induction in vitro
2.4 糖酵解途径抑制PGC-like形成
研究表明PGC-like形成经历类胚体过程,类胚体中能表达PGC标记基因的细胞可称为PGC-like。本研究前期已证明DDX4能够作为标记PGC的特异蛋白进行流式分析。因此,在BMP4诱导过程中添加VK3和DASA58后第6天收集细胞,流式分析检测PGC-like的阳性比例,结果显示当添加VK3后,PGC-like的阳性数量显著升高(P<0.05),而添加DASA58后,阳性细胞数量显著降低(P<0.05)(图4)。以上结果说明糖酵解途径抑制体外PGC-like 的形成。
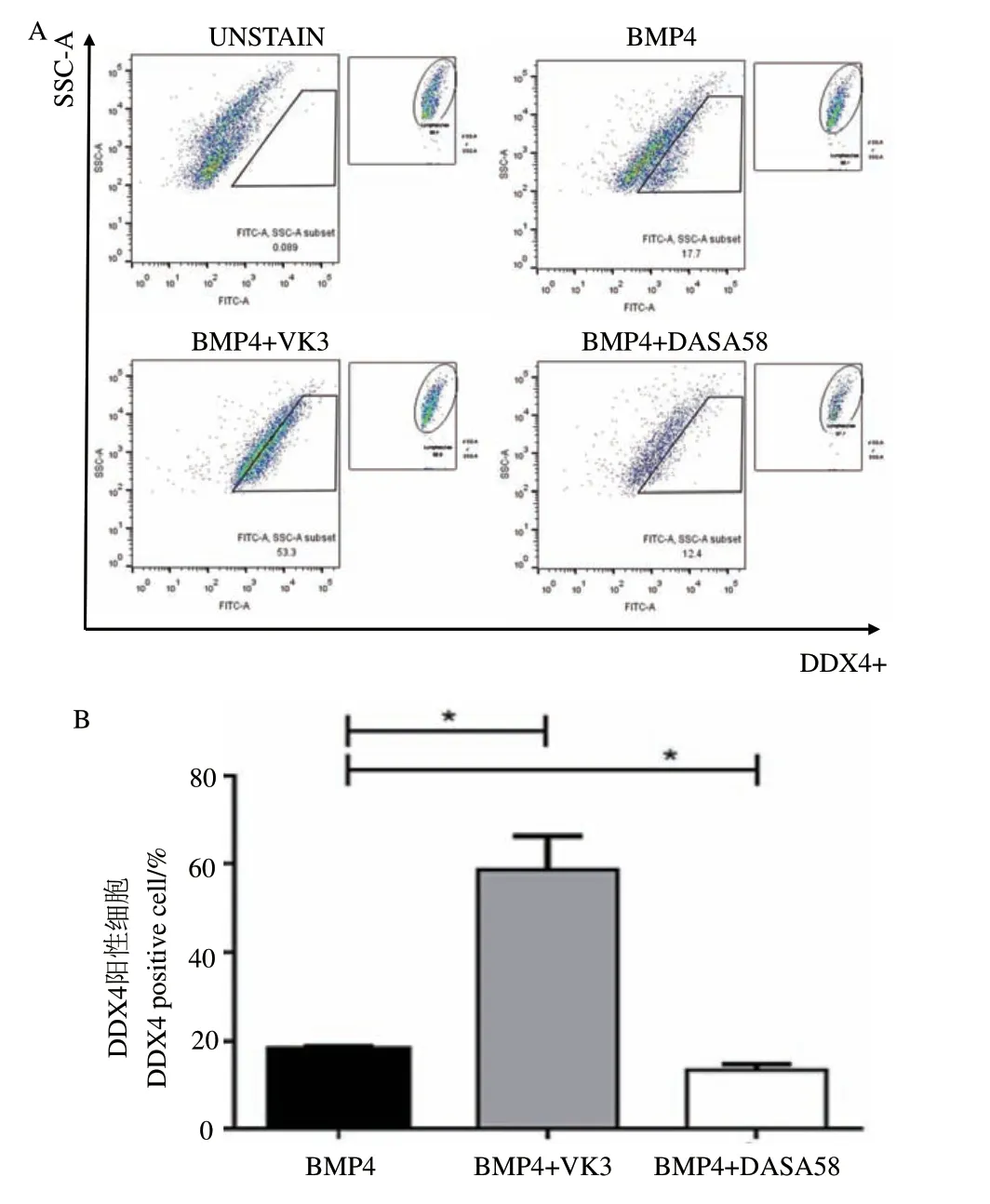
图4 体外诱导过程中糖酵解抑制剂/激活剂对PGC-like形成的影响Fig. 4 Effect of glycolysis inhibitor/activator on PGC-like formation during the induction in vitro
3 讨论
糖酵解关键酶的表达影响糖酵解效率参与生物学过程,常见的糖酵解关键酶包括HK1/2、5-甘油醛-3-磷酸脱氢酶(GAPDH)、6-磷酸果糖-1/2-激酶(PFK1/2)、GLUT-1和LDH-A等,这些关键酶的上调往往造成较高的糖酵解率,在癌症和重编程过程中较为常见[17-19]。糖酵解关键酶(如Pglym78/pgam2)功能的丧失对成肌细胞融合能力(果蝇和斑马鱼胚胎)也会有所影响。本研究发现与心脏发育过程中糖酵解系统的正面调控作用不同[20],在体外鸡PGC-like形成中糖酵解基因的mRNA表达普遍下降,可能由于在干细胞中糖酵解系统具有不同的表达模式。结合Zhou等[21]发现的ES细胞的能量生产具有二价特征,会根据需要从糖酵解转换为线粒体呼吸。本研究推测体外ESC向PGC-like诱导分化过程中,以糖酵解为主要能量代谢途径的模式逐渐瓦解,细胞转化为线粒体呼吸。这一推测还需要进一步对线粒体呼吸相关指标进行检测。
研究报道,甲萘醌VK3通过激活氧化还原反应抑制糖酵解过程[22-31]。本研究发现添加VK3后,有效抑制糖酵解相关基因的表达,暗示其可能对氧化磷酸化过程起激活作用。而DASA58作为PKM2的激活剂,在本研究中未出现显著激活PKM2的结果,可能是检测时间点过晚或是40 μmol/L的工作浓度难以满足激活PKM2的需要。同时,本研究还观察到添加DASA58后,Glut1、Pfkp、Pgk1的表达有所上升,说明DASA58的加入确实影响糖酵解系统的稳态,对糖酵解途径具有一定的激活作用。
能量代谢确实影响细胞的命运决定。ESC细胞往往以糖酵解途径为主要代谢方式,因此培养液中高浓度的葡萄糖有利于ESC的增殖,而葡萄糖浓度的变化则会影响ESC的分化[32-34]。研究表明AMP激活的蛋白激酶(AMPK)激活剂AICAR能启动ATP产生的分解代谢途径,抑制小鼠类胚体的形成[35]。本研究发现体外鸡PGC-like形成中糖酵解相关基因表达降低;抑制糖酵解过程促进类胚体形成,激活糖酵解后类胚体形成减少。类胚体是PGClike形成的必经阶段,糖酵解途径对类胚体形成的调控暗示其对PGC-like的形成也有相似的调控模式。本研究通过流式分析也证明了这一点。这种能量代谢的调控模式与小鼠体内PGC形成过程氧化磷酸化升高、糖酵解降低的模式不谋而合。说明糖酵解过程不是体内外PGC形成所必需的,相反,氧化磷酸化可能在体内外PGC形成中起主导作用。然而PGC形成过程涉及多种调控因素,其中能量代谢的调控机制仍需进行深入挖掘。
4 结论
本研究发现ESC向PGC-like诱导过程抑制了糖酵解相关基因的表达。在添加VK3后糖酵解基因表达降低,促进类胚体/PGC-like的形成;而添加DASA58后,Glut1、Pfkp、Pgk1的表达升高,抑制类胚体/PGC-like的形成。本研究可为后续研究体内外PGC形成中能量代谢调控模式提供参考和理论。