单倍体甜瓜染色体加倍技术研究
2021-08-10高宁宁李晓慧康利允梁慎常高正李海伦王慧颖王琰徐小利赵卫星
高宁宁 李晓慧 康利允 梁慎 常高正 李海伦 王慧颖 王琰 徐小利 赵卫星


摘 要:探究秋水仙素对甜瓜单倍体加倍的影响,以便为甜瓜遗传育种研究提供新材料。以甜瓜大孢子离体培养获得的单倍体为试材,利用不同浓度秋水仙素直接加入培养基和浸芽后接种到芽伸长培养基两种方法进行甜瓜单倍体的加倍试验。70 mg·L-1秋水仙素直接加入培养基加倍频率最高为37%,组培苗成活率为67%,700 mg·L-1秋水仙素附加1.5% DMSO浸芽处理2 h加倍频率最高可达58%,成活率为100%。在不添加秋水仙素的培养基中,添加0.2 mg·L-1 KT加倍率为8%~17%,表明激素KT也能诱导单倍体植株加倍。加倍植株经流式细胞仪倍性鉴定,发现除存在单倍体、二倍体外,还存在混倍体,100 mg·L-1秋水仙素浸芽处理6 h嵌合体的比例最高为75%。结果表明,秋水仙素浸芽处理效果好于直接加入培养基,700 mg·L-1秋水仙素浸芽处理2 h加倍频率最高为58%。
关键词:甜瓜;单倍体;秋水仙素;染色体加倍
中图分类号:S652 文献标志码:A 文章编号:1673-2871(2021)06-028-05
Study on chromosome doubling technique of haploid muskmelon
GAO Ningning, LI Xiaohui, KANG Liyun, LIANG Shen, CHANG Gaozheng, LI Hailun, WANG Huiying, WANG Yan, XU Xiaoli, ZHAO Weixing
(Henan Academy of Agricultural Sciences, Horticulture Institute, Zhengzhou 450002, Henan, China)
Abstract: In order to explore the effect of colchicine on haploid doubling of muskmelon and provide new materials for the genetic and breeding research, the haploid muskmelon obtained from megaspore culture in vitro was used as the test material. The haploid doubling test of muskmelon was conduced by adding colchicine with different concentrations to the medium and immersing the buds with colchicine then inoculated into the medium of bud elongation. The maximum doubling frequency of 70 mg·L-1 colchicine directly added to the medium was 37%, and the survival rate of tissue cultured seedling was 67%. The maximum doubling frequency of 700 mg·L-1 colchicine plus 1.5% DMSO immersing buds for 2 h was up to 58%, and the survival rate was 100%. The doubling rate of adding 0.2 mg·L-1 KT to the medium without colchicine was 8%-17%, which indicated that KT could also induce the doubling of haploid plants. In addition to haploid and diploid plants, there were also mixoploid plants by flow cytometry identification. The proportion of chimeras was the highest, up to 75% by immersing buds in 100 mg·L-1 colchicine solution for 6 h. The results suggested that the effect of colchicine immersing buds was better than that of adding directly into the medium, and the doubling frequency was the highest, up to 58% by immersing buds in 700 mg·L-1 colchicine solution for 2 h.
Key words: Muskmelon; Haploid; Colchicine; Chromosome doubling
甜瓜(Cucumis melo L.)屬于葫芦科,是世界十大水果之一,我国拥有丰富的甜瓜资源,但遗传基础狭窄。利用常规育种手段进行甜瓜品种改良的周期长且效率低,单倍体材料的基因型和表现型完全一致,经过染色体加倍后可产生纯合的二倍体植株,利用单倍体诱导技术可大大提高育种效率,缩短育种周期。另外,纯系群体具有重要的遗传学研究价值,可应用于基因定位、克隆以及遗传图谱的构建等。单倍体植株可以通过人工诱导获得,也可以自发产生,但在自然界中自发产生单倍体的频率极低[1]。人工诱导染色体加倍常用的试剂主要是秋水仙素,其能够阻止微管的聚合,从而抑制纺锤丝的形成,使染色体不能分向两极,导致新生细胞染色体加倍。之后发现萘啶乙烷、吲哚乙酸、藜芦碱等植物碱、黄草消和氟乐灵等除草剂、植物激素等[2-3]也可以诱导染色体加倍,加倍试剂中通常添加二甲基亚砜(DMSO)来提高加倍效率。染色体加倍常采用的方法有浸泡法、注射法、组织培养法等[4]。1979 年,白守信等[5]利用秋水仙素对单倍体小麦加倍获得成功,是国内最早的有关单倍体加倍的研究报道。目前,利用秋水仙素进行单倍体加倍的研究在玉米[6-8]、小麦[9]、黄瓜[10]、甜瓜[11-13]等作物上均有报道。对甜瓜单倍体诱导,由于单倍体植株获得的频率较低,前人对甜瓜单倍体植株染色体加倍的研究较少。在甜瓜单倍体加倍研究中,不同基因型材料相同化学试剂处理加倍率差异较大,加倍率受不同基因型材料的影响较大,且加倍率较低、嵌合体发生频率高。前人的研究大多集中在移栽后对单倍体植株进行加倍方面,但受到环境和植株生长周期的影响较大。因此,笔者以甜瓜大孢子培养获得的单倍体为材料,利用组织培养法将不同浓度秋水仙素加入培养基和不同浓度秋水仙素浸泡离体芽时间长短对单倍体进行加倍,探究最佳的秋水仙素加倍浓度和时间,以获得纯合的二倍体植株,为甜瓜新品种选育和遗传研究提供材料。
1 材料和方法
1.1 材料
以厚皮甜瓜品种将军玉(市场上已推广的杂种1代)大孢子离体培养诱导出的单倍体植株(经流式細胞仪倍性鉴定)为材料[14],研究不同浓度的秋水仙素在甜瓜单倍体加倍中的效果。材料由河南省农业科学院园艺研究所西瓜甜瓜研究室提供。
1.2 方法
1.2.1 秋水仙素加入培养基加倍 以甜瓜芽伸长培养基(MS+0.2 mg·L-1 KT+15%椰汁)作为基础培养基,在其中分别添加不同质量浓度的秋水仙素 (0、30、50、70、100 mg·L-1)制成加倍培养基,在超净工作台切单倍体植株芽生长点1 cm左右,接种到加倍培养基中,在温度(25±2)℃、光照度3000~4000 lx、光照时间16 h·d-1的条件下培养15 d后,转入芽伸长培养基中。试验共5个处理,每个处理接种4个单倍体离体芽,3次重复。培养30 d后,统计加倍处理后幼苗的成活数。成活率=成活植株数/处理植株数×100%。
1.2.2 秋水仙素浸泡离体芽加倍 在超净工作台上切取单倍体植株的芽生长点1 cm左右,置于过滤灭菌的不同质量浓度的秋水仙素(0、100、400、700、1000 mg·L-1)与1.5%的二甲基亚砜(DMSO)的混合溶液中分别浸泡8 h和6 h、8 h和6 h、6 h和4 h、4 h和2 h、2 h和1 h,用过滤灭菌的1.5%的DMSO浸泡8 h、6 h作为对照,无菌水冲洗3次后接种到芽伸长培养基上进行培养。试验共10个处理,每个处理接种4个单倍体离体芽,3次重复。培养条件同上,培养30 d后,统计加倍处理后幼苗的成活数。
1.2.3 单倍体加倍植株的倍性鉴定 切取一片新长出的嫩叶,利用德国PARTEC公司生产的CyFlowR Cube 8流式细胞仪对处理成活的植株进行倍性鉴定,以未经秋水仙素处理的单倍体植株作为对照,并计算加倍率。加倍率=加倍植株数/处理存活植株数×100%。
1.2.4 二倍体植株生根及移栽驯化 将加倍成功的植株转接到芽生根培养基1/2MS+IAA(0.1、0.2 mg·L-1),待长出粗壮根系后,将其从培养瓶中取出,洗去根上附着的培养基,在清洗时要轻,防止将根系折断。然后,将植株移栽到含有草炭、蛭石等的基质中,于(25±2)℃温室中驯化7~15 d,最后移栽到田间。
1.3 数据处理
采用Excel 2007进行数据统计,SPSS 22软件进行方差分析,采用FCS Express V3软件对流式数据进行作图。
2 结果与分析
2.1 秋水仙素加入培养基加倍分析
试验将不同浓度的秋水仙素添加到芽伸长培养基中,对甜瓜单倍体芽进行加倍处理,利用流式细胞仪进行倍性鉴定。结果表明(表1),随着秋水仙素质量浓度的升高,其加倍率也有所上升,70 mg·L-1秋水仙素加倍率最高可达37%,但秋水仙素为100 mg·L-1时又下降至17%,且成活率最低为50%,植株叶片易黄化枯萎,说明高浓度的秋水仙素对植株有毒害作用。倍性鉴定表明,除单倍体(图1-A、B)、二倍体(图1-A、D)外,还存在n+2n的混倍体(图1-A、C),每个处理中单倍体的占比最高,混倍体占比最低,随着处理浓度的升高,混倍体的比例也升高,最高可达25%,但秋水仙素质量浓度为100 mg·L-1时下降至0。从试验结果看,在不添加秋水仙素的芽伸长培养基上,仅添加0.2 mg·L-1的KT,植株成活率为100%,加倍率为8%,表明细胞分裂素KT在一定程度上可以诱导单倍体植株加倍。
2.2 秋水仙素浸泡离体芽加倍分析
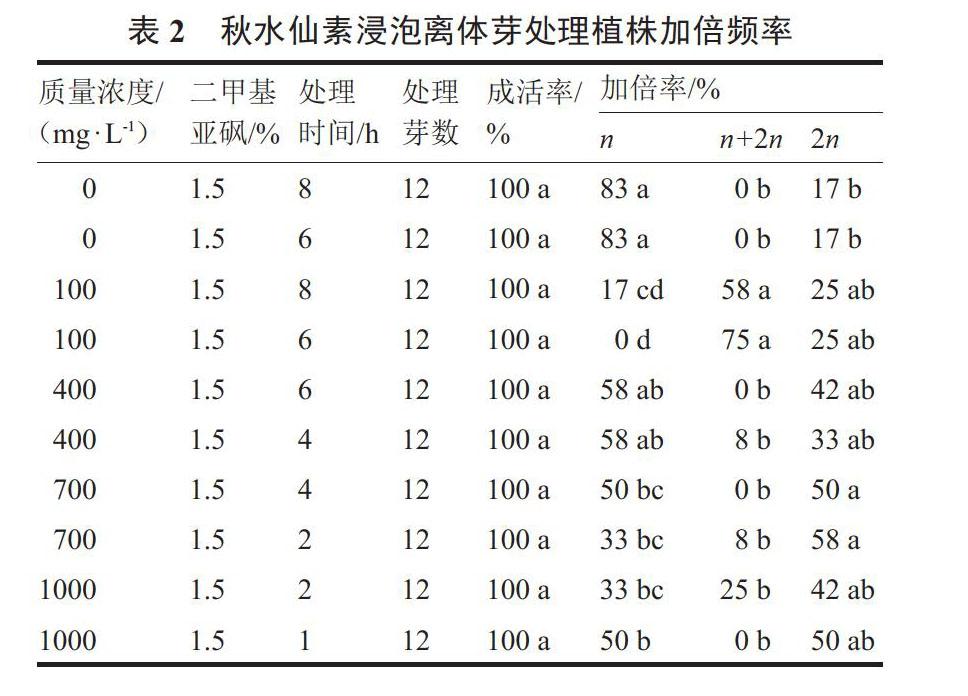
试验利用不同浓度的秋水仙素和1.5%DMSO混合液浸泡离体芽生长点,进行染色体加倍处理,芽成活率均为100%。流式细胞仪倍性鉴定结果显示(表2),700 mg·L-1秋水仙素处理2 h加倍频率最高为58%,其次为秋水仙素700 mg·L-1处理4 h和1000 mg·L-1处理1 h,其加倍频率为50%,低质量浓度秋水仙素100 mg·L-1处理8 h和6 h,加倍频率最低,为25%。随着秋水仙素质量浓度的升高,加倍频率也逐渐升高,但在质量浓度为1000 mg·L-1时,又有所下降,且再生苗后期黄化较为严重。从浸泡处理时间来比较,低质量浓度400 mg·L-1秋水仙素处理时,浸泡时间长加倍频率高,高质量浓度700 mg·L-1和1000 mg·L-1秋水仙素处理时,浸泡时间短加倍频率高,表明高浓度秋水仙素对再生苗的生长有一定的抑制作用。同时,试验发现利用100 mg·L-1秋水仙素处理8 h和6 h,混倍体出现概率较高分别为58%和75%,其次为1000 mg·L-1秋水仙素处理2 h,其混倍体的概率为25%。在不添加秋水仙素仅用DMSO浸泡8 h和6 h的芽,加倍率为17%,表明培养基中的KT能够诱导单倍体植株加倍,经过DMSO浸泡处理提高了加倍频率。
2.3 离体植株生根、移栽及驯化
将单倍体加倍获得的二倍体植株(图2-A)在添加0.1、0.2 mg·L-1 IAA的1/2MS培养基上培养,结果表明,IAA质量浓度为0.1 mg·L-1时,植株根系生长较快且健壮(图2-B),IAA质量浓度为0.2 mg·L-1时,植株根系生长慢且细弱,高浓度的IAA抑制根的形成。移栽时,将根系上的培养基清洗干净(图2-C),防止移栽后污染而导致根系腐烂,随后移栽到盆栽基质中(图2-D),覆盖塑料膜保温、保湿,温度保持在25℃左右,驯化7~15 d,成活率为65%,移栽到田间(图2-E、F),移栽成活率为92%。
3 讨论与结论
秋水仙素加倍是秋水仙素与正在分裂的植物幼嫩组织细胞接触,通过维管系统在植物体内迅速扩散,抑制纺锤丝的形成,使细胞整齐地阻止在分裂中期,实现植物染色体加倍 [15-16]。笔者在本研究中利用组织培养法将不同浓度秋水仙素加入培养基和不同浓度秋水仙素浸泡离体芽时间长短对单倍体进行加倍,发现利用秋水仙素浸泡离体芽之后接入芽伸长培养基加倍效果好于秋水仙素直接加入培养基,秋水仙素浸芽处理加倍频率最高可达58%,成活率为100%,而直接加入培养基加倍频率最高为37%,植株成活率较低(在50%~75%之间),且植株叶片易黄化,说明秋水仙素加入培养基长时间的吸收渗透对单倍体芽产生了一定的毒害作用,使植株的再生能力变差,这跟贾媛媛等[17]将秋水仙素加入培养基对甜瓜单倍体加倍研究和付文苑等[10]对黄瓜单倍体加倍研究的结论一致。
将不同浓度的秋水仙素添加到芽伸长培养基中,对甜瓜单倍体芽进行加倍处理,随着秋水仙素浓度的升高,其加倍率也有所上升,70 mg·L-1秋水仙素加倍率最高可達37%,但秋水仙素质量浓度为100 mg·L-1时又下降至17%,研究结果高于贾媛媛等[17]将甜瓜单倍体芽放入添加不同浓度秋水仙素培养基中获得的最高7.8%的加倍率,同时也高于付文苑等[10]用1000 mg·L-1的秋水仙素添加到培养基中的研究,植株全部死亡,加倍率为0;但低于Bouvier等[18]对苹果单倍体加倍的研究,利用低质量浓度10 mg·L-1秋水仙素处理30 d,加倍频率高达77.8%,这可能与作物种类及秋水仙素浓度不同有关。在不添加秋水仙素的培养基中,添加0.2 mg·L-1 KT加倍率可达8%,这与许衡[19]利用秋水仙素诱导多倍体的研究结果一致,添加0.2 mg·L-1 KT的培养基能够提高植物变异率,认为可能是由于KT有利于促进细胞分裂,从而使处于有丝分裂时期的细胞增多。在倍性鉴定中发现除存在单倍体、二倍体植株外,还存在混倍体。前人Lotfi等[20]用500 mg·L-1秋水仙素处理6 h混倍体的概率高达86%,在本研究的培养基中添加70 mg·L-1秋水仙素嵌合体的比例最高可达25%,100 mg·L-1秋水仙素浸芽处理6 h嵌合体的比例最高可达75%,原因可能是秋水仙素处理过程中有丝分裂不稳定而有混倍组织产生。
利用不同浓度的秋水仙素和1.5%DMSO混合液浸泡离体芽生长点,进行染色体加倍处理。随着秋水仙素浓度的升高,加倍频率也逐渐升高,但在质量浓度为1000 mg·L-1时,又有所下降。秋水仙素低质量浓度100 mg·L-1处理8 h和6 h,加倍频率最低为25%;700 mg·L-1秋水仙素处理2 h,加倍频率最高为58%。研究结果高于贾媛媛等[17]和张永兵等[21]利用250 mg·L-1秋水仙素溶液浸泡甜瓜单倍体芽8 h的处理,加倍率分别为13.7%和29.4%,说明在本研究中设置的秋水仙素质量浓度700 mg·L-1处理2 h效果较好,比前人研究的甜瓜单倍体加倍率分别提高了3.2倍和1.0倍。但低于Yetisir等[11]利用500 mg·L-1秋水仙素浸泡甜瓜离体芽的加倍率(90%),及付文苑等[10]利用0.1%的秋水仙素加5%的DMSO处理黄瓜茎尖1 h的加倍率(72.5%),这可能与不同基因型材料及秋水仙素使用浓度有关,有研究表明不同基因型材料的单倍体染色体加倍率差异较大[22]。在不添加秋水仙素仅用DMSO浸泡8 h和6 h的芽,其加倍率为17%,比未经浸泡芽的加倍率提高了1.1倍,表明芽分化培养基中添加激素KT能够诱导单倍体植株加倍,经过DMSO浸泡处理提高了其加倍率。Sanders等[23]在悬钩子染色体加倍液中加入DMSO,加倍率提高了4 倍。DMSO是一种助渗剂,本身对染色体的加倍没有作用,但是可以提高植物组织的穿透力,促进秋水仙素、KT等渗入分生组织,进而提高加倍效率[5]。
单倍体植物可以在短时间内获得纯合的二倍体,快速选育自交系,提高育种效率。因此,提高单倍体加倍效率是今后研究的重点。笔者在本研究中建立的组织培养染色体加倍及再生体系,不受环境以及植株生长发育周期的影响,将为甜瓜遗传育种和基础研究等提供新材料,提高甜瓜育种效率,快速实现育种目标。
参考文献
[1] MALLARD J,DECOMBLE V,SAVIN F,et al.The X-ray detection of haploid embryos arisen in muskmelon(Cucumis melo L.)seeds, and resulting from a parthenogenetic development induced by irradiated pollen[J].Cucurbit Genetics Cooperative Report,1998,11:39-42.
[2] HANSEN N J P,ANDERSEN S B.In vitro chromosome doubling potentialof colchicine,oryzalin,trifluralin,and APM in Brassica napus microspore culture[J].Euphytica,1996,88:159-164.
[3] 孙敏红,张蜀宁.多倍体育种在园艺作物中的应用[J].江苏农业科学,2004(1):68-72.
[4] 郭书磊,魏昕,魏良明,等.玉米单倍体诱导、加倍技术及相关机理探讨[J].玉米科学,2020,28(3):52-59.
[5] 白守信,刘翠云,张振刚,等.单倍体小麦染色体加倍的研究[J].遗传学报,1979,6(2):230-232.
[6] VIJAY C,MANJE G,LEOCADIO M,et al.Improving the efficiency of colchicine-based chromosomal doubling of maize haploids[J].Plants,2020,9(4):459-471.
[7] 慈佳宾,杨巍,任雪娇,等.玉米单倍体诱导及化学加倍方法的研究[J].华南农业大学学报,2015,36(3):49-53.
[8] 王志永,郑淑云,吴金鑫,等.玉米单倍体自然加倍与化学加倍研究[J].玉米科学,2015,23(6):18-20.
[9] 李文灼,郝峥嵘,崔建平,等.激素对小麦和小黑麦杂交后代花药培养和染色体加倍的影响[J].复旦学报(自然科学版),1998,37(4):573-576.
[10] 付文苑,唐兵,邓英,等.辐射花粉授粉诱导黄瓜单倍体及染色体加倍[J] .分子植物育种,2019,17(21):7150-7155.
[11] YETISIR H, SARI N.A new method for haploid muskmelon(Cucumis melo L.)dihaploidization[J].Scientia Horticulture,2003,98 (3):277-283.
[12] KOKSAL N,YETISIR H,SARI N,et al.Comparison of different in vivo methods for chromosome duplication in muskmelon(Cucumis melo)[J].Acta Horticulturae,2002,588:293 -298.
[13] ABAK K,SARI N,PAKSOY M,et al.Genotype response to haploid embryo induction with pollination by irradiated pollens in melon,obtaining of dihaploid lines, determination of haploid and diploid plants by different techniques[J].Turkish Joural of Agriculture and Forestry,1996,20:425-430.
[14] 高宁宁,李晓慧,康利允,等.厚皮甜瓜未受精子房离体培养获得胚囊再生植株[J].果树学报,2020,37(7):1036-1045.
[15] 陈绍江,黎亮,李浩川,等.玉米单倍体育种技术[M].2版.北京: 中国农业大学出版社,2012:3.
[16] 敬成俊,李昌庭,邓亚平,等.秋水仙素间断式诱导植物多倍体研究[J].西南大学学报(自然科学版),2013,35(7):46-51.
[17] 贾媛媛,张永兵,刁卫平,等.双单倍体甜瓜的获得及其初步定性研究[J].江苏农业科学,2008(1):116-118.
[18] BOUVIER L,FILLON F R,LESPINASSE Y.Oryzalin as an efficient agent for chromosome doubling of haploid apple shoots in vitro[J]. Plant Breeding,1994,113:343-346.
[19] 许衡.观赏植物的多倍体诱导及生物学性状的研究[D].山东泰安:山东农业大学,2000.
[20] LOTFI M,ALAN A R,HENNING M J,et al.Production of haploid and doubled haploid plants of melon(Cucumis melo L.)for use in breeding for multiple virus resistance[J].Plant Cell Reports,2003,21(11):1121-1128.
[21] 张永兵.甜瓜细胞遗传学、单倍体创制及抗蔓枯病分子标记[D].南京:南京农业大学,2007.
[22] 刘晓鑫,杨巍,慈佳宾,等.不同基础材料和秋水仙素濃度对玉米单倍体加倍率的影响[J].吉林农业大学学报,2015,37(2):136-140.
[23] SANDERS J,HULL J W.Dimethyl sulfoxide as an adjuvant of colchicine in the treatment of Rubus seeds and shoot apices[J].Horticultural Science,1970,5:111-112.
