绵羊乳酪蛋白血管紧张素转换酶抑制肽的制备与鉴定
2021-08-09葛武鹏宋宇轩谢玉霞汤海霞王海燕王爽爽
张 艳,葛武鹏,宋宇轩,谢玉霞,汤海霞,王海燕,王爽爽
(1.富平县检验检测中心,陕西省羊乳产品质量监督检验中心,陕西 富平 711700;2.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100;3.西北农林科技大学动物科技学院,陕西 杨凌 712100)
近10 年来,随着人们生活方式的快速转变、人口老龄化的加重及不健康生活习惯的影响,心血管疾病越来越普遍,世界卫生组织报告显示,每年约有1 750 万人死于心血管疾病,高血压是一种对人类心血管健康威胁最大的疾病,全球有1/3的成年人具有患高血压的危险[1-3]。根据我国第5次高血压调查结果,中国成人高血压患病率为23.2%,患病人数达2.45 亿,患病率随年龄增加而升高,男性高于女性[4-5]。如何有效控制心血管疾病的患病率,已成为全世界关注的重大问题。
血管紧张素转换酶(angiotensin converting enzyme,ACE)通过肾素-血管紧张素系统(renin-angiotensin system,RAS)和激肽释放酶-激肽系统(kinin-kallikrein system,KKS)在体内发挥调节血压作用,在RAS中,血管紧张素Ⅱ可通过ACE从血管紧张素Ⅰ中切割C端二肽释放,在KKS中,ACE还可以通过去除2 个C端二肽来灭活缓激肽[6-7]。ACE可催化血管紧张素Ⅰ转变为具有血管收缩功能的血管紧张素Ⅱ,从而引起血压升高,因此,通过抑制ACE的活性可以有效降低高血压。目前市场上广泛使用卡托普利、来诺普利、依那普利等降压药物来抑制ACE活性,进而实现临床上的降血压作用,但上述化学合成药物都会有一定的副作用,如低血压、咳嗽、钾含量升高、肾功能减弱和胎儿异常等[8-9]。目前已报道的天然食源性ACE抑制肽主要来源于乳蛋白、鸡蛋蛋白、大豆蛋白、高粱蛋白、鱼蛋白和肌肉蛋白等[10-12]。相比化学合成药物,天然食源性ACE抑制肽具有更安全、种类多、易制备的特点,可作为辅助治疗高血压的一种更健康、更自然的替代来源。
乳源衍生肽可发挥多种调节作用,如具有抗氧化、降压、抗菌、抗癌、免疫调节等不同生物活性。ACE抑制肽的制备方法主要有酶解、微生物发酵和化学合成,前2 种的应用更加广泛[13-14]。绵羊乳中含有丰富的酪蛋白,含量约占总蛋白的80%,已有研究从羊乳酪蛋白水解物中分离鉴定出许多生物活性肽,尤其是ACE抑制肽。Ibrahim等[15]从山羊乳酪蛋白中分离鉴定出2 个肽,分别为QSLVYPFTGPI(来自β-CN)和ARHPHLSFM(来自κ-CN),二者在体外均显示出有效的ACE抑制活性。舒国伟[16]从山羊乳酪蛋白中鉴定出4 种新的ACE抑制肽SKK、RHPHPH、YFYPQ和LSQPKVLP,其分别来自αs2-CN、κ-CN、αs1-CN和β-CN。目前,乳源生物活性肽是国内外研究热点,而针对绵羊乳酪蛋白来源的ACE抑制肽研究较少,因此利用绵羊乳制备ACE抑制肽符合目前功能性乳制品的发展趋势。本研究以绵羊乳酪蛋白作为目标蛋白,通过水解法筛选具有ACE抑制作用的生物活性肽。首先利用中性蛋白酶水解绵羊乳酪蛋白,利用液相色谱-质谱联用技术对水解物进行分析和鉴定,筛选具有潜在ACE抑制作用的生物活性肽,为绵羊乳酪蛋白开发生物活性肽提供一定理论依据。
1 材料与方法
1.1 材料与试剂
绵羊乳取自甘肃省金昌奶绵羊试验示范基地。
中性蛋白酶(0.8 AU/g) 诺维信(中国)投资有限公司;L-丝氨酸、邻苯二甲醛 北京索莱宝科技有限公司;马尿酸-组氨酸-亮氨酸(Hip-His-Leu,HHL)上海麦克林生化科技有限公司;ACE、乙腈(色谱级)美国Sigma-Aldrich公司;其他试剂均为国产分析纯。
1.2 仪器与设备
AKTA蛋白质分离纯化系统 美国通用GE集团;FG2 pH计 瑞士Mettler-Toledo公司;LGJ-25C真空冷冻干燥机 北京四环科学仪器厂;HC-3618R高速冷冻离心机 安徽中科中佳公司;Orbitrap Fusion Lumos Tribrid MS超高压液相色谱飞行时间质谱仪 赛默飞世尔科技公司;1100高效液相色谱仪 美国安捷伦科技公司;UV-1900紫外分光光度计 日本岛津制作所。
1.3 方法
1.3.1 绵羊乳酪蛋白制备
取绵羊乳于4 ℃、5 000×g条件下离心30 min,除去上层脂肪,用1 mol/L HCl调节pH值至4.2,室温下静置40~60 min,相同条件下再次离心10 min,除去上清,沉淀则为酪蛋白粗品,依次用1 mol/L HCl和蒸馏水多次清洗,将其冷冻干燥,即可得到绵羊乳酪蛋白。
1.3.2 绵羊乳酪蛋白水解
选择中性蛋白酶水解酪蛋白,水解方法参照Cui Pengfei等[17]的方法并稍作修改。将制备好的绵羊乳酪蛋白用超纯水复溶,溶液质量浓度5 g/100 mL,随后将该溶液55 ℃水浴10 min,用1 mol/L氢氧化钠溶液调节pH值至7.0,然后向该溶液中加入3 g/100 mL中性蛋白酶,55 ℃水浴酶解90 min,酶解过程中,pH值和水浴温度保持恒定。间隔30 min取样1 次,在95 ℃条件下灭酶15 min,迅速冷却,在4 ℃、10 000×g条件下离心15 min,取上清液,置于-20 ℃冰箱保存备用,进行后续水解度和ACE抑制率测定。
1.3.3 水解度测定
参考封张萍等[18]报道的邻苯二甲醛法。
1.3.4 ACE抑制率测定
参考纪钱萍等[19]的方法对ACE抑制率进行测定,并稍有修改。
1.3.5 多肽序列分析
研究发现,小分子质量的肽可能具有更高的活性。因此,利用超滤浓缩管选择分子质量小于3 kDa的酪蛋白水解物。参考Tu Maolin等[3]的方法,利用超高效液相色谱飞行时间质谱仪分析酪蛋白水解产物中的肽。利用在线工具数据库Uniprot、NCBI、Expasy、BIOPEP、AHTPDB、SwePep、EROPMoscow和PeptideDB进行搜索比对,其中从NCBI数据库下载数据,使用Expasy预测肽的分子质量和等电点,进行生物学信息比对分析。
1.3.6 目标活性肽半抑制浓度(50% inhibiting concentration,IC50)测定
通过对比BIOPEP数据库和文献[16]报道的ACE抑制肽,选择具有潜在抑制活性的生物肽进行IC50测定。
1.3.7 ACE抑制模式测定
参照Forghani等[20]的方法,使用双倒数曲线作图,用Lineweaver-Burk图对筛选的YYQQRP肽进行抑制模式探究,将YYQQRP肽浓度设定为0、5、12 mmol/L,底物HHL浓度设定为0.5、2.0、2.5、3.5 mmol/L,与ACE按1.3.4节方法混合反应,测定水解产物(马尿酸)的含量,根据酶促反应速率的倒数(1/v)与底物浓度的倒数(1/S),通过Lineweaver-Burk图中的斜率和截距计算最大反应速率(vm)和抑制常数(Km)。
1.4 数据处理
采用Origin 9.0软件对数据进行处理并绘图。
2 结果与分析
2.1 酶解时间对酪蛋白水解度的影响
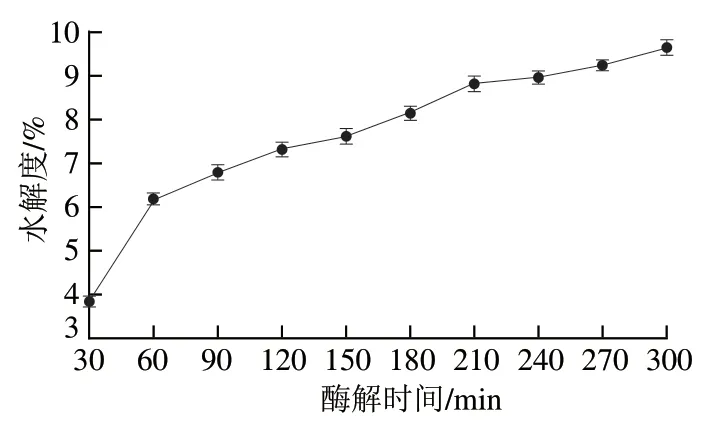
图1 酶解时间对酪蛋白水解度的影响Fig. 1 Effect of hydrolysis time on degree of hydrolysis of casein
利用中性蛋白酶水解绵羊乳酪蛋白,酶解时间对绵羊乳酪蛋白的水解度存在一定影响。由图1可知,随着酶解时间的延长,酪蛋白水解度逐渐升高,酶解时间为30~210 min,绵羊乳酪蛋白水解度从3.84%增加至8.81%,当酶解时间达到300 min,水解度达到最高值9.65%,表明酶解时间的延长使得绵羊乳酪蛋白结构得到充分破坏[21],引起酪蛋白水解度的逐渐升高。
2.2 酶解时间对酪蛋白水解产物ACE抑制率的影响
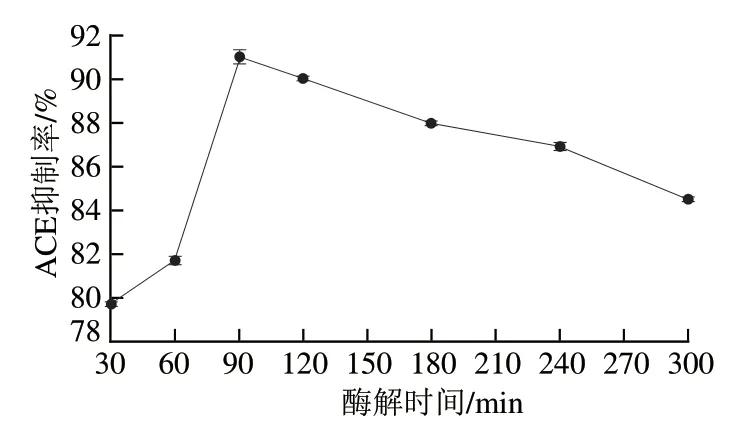
图2 酶解时间对酪蛋白水解产物ACE抑制率的影响Fig. 2 Effect of hydrolysis time on ACE inhibitory activity of hydrolysates of casein
由图2可知,酶解时间对酪蛋白水解产物ACE抑制率存在一定影响,随着酶解时间的延长,酪蛋白水解产物ACE抑制率呈现先增加后降低的趋势。当酶解时间从30 min延长至90 min,ACE抑制率提高了11.3%,但随着酶解时间的延长,水解产物ACE抑制率下降,且在酶解时间为300 min时降低至84.55%,这与Gao Dandan等[22]研究的结果相似,可能是由于酶解过程的蛋白变性导致ACE抑制率降低。
2.3 酪蛋白水解产物中多肽的分析与鉴定

表1 酪蛋白水解物中部分多肽的分析与鉴定Table 1 Analysis and identification of some peptides separated from hydrolysates of casein

续表1
酪蛋白水解产物中共鉴定出391 个肽段,其中163 个来自β-CN,106 个来自αs1-CN,68 个来自αs2-CN,54 个来自κ-CN。由表1可知,这些肽段中,LTQTPVVVPPF、LGPVRGPFP、LHLPLP、LHLPLPL、YQKFPQY、VLSRYP、ARHPHP是7 个经鉴定具有ACE抑制作用的生物活性肽。以上肽段的存在也是酪蛋白水解产物表现出较高ACE抑制率的原因之一,这7 个肽段中有6 个肽段分子质量都小于1 kDa,可知肽段分子质量越小,其生物活性可能越高。
2.4 活性肽YYQQRP的IC50预测
De Gobba等[23]水解牛乳酪蛋白,在κ-CN中鉴定出1 个具有ACE抑制作用的活性肽YYQQKP,该肽段与本研究从κ-CN中筛选出的肽段YYQQRP只相差1 个氨基酸,所以推测肽段YYQQRP具有ACE抑制活性,通过测定IC50范围,预测肽段YYQQRP对ACE的抑制活性。
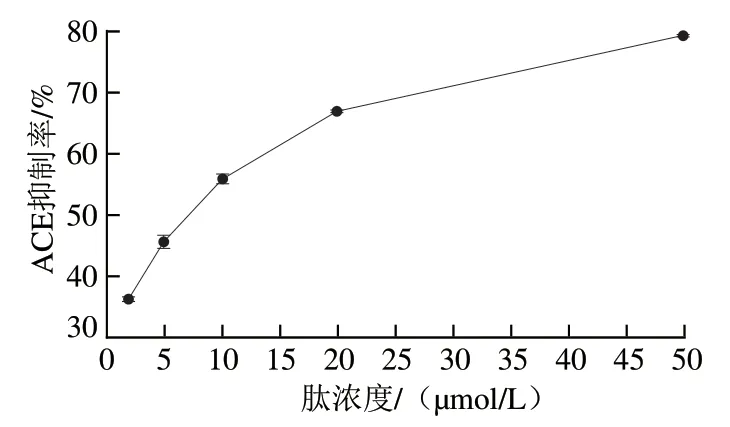
图3 不同浓度YYQQRP对ACE抑制率的影响Fig. 3 Effect of different concentration of YYQQRP on ACE inhibition
由图3可知,当ACE抑制率达到50%时,所需肽段YYQQRP浓度为5~10 μmol/L。
2.5 活性肽YYQQRP的ACE抑制动力学分析
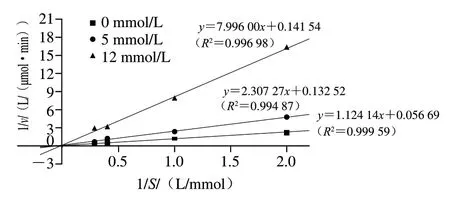
图4 YYQQRP对ACE抑制作用的Lineweaver-Burk图Fig. 4 Lineweaver-Burk plot of ACE inhibition by the peptide YYQQRP
利用Lineweaver-Burk图分析肽段YYQQRP对ACE的抑制模式。由图4可知,YYQQRP与底物表现出竞争性抑制作用,随着YYQQRP浓度的增加,vm减小,说明YYQQRP的存在阻碍了ACE与底物的结合,同时YYQQRP浓度越高,Km越大,ACE与底物的亲和力变小,表明YYQQRP的浓度对ACE催化反应至关重要。这种抑制模式说明YYQQRP结构可能与底物结构相似,能与ACE的活性位点相结合,从而降低ACE的催化活性。此结果与Parmar等[24]从发酵山羊乳中得到的六肽(AFPEHK)对ACE的抑制模式分析结果相似。
3 结 论
利用中性蛋白酶酶解绵羊乳酪蛋白,测定绵羊乳酪蛋白酶解产物水解度和ACE抑制率,研究酶解时间对水解度和ACE抑制率的影响,发现酶解时间300 min时的水解度为9.65%,ACE抑制率为84.55%,并利用超高效液相色谱飞行时间质谱仪对酶解后的多肽进行序列分析,与蛋白数据库比对,筛选出1 个新的具有潜在ACE抑制活性的肽YYQQRP,推测YYQQRP结构可能与底物结构相似,通过与ACE的活性位点相结合,从而降低ACE的催化活性。综上,绵羊乳酪蛋白酶解产物具有显著的ACE抑制活性,可为降血压药物及相关功能性产品的研制提供一定理论参考。
