柚皮素通过诱导血红素加氧酶-1的表达抑制氧化应激和血管钙化
2021-08-04李金河梁青春
周 芹,宋 艳,李金河,梁青春
(1.中山大学附属第一医院麻醉科,广东广州 510080;2.中山大学附属第一医院病理科,广东广州 510080;3.南方医科大学第三附属医院麻醉科,广东广州 510630)
血管钙化(vascular calcification)是常见的慢性肾脏病血管病变,其发病机制十分复杂。传统观点认为血管钙化仅仅是钙磷矿物质被动沉积于血管壁的过程。但是,越来越多的研究报道:在血管钙化过程中,大量的骨相关蛋白表达上调,改变基因的表达水平可影响血管钙化的发展[1-3],说明血管钙化是可调控的,治疗血管钙化成为可能。氧化应激是导致慢性肾脏病血管钙化的关键因素[4-5],抑制氧化应激可成为干预血管钙化的有效策略。血红素加氧酶-1(heme oxygenase-1,HO-1)是抑制氧化应激的关键酶,目前临床上尚无诱导HO-1 表达的药物用来干预血管钙化。柚皮素(Naringenin,NRG)是一种天然的黄酮类化合物,具有清除自由基和抗氧化的作用[6]。研究报道柚皮素可抑制血管平滑肌细胞增殖和血管内膜增生[7-8],然而柚皮素对高磷高钙诱导的血管钙化是否有效尚不清楚。在本研究中,我们采用血管平滑肌细胞和血管环钙化模型,研究NRG 对高磷高钙诱导的血管钙化的作用,并阐明HO-1 介导NRG 抑制血管钙化的机制,为慢性肾脏病血管钙化的防治提供新的策略。
1 材料与方法
1.1 主要材料与试剂
细胞培养基DMEM、胎牛血清(FBS)、TRIzol、BCA 蛋白定量试剂盒购自Thermo Fisher Scientific公司;NRG、茜素红、β-甘油磷酸、活性氧试剂盒购自Sigma 公司;钙检测试剂盒购自北京雷根生物公司;逆转录反应试剂盒、SYBR green 试剂盒购自Ta‐KaRa 公司;Western blot 超敏发光液购自Millipore公司。
1.2 细胞培养和药物处理
参考文献[9-10]的方法,从雄性SD 大鼠(南方医科大学动物中心,许可证号:SCXK(粤)2011-0015)的胸主动脉分离血管平滑肌细胞。使用含10% FBS 的DMEM 培养基处理大鼠血管平滑肌细胞,代细胞长满后传代。钙化培养基(10 mmol∕L 的β-甘油磷酸+3 mmol∕L 的CaCl2)处理血管平滑肌细胞7 d诱导细胞钙化,普通生长培养基处理的细胞作为阴性对照。为了研究NRG对细胞钙化的影响,在高磷高钙的条件下,用不同浓度的NRG(5、10、20 μmol∕L)处理血管平滑肌细胞7 d。动物的使用已获中山大学附属第一医院动物伦理委员会的批准。
1.3 血管环组织培养和药物处理
分离主动脉血管环[11],使用1%戊巴比妥钠麻醉处死雄性SD 大鼠,暴露和分离胸主动脉,用眼科剪将其剪成5 mm 左右长的血管环,加入钙化培养基,药物处理组血管环加入不同浓度的NRG(5、10、20 μmol∕L)7 d 后,收集血管标本检测钙化程度。
1.4 检测细胞钙化
参考文献[11-12],采用茜素红染色法检测血管平滑肌细胞和血管环钙化。将培养皿从细胞培养箱中取出,放置室温下,去除培养基,用PBS溶液洗3 次,加入40 g∕L 的多聚甲醛,固定细胞10 min,然后用去离子水洗培养皿,加入2%茜素红(pH 4.2)溶液孵育5 min,加入去离子水洗去背景色,倒置显微镜下拍摄细胞。加入1 mL 甲酸液体,充分混匀后液体变成黄色,用多功能酶标仪在波长为405 nm处检测吸光值。
1.5 检测血管环钙化
血管环茜素红染色:用40 g∕L 的多聚甲醛固定动脉环,使用梯度酒精脱水,二甲苯透明,石蜡浸泡血管环,包埋好血管环制成血管石蜡块,将其切成5 μm 厚的组织切片,然后脱蜡水化,把切片组织浸泡在2%茜素红溶液中孵育5 min,去除多余染色液,用中性树胶封片保存,在倒置显微镜下观察并拍照。
1.6 检测钙离子浓度
采用比色法检测钙离子浓度,参考钙检测试剂盒说明书,先用预冷PBS 清洗细胞和血管组织,加入蛋白裂解液处理,然后低温离心(3 000×g,4 ℃,3 min),将上清样品转移至1.5 mL 离心管中,将2.5 μL 的待测样品和钙标准品加入96 孔板中,配制钙离子显色工作液,每孔各加入200 μL 显色液,室温避光静置孵育10 min,使用多功能酶标仪检测在610 nm处的吸光值。
1.7 活性氧水平检测
采用活性氧检测试剂盒检测活性氧(reactive oxygen species,ROS)水平,去除培养基,用PBS 溶液洗3 次,洗细胞后加入荧光染料二氢乙啶(dihy‐droethidium,DHE),37 ℃避光孵育30 min,然后用PBS清洗细胞,荧光显微镜下拍照。
1.8 荧光定量qPCR
将细胞培养基吸取丢弃,加入1 mL RNA 提取试剂TRIzol,参照试剂公司说明提取血管平滑肌细胞总RNA。取1 μg mRNA,加入Takara PrimeScript RT试剂,将mRNA逆转录为cDNA,配制20 μL PCR反应体系:2×SYBR premix(10 μL),50× ROX Ref‐erence Dye Ⅱ(0.4 μL),Primer mix(0.4 μL),cD‐NA(1μL),ddH2O(8.2 μL),将PCR 反应物混匀随后放入Real Time PCR 仪上,进行荧光定量PCR 反应:95 ℃预变性15 min,95 ℃变性15 s 和60 ℃退火延伸1 min(40 次循环)。所用的引物信息如下:βactin(forward):TGTCACCAACTGGGACGATA,βactin(reverse):GGGGTGTTGAAGGTCTCAAA;HO-1(forward):TTCAGAAGGGTCAGGTGTCC,HO-1(reverse):CTGTGTGGCTGGTGTGTAAG。采用β-actin为内参基因,2ΔΔCt的方法计算目的基因mRNA的相对量表达水平。
1.9 Western blot
加入蛋白裂解液提取血管平滑肌细胞总蛋白,BCA 试剂盒检测蛋白质的浓度。蛋白样品100 ℃加热10 min 后蛋白质充分变性。每孔上样20 μg蛋白样品,采用8% SDS-PAGE 胶进行电泳分离蛋白,然后将蛋白电转移至PVDF 膜,TBST 洗膜3次,加入5%脱脂奶粉封闭液在室温下孵育1 h。加入一抗HMOX-1 抗体(Proteintech,1:1 000)室温孵育1 h,TBST 洗膜3 次,然后加入二抗室温孵育1 h,TBST 洗膜3 次,加入超敏发光液ECL 试剂,将膜放入LAS 500发光成像仪内曝光显影。
1.10 统计学分析
所有的计量资料以均数±标准差表示,采用SPSS 软件分析数据,两组以上均值比较采用单因素方差分析(One way-ANOVA)检验,两两比较采用Turkey法。当P<0.05时被认为有统计学差异。
2 结果
2.1 NRG抑制大鼠血管平滑肌细胞钙化
我们采用含高磷高钙的钙化培养基(calcifying medium,CM)诱导大鼠血管平滑肌细胞钙化。为研究NRG 对高磷高钙诱导的血管平滑肌细胞钙化的作用,在CM 的条件下,不同浓度的NRG(5、10、20 μmol∕L)处理大鼠血管平滑肌细胞7 d。茜红素染色结果显示:普通培养基(Growth medium,GM)处理的细胞未见钙化沉积,CM 组的血管平滑肌细胞钙化明显增强(图1A);使用不同浓度的NRG(5、10、20 μmol∕L)后,大鼠血管平滑肌细胞钙化程度减轻(图1A),其中以浓度为20 μmol∕L 的NRG效果最为明显。定量分析茜素红染色结果显示(方差分析的F=178.183,P=0.000 3):与GM 组比较,CM组的细胞钙化明显增强(图1B,P=0.000 02);与CM 组比较,NRG 处理组的细胞钙化程度明显减轻(图1B,P<0.001)。另外,不同浓度的NRG(5、10、20 μmol∕L)都能降低细胞钙离子浓度(图1C,P<0.001),20 μmol∕L 的NRG 效果最好。这些结果说明NRG 可以浓度依赖性地抑制高磷高钙诱导的血管平滑肌细胞钙化,且浓度为20 μmol∕L 的NRG 抑制血管钙化的作用最为明显。
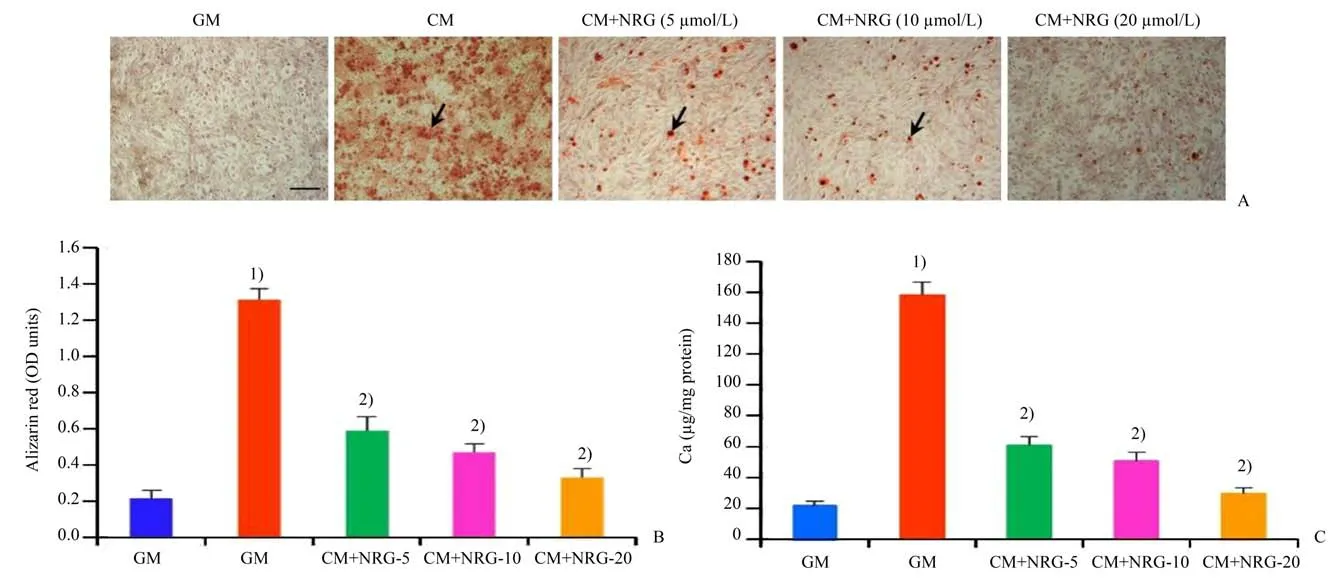
图1 NRG对高磷高钙诱导的大鼠血管平滑肌细胞钙化的影响Fig.1 Effect of NRG on high phosphate/calcium-induced calcification of rat VSMCs
五组定量分析茜素红染色结果比较,经单因素方差分析,五组间差异有统计学意义(F=178.183,P=0.000 3);采用Turkey 法进一步作两两比较,发现CM 组与GM 组比较,差异有统计学意义(P=0.000 02),NRG(5 μmol∕L)组与CM 组比较,差异有统计学意义(P=0.000 16),NRG(10 μmol∕L)组与CM 组比较,差异有统计学意义(P=0.000 37),NRG(20 μmol∕L)组与CM 组比较,差异有统计学意义(P=0.000 83)。
2.2 NRG抑制大鼠血管环钙化
为进一步研究NRG 对血管钙化的作用,我们采用不同浓度的NRG(5、10、20 μmol∕L)处理血管环7 d。染色结果和定量分析显示(方差分析的F=267.048,P=0.000 04):与GM 组比较,CM 组的血管环钙化程度明显加重(P<0.001;图2A、B);与CM组比较,NRG 处理组的血管环钙化程度明显减弱(P<0.001;图2A、B)。另外,我们发现:NRG 可显著降低血管组织钙离子浓度(P<0.001;图2C)。

图2 NRG对高磷高钙诱导的大鼠血管环钙化的影响Fig.2 Effect of NRG on high phosphate/calcium-induced calcification of rat aortic rings
五组定量分析茜素红染色结果比较,经单因素方差分析,五组间差异有统计学意义(F=267.048,P=0.000 04);采用Turkey法进一步作两两比较,发现CM 组与GM 组比较,差异有统计学意义(P=0.000 37),NRG(5 μmol∕L)组与CM 组比较,差异有统计学意义(P=0.000 32),NRG(10 μmol∕L)组与CM 组比较,差异有统计学意义(P=0.000 17),NRG(20 μmol∕L)组与CM 组比较,差异有统计学意义(P=0.000 44)。
2.3 NRG抑制血管平滑肌细胞氧化应激
由于NRG 具有清除自由基和抗氧化的作用,因此我们研究了NRG 对血管平滑肌细胞氧化应激的影响。结果显示(方差分析的F=29.89,P=0.000 1):CM 处理可升高血管平滑肌细胞ROS 水平,而使用NRG 可明显降低ROS 水平(图3A、B),说明NRG 可减轻血管平滑肌细胞氧化应激。

图3 柚皮素对高磷高钙诱导的大鼠血管平滑肌细胞氧化应激的影响Fig.3 Effect of NRG on high phosphate/calcium-induced oxidative stress in rat VSMCs
四组定量分析茜素红染色结果比较,经单因素方差分析,四组间差异有统计学意义(F=29.89,P=0.0001);采用Turkey 法进一步作两两比较,发现CM 组与GM 组比较,差异有统计学意义(P=0.00094),NRG(10 μmol∕L)组与CM 组比较,差异有统计学意义(P=0.012),NRG(20 μmol∕L)组与CM组比较,差异有统计学意义(P=0.000 5)。
2.4 NRG上调血管平滑肌细胞HO-1的表达水平
HO-1 是抑制氧化应激的关键酶,我们研究了NRG 对血管平滑肌细胞HO-1 表达水平的影响。qPCR 结果显示(F=248.488,P=0.000 02)NRG(20 μmol∕L)能明显增加血管 平滑肌细胞HO-1 mRNA 的表达水平(P<0.001;图4A);Western blot结果也显示NRG 能明显上调血管平滑肌细胞HO-1 蛋白的表达水平(P<0.001;图4B)。
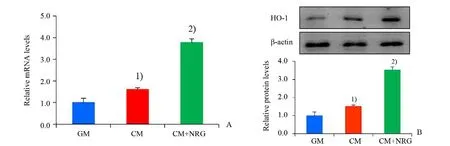
图4 NRG对大鼠血管平滑肌细胞HO-1表达水平的影响Fig.4 Effect of NRG on HO-1 expression in rat VSMCs
三组HO-1 mRNA 结果比较,经单因素方差分析,3 组间差异有统计学意义(F=248.488,P=0.000 02);采用Turkey 法进一步作两两比较,发现CM 组与GM 组比较,差异有统计学意义(P=0.009),CM+NRG 组与CM 组比较,差异有统计学意义(P=0.000 8)。
2.5 抑制HO-1 阻断NRG 对血管平滑肌细胞钙化的抑制作用
为了研究HO-1 是否参与了NRG 抑制血管平滑肌细胞钙化的过程,我们观察了HO-1 抑制剂ZnPP9 对NRG 抑制血管平滑肌细胞钙化的影响。结果显示(F=241.933,P=0.000 03):与CM 组比较,NRG(20 μmol∕L)处理的细胞钙化明显减轻,加入ZnPP9(10-7mol∕L)能明显阻断NRG 对血管平滑肌细胞钙化的抑制作用(图5A、B);另外,钙定量分析显示:ZnPP9能对抗NRG降低细胞钙离子浓度的作用效应(图5C)。
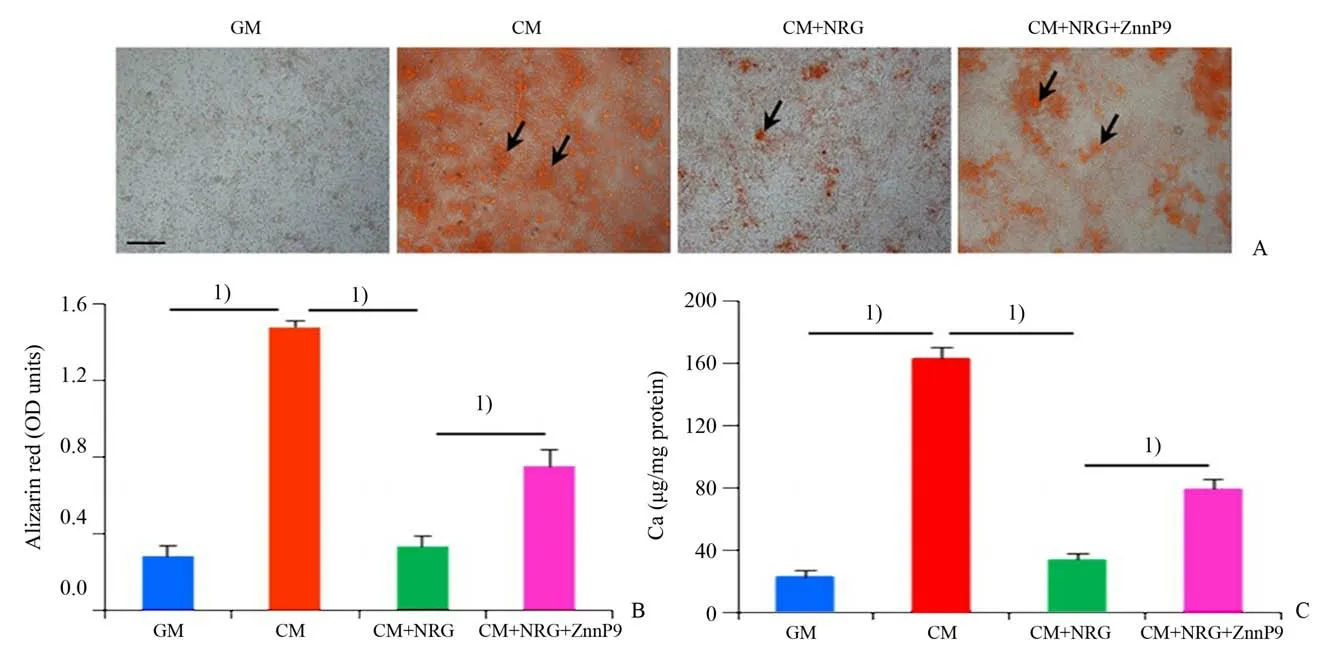
图5 HO-1抑制剂ZnPP9对大鼠平滑肌细胞钙化的影响Fig.5 Effect of HO-1 inhibitor ZnPP9 on calcification of rat VSMCs
四组定量分析茜素红染色结果比较,经单因素方差分析,四组间差异有统计学意义(F=241.933,P=0.000 03);采用Turkey法进一步作两两比较,发现CM 组与GM 组比较,差异有统计学意义(P=0.000 49),CM+NRG 组与CM 组比较,差异有统计学意义(P=0.000 69),CM+NRG+ZnPP9 组与CM+NRG 组比较,差异有统计学意义(P=0.000 02)。
3 讨论
慢性肾脏病血管钙化临床上尚无有效的治疗方法,阐明血管钙化的分子调控机制,寻找其干预靶点具有极其重要的临床价值。在本研究中,我们采用平滑肌细胞和血管环钙化模型,研究NRG 对血管钙化的作用。结果显示:不同浓度的NRG(5、10、20 μmol∕L)均可明显减轻高磷高钙诱导的大鼠血管平滑肌细胞和血管环钙化。由于我们在研究NRG 对血管钙化的作用时,采用了多个浓度NRG(5、10、20 μmol∕L)处理细胞和血管环,其中以NRG(20 μmol∕L)对血管钙化的作用效果最佳。因此,在后续研究NRG 对HO-1 mRNA 和蛋白的表达水平的影响时,采用了20 μmol∕L 的NRG 处理细胞。NRG 降低细胞ROS 的水平,上调HO-1 的表达水平,而抑制HO-1可阻断NRG 减轻血管平滑肌细胞钙化的作用效应。这些结果提示:NRG 可通过诱导HO-1的表达抑制氧化应激和血管钙化。
氧化应激的增强是许多血管钙化相关疾病如慢性肾脏病、高血压、糖尿病等的共同特征。慢性肾脏病血管钙化的病理机制十分复杂,氧化应激是导致慢性肾脏病血管钙化的重要发病机制[5]。在慢性肾脏病血管钙化发展过程中,主动脉氧化应激程度明显增加,而抑制氧化应激可改善动脉钙化[13]。高磷水平能诱导ROS的产生和血管钙化,抗氧化剂能明显抑制氧化应激,延缓血管钙化的发展[14]。本研究表明:高磷高钙可刺激血管平滑肌细胞ROS 的水平升高,促进平滑肌细胞钙化。使用NRG 后可明显降低ROS 的水平,抑制血管平滑肌细胞和血管环钙化。另外,既往研究表明:NRG 可通过促进HO-1 的表达发挥其抗氧化,抗细胞损伤等生物学作用[15-16]。我们的研究也发现:NRG 可增加血管平滑肌细胞HO-1 的表达水平,抑制血管钙化;而采用HO-1 抑制剂后,NRG 抑制平滑肌细胞钙化的作用明显减弱了。这些结果首次证实:NRG可通过调控HO-1抑制血管钙化。
综上所述,在钙磷代谢失调的条件下,氧化应激可诱导血管钙化。NRG 可上调HO-1 的表达水平,抑制氧化应激和血管细胞钙化。调节HO-1 的表达水平可成为干预血管钙化的新策略,我们将采用动物实验进一步验证NRG 通过调控HO-1 的表达抑制慢性肾脏病血管钙化,为NRG 治疗血管钙化提供实验依据。
