CFTR通过调控二磷酸腺苷受体P2Y12影响血小板活化
2021-08-04杨涵滟王冠蕾
李 俊,杨涵滟,韩 慧,李 梅,王冠蕾
(1.中山大学中山医学院药理学教研室和心脑血管研究中心,广东广州 510080;2.中山大学附属第三医院特诊医疗病区,广东广州 510630)
血小板的主要生理功能是止血,当血管内发生出血事件或者动脉粥样硬化斑块破裂时,血小板活化分泌致密颗粒促进血小板自身活化、单核细胞-血小板以及中性粒细胞-血小板聚集,纤维蛋白原暴露,血小板膜上糖蛋白Ⅵ(glycoprotein Ⅵ)与纤维蛋白结合从而引发血栓形成[1]。血小板的异常激活是血栓相关疾病如心肌梗塞的主要病理机制。二磷酸腺苷(ADP)受体P2Y12介导的血小板活化信号通路是血小板活化的核心机制,如目前临床上应用最广泛的抗血小板药物之一就是P2Y12受体抑制剂。P2Y12是一种G 蛋白偶联受体(G-protein-cou‐pled receptors GPCRs),ADP 与其细胞外部分结合能激活P2Y12[2-6]。除了与ADP结合外,P2Y12激活还能促进整合素αⅡbβ3 活化,进一步放大凝血酶、血栓素A2 介导的血小板活化信号。P2Y12激活后通过PI3K-AKT 信号通路促进血小板聚集,促进血小板介导血栓的形成;同时这条信号通路还能促进致密颗粒释放多种血小板活性物质,对血小板介导的血栓形成发挥重要调节作用。囊性纤维化跨膜电导 调 节 子(cystic fibrosis transmembrane conduc‐tance regulator,CFTR)在1989 年首次由Riordan 克隆[7],CFTR基因编码一种cAMP 激活的氯离子通道。CFTR单基因突变可引起一种人类遗传疾病囊性纤维化(cystic fibrosis,CF)。其中最常见的基因突变是CFTR外显子上3 个碱基对的缺失,可引起CFTR 蛋白第508 位置上的苯丙氨酸残基缺失(ΔF508)[8]。CF 病人由于CFTR 编码的氯离子通道功能障碍,引起呼吸道及肠道黏膜等腺上皮器官分泌异常,黏膜增厚及黏液粘稠,导致呼吸困难、反复感染等症状[9-10]。以往研究提示CF 病人外周血小板活性增高[10],最近有报道应用巨核细胞∕血小板特异性敲除CFTR小鼠证实了CFTR敲除可促进血小板介导的炎症反应[11],促进血小板和淋巴细胞相互作用。但是,CFTR 和血小板活化的相关性及具体分子机制仍未完全清楚。由于P2Y12激活在血小板活化过程中起关键作用,本研究还揭示了CFTR可能通过调控P2Y12蛋白表达从而影响血小板活化。
1 材料与方法
1.1 实验动物
本研究所涉及的所有动物实验经中山大学实验动物伦理委员会的批准,批准编号为:SYSU-IA‐CUC-2020-000446,并且符合国家科技部《实验动物护理和使用指南》。CFTR基因敲除小鼠[CFTRtm1UncTg(FABPCFTR)1Jaw∕J;Cftr-∕-]购于美国The Jackson Laboratory,该小鼠是C57BL∕6、FVB∕N和129的混合遗传背景。文中所涉及的C57BL∕6小鼠全部购置于中山大学实验动物中心,动物许可证编号为SCXK(粤)2018-0003。P2Y12全基因敲除(P2Y12
-∕-)小鼠购于美国Shering Plough 公司,该小鼠的遗传背景为C57BL∕6。本研究中所有小鼠均为8~16 周龄,性别体质量匹配。所有小鼠饲养于中山大学实验动物中心。饲养条件为:SPF 级动物房,每笼5 只小鼠,每日清扫,专人喂养。室温(25±2)℃,相对湿度(60±10)%,模拟正常昼夜生物节律。
1.2 主要材料
人巨核细胞株(Megakaryocyte cell strains;Meg-01)细胞购自美国American type culture collec‐tion(ATCC),RPMI-1640 培养基、胎牛血清(FBS)购于美国Gibco公司,CFTR抗体购于美国Novus公司,P2Y12抗体购于英国Abcam 公司,PI3K、p-PI3K、AKT、p-AKT 抗体购于美国Cell Signaling Technolo‐gy 公司,β-actin 抗体和α-tublin 抗体购于中国Boster 生 物 公 司,CFTRinh-172(CFTR inhibitor)、ADP、胶原蛋白、肾上腺素购于美国Sigma 公司,BCA 试剂盒购于美国Thermo Fisher Scientific 公司,ECL试剂盒购于美国Millipore公司。
1.3 主要仪器设备
多功能酶标仪:美国Bio Tek 公司;高速冷冻离心机:德国Eppendorf Centrifuge 公司;电转装置:美国Bio-Rad 公司;凝胶成像系统:美国ChemiDoc XRS 公司;石蜡切片机:美国Thermo Fisher Scientif‐ic公司。
1.4 实验方法
1.4.1 小鼠外周血血小板提取 分别取8~16 周的Cftr-∕-鼠和C57BL∕6(Cftr+∕+)鼠,用10 g∕L 戊巴比妥钠腹腔注射麻醉小鼠。打开小鼠腹腔,棉签分离出小鼠腹主动脉,使用2 mL 注射器进行腹主动脉取血,全血转移到15 mL 离心管中。在25℃,300×g条件下离心2 min,得到上层富含血小板血清。将上层血清在25 ℃,500×g条件下再次离心5 min,弃去上清得到血小板沉淀,留下备用。
1.4.2 肺栓塞模型构建和HE 染色 分别取8~16周Cftr-∕-鼠和Cftr+∕+鼠两组(n=6)。用0.8 mg∕kg 胶原蛋白和60 μg∕kg 肾上腺素注射入下腔股静脉,30 min 后仍存活小鼠为肺栓塞模型建模成功。处死后取出肺组织,PBS 冲洗后置于40 g∕L 多聚甲醛中固定过夜。从固定液中取出肺组织,用0.1 mol∕L PBS 溶液洗3次,然后将肺组织依次放入5%、10%、15%的蔗糖梯度溶液中脱水30 min,最后将其放入20%的蔗糖溶液中4 ℃脱水过夜。将组织取出用滤纸吸干后,用OTC 包埋剂包埋,制备肺脏组织冰冻切片,切片做Hematoxylin-eosin(H&E)染色,显微镜下观察血栓水平。
1.4.3 ADP刺激Meg-01细胞实验 用含有100 mL∕L FBS 的RPMI-1640 培养基培养Meg-01 细胞,待细胞密度至5×105∕mL 时,分别孵育不同浓度的ADP(0、0.3、1、5和10 μmol∕L),孵育后提取细胞蛋白。
1.4.4 免疫印迹法 将细胞或者提取的血小板加入RIPA蛋白裂解液和蛋白酶抑制剂(cocktail)冰上裂解20 min。在4 ℃,15 000×g条件下离心15 min,得到蛋白上清液。用BCA 试剂盒蛋白定量后,按每孔30 μg 蛋白上样。用Bio-Rad 仪器进行SDSPAGE 电泳2 h,转膜。室温封闭90 min 后,与相应一抗抗体4 ℃孵育过夜,TBST 洗膜后,用二抗室温孵育90 min,ECL 反应显色,在化学发光成像系统(Bio-rad)下显影。使用Image J 1.42 软件,根据条带灰度值,对目的蛋白表达进行相对定量分析[12]。
1.5 统计学分析
数据数值均采用均数±标准差表示。数据处理两样本间比较采用Student’st检验。多组数据比较采用单因素方差分析(One-way ANOVA),多组数据比较差异有统计学意义后,对于不同浓度处理组检测结果和对照组比较采用Dunnett’st检验;所有数据均采用Graphpad Prism version 8.20 软件统计。P<0.05表示差异具有统计学意义。
2 结果
2.1 CFTR 基因敲除促进胶原蛋白/肾上腺素诱导的小鼠肺动脉血栓形成
以胶原蛋白(0.8 mg∕kg)∕肾上腺素(60 μg∕kg)注射入Cftr-/-和同周龄Cftr+/+的小鼠下腔股静脉,以诱导小鼠肺动脉血栓形成。注射30 min 后处死小鼠,取肺组织切片行HE染色。如图1所示,Cftr-/-小鼠的肺动脉血栓栓塞数量明显大于Cftr+/+小鼠(n=6)。

图1 CFTR 基因敲除增加肺动脉血栓血栓栓塞数目Fig.1 CFTR knockout increased thrombus formation in the pulmonary artery thrombosis model
2.2 CFTR基因敲除上调小鼠外周血血小板P2Y12及其介导的血小板活化信号通路
分离8 周龄Cftr-/-及Cftr+/+小鼠外周循环血液的血小板,Cftr-/-小鼠血小板P2Y12蛋白表达显著升高,差异具有统计学意义(P<0.01;图2A);Cftr-/-小鼠血小板PI3K 和AKT 蛋白磷酸化水平明显升高,差异具有统计学意义(P<0.01;图2B);与Cftr+/+组相比,Cftr-/-小鼠血小板PI3K 和AKT 总蛋白水平无显著差异。
2.3 P2Y12 基因敲除小鼠外周循环血小板CFTR蛋白表达无改变
如图3 所示,P2Y12-/-小鼠外周血小板上CFTR蛋白表达与WT 小鼠相比无显著统计学差异(P>0.05)。
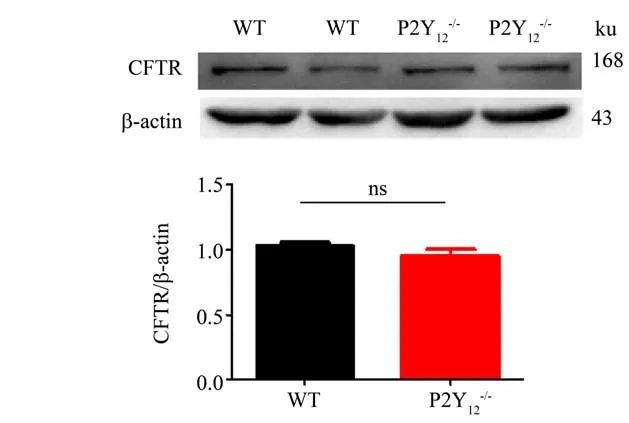
图3 P2Y12基因敲除不影响小鼠外周血小板CFTR蛋白表达Fig.3 P2Y12 KO has no influence on CFTR protein expression in mouse circulating platelets
2.4 ADP刺激Meg-01细胞后CFTR 和P2Y12 蛋白表达变化
如图4 所示,用不同浓度ADP(0、0.3、1、5 和10 μmol∕L)刺激人巨核细胞株Meg-01 细胞,显示P2Y12蛋白表达逐渐增加,5 μmol∕L ADP 刺激时,P2Y12蛋白表达即显著增加(5 μmol∕L:1.2±0.3vs.0 μmol∕L:0.4±0.1,q=4.684,P=0.003 4),具有统计学意义。CFTR 蛋白表达则随着ADP 刺激浓度增加而逐渐下降(F=22.51,P<0.000 1),与对照组相比,1 μmol∕L ADP 刺激时CFTR 表达即显著下降,具有统计学意义(1 μmol∕L:0.7±0.1vs.0 μmol∕L:1.1±0.1,q=6.214,P=0.000 4)。ADP刺激活化P2Y12后,其下游PI3K 以及AKT 蛋白磷酸化表达也显著增强,而总蛋白并没有改变。另外,ADP 在1~10 μmol∕L 浓度范围与MEG-01 细胞共孵育12 h 未观察到其对于细胞增殖有影响(结果未显示)。
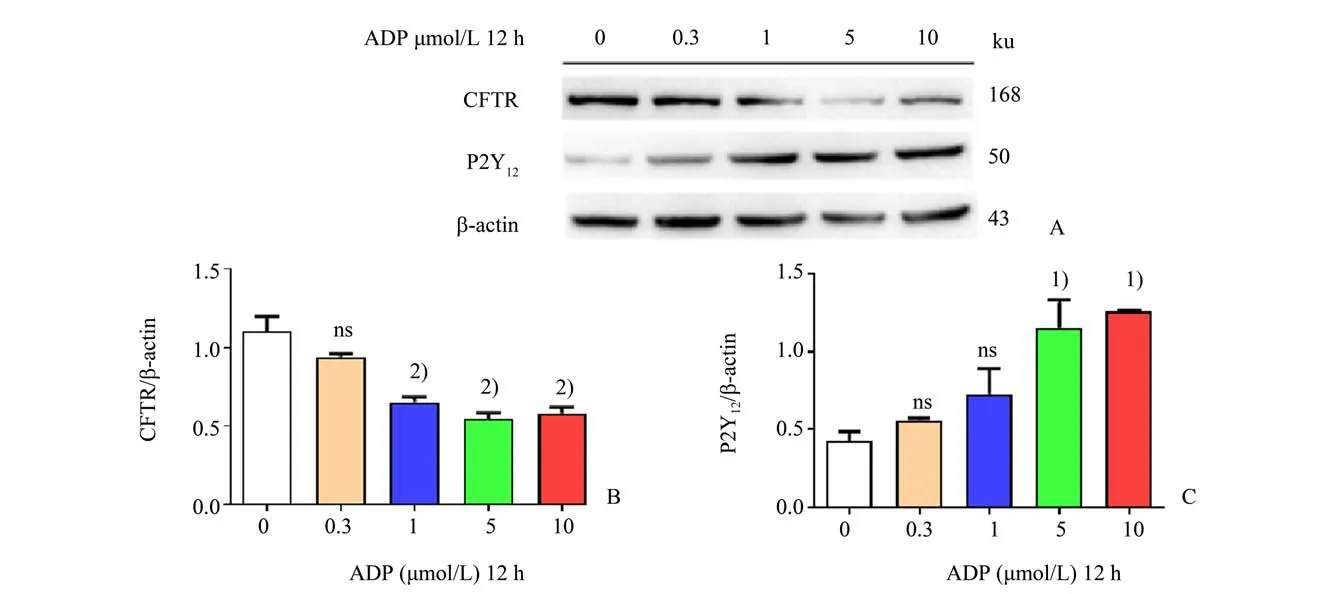
图4 ADP刺激Meg-01细胞对CFTR和P2Y12蛋白表达的影响Fig.4 The effects of ADP on the protein expression of CFTR and P2Y12 in Meg-01 cells
2.5 CFTRinh-172诱导Meg-01细胞P2Y12蛋白表达
如图5 所示,不同浓度的CFTRihn-172(0、1.25、2.5、5 和10 μmol∕L)与Meg-01 细胞共孵育24 h,发现CFTRinh-172 不影响CFTR 蛋白表达,而P2Y12蛋白表达则随着CFTRinh-172 刺激浓度增加而逐渐升高(方差分析统计量F=12.59,P<0.000 1),与未加CFTRinh-172 组相比,5 μmol∕L 的CFTRinh-172 引起P2Y12蛋白表达显著增加(5 μmol∕L:0.9±0.3vs.0 μmol∕L:0.4±0.1,q=4.7,P=0.000 5)。
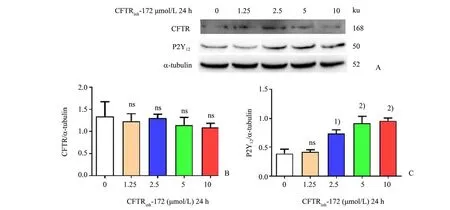
图5 CFTRinh-172诱导Meg-01细胞P2Y12蛋白表达升高Fig.5 CFTRinh-172 induced an increase of P2Y12 protein expression in Meg-01 cells
3 讨论
本文主要发现了阻断CFTR 氯通道或是降低CFTR 蛋白表达均能够通过诱导循环血液血小板P2Y12表达的升高,从而影响血小板活化。同时,应用Cftr-/-小鼠肺栓塞显著加重,提示CFTR 可能参与病理情况下由血小板活化所引起的后续事件如血栓和炎症等。
血小板活化无论是在动脉和静脉血栓形成过程中,均占据核心地位[1]。早期研究已经发现CF病人的血小板高反应活性,包括血小板-淋巴细胞微颗粒增加[10,13-14];感染绿脓杆菌的CF患者血小板产生的炎症因子sCD40L 显著增加[15-16]。这些研究提示CFTR 氯通道功能降低促进血小板活化。但CFTR调控血小板活化的机制并不清楚。我们应用特异性通道组阻断剂CFTRinh-172 以阻断Meg-01细胞上的跨膜Cl-外流,模拟了CFTR 氯通道功能降低,发现CFTRinh-172 可浓度依赖性诱导P2Y12表达。同时,我们发现在Cftr-/-小鼠静息情况下血小板上的P2Y12蛋白表达和PI3K-AKT 磷酸化水平都显著升高,PI3K-AKT磷酸化是P2Y12下游经典的血小板聚集信号分子[17-18],上述发现提示CFTR基因敲除不但通过上调P2Y12促进血小板活化,也可能影响血小板活化的后续事件,如血栓形成、血管炎症等。但值得注意的是,由于CFTR氯通道基因在多种组织和细胞上广泛分布,CFTR 是否能调控血小板聚集和血栓形成应该在血小板特异性敲除CFTR小鼠上进行验证。
ADP 是体内最重要的引起血小板聚集的物质[17,20-21],我们采用体外ADP 刺激Meg-01 细胞以模拟在体的血小板活化状态,由于血小板是由骨髓巨核细胞或者肺的巨核细胞分化产生的无核血细胞。血小板在体内存活时间约7~14 d,在体外无法培养。人成巨核细胞白血病(Meg-01)细胞已公认为一种研究血小板电生理特性或者长时程功能蛋白或基因表达的替代细胞株,因为:①巨核细胞是最直接的血小板前体,它们在功能性分子表达和特性上有很多的相似之处。②由于巨核细胞较大的尺寸、特殊的形态以及结合到巨核细胞∕血小板特异性细胞表面标记物CD41的能力。我们发现ADP诱导P2Y12及其下游PI3K-AKT 上调的同时,CFTR蛋白表达显著下降,这与Cftr-/-小鼠实验结果是一致的。另外,P2Y12的激活还能放大其他血小板活性物质如凝血酶介导的血小板分泌活动,并通过放大磷脂酰丝氨酸的膜上暴露,血小板衍生的微粒形成和胶原诱导的组织因子(TF)暴露来促进血栓形成、血管炎症反应[5-6]。是否CFTR 可能通过调控P2Y12,继而影响血小板其他功能,也需要进一步研究。另外,我们在P2Y12-/-小鼠血小板上发现CFTR 蛋白表达和WT 鼠相比无明显变化,这提示CFTR位于P2Y12活化信号通路的上游,但中间通过哪些信号分子介导,现在还不清楚。
综上所述,我们揭示了CFTR 调控血小板活化的一个新机制:阻断CFTR 氯通道或是降低CFTR蛋白表达可上调血小板P2Y12表达从而增强血小板活化,并上调P2Y12下游血小板聚集信号分子如PI3K-AKT。
