痛泻要方对肝郁脾虚证IBS-D大鼠SCF/c-Kit信号系统的影响*
2021-07-24芮晓薇郑思慧赵方敏蒋佳怡柯雅妮蔡利军
芮晓薇 郑思慧 赵方敏 蒋佳怡 柯雅妮 张 璐 蔡利军#
1 浙江中医药大学第一临床医学院 浙江 杭州 310053
2 浙江中医药大学附属第一医院 浙江 杭州 310006
腹泻型肠易激综合征(IBS-D)是以反复发作的腹痛腹泻为临床特征的慢性功能性胃肠道疾病,常伴心理障碍。IBS-D发病可能与脑-肠轴功能紊乱、内脏高敏感性、肠道动力异常及精神心理因素等有关[1-2]。而内脏高敏感性、肠道动力异常与5-羟色胺(5-HT)、P物质(SP)等脑肠肽及SCF/c-Kit信号系统密切相关[3]。痛泻要方对于治疗肝郁脾虚证IBS-D具有良好疗效,然而其作用机制尚未完全明确,故本研究通过观测大鼠血清5-HT和结肠组织SP、SCF和c-Kit mRNA表达量的变化,探讨痛泻要方对肝郁脾虚证IBS-D的作用机制,为疏肝健脾方药在IBS-D中的运用提供理论依据。
1 材料与方法
1.1 实验动物:SD雄性大鼠24只,体质量200±20g。饲养条件:室温 20~24℃,相对湿度 40%~70%,噪音<60dB,光照周期12h/12h。
1.2 实验药物:番泻叶、痛泻要方(炒白术30g,炒白芍20g,炒陈皮15g,防风10g),中药饮片由浙江省中医院中药房提供并进行质量鉴定。
1.3 实验试剂及仪器:大鼠SP ELISA试剂盒;大鼠5-HT ELISA试剂盒;BCA蛋白法含量测试盒(ADS-FDB005);RNA提取试剂盒(TaKaRa,AHF1991D);RT反转录试剂盒(TaKaRa,RR036A);SYBR Green荧光定量PCR染料(TaKaRa,AK9301)。悬尾测试仪(济南益延科技发展有限公司,YLS-18A);大鼠旷场(深圳市瑞沃德生命科技有限公司,63007);荧光定量PCR仪(ABI)。
1.4 造模及干预方法:具体如下。
1.4.1 药物制备:番泻叶水煎剂:番泻叶水浸泡5h,煎煮20min,过滤浓缩至含生药0.45g/ml药液备用。痛泻要方水煎剂:炒白术、炒白芍、炒陈皮、防风水浸泡30min,煎煮30min,过滤浓缩至含生药1.35g/ml备用。
1.4.2 建立模型:除空白组外,各组均采用番泻叶灌胃联合慢性束缚应激法建立[4]肝郁脾虚证IBS-D动物模型:连续14d番泻叶水煎剂[4.5g/(kg·d)]灌胃后叠加束缚,每日约2h。
1.4.3 药物干预:造模成功后开始治疗,给药剂量按大鼠与人体体表面积折算的等效剂量计算:痛泻要方组按生药6.75g/(kg•d);空白组、模型组分别给予等体积生理盐水,灌胃量按0.50ml/100g计算,连续14d。
1.5 检测指标及方法:具体如下。
1.5.1 一般状态观察:造模与治疗前后,观察各组大鼠的精神状态、行为等,并记录体质量变化。
1.5.2 粪便性状测定:第28、42d观察并记录4h(8:00-12:00Am)内各组大鼠的粪便性状和粪点数。采用Bris‐tol分级评分[5]评价大鼠的腹泻情况。稀便率=大鼠所排稀便粒数/排便总粒数。采集大鼠粪便,称量记录粪便湿重,烘干后称量记录干重。计算公式:粪便含水量(%)=(粪便湿重-粪便干重)/粪便湿重×100%[6]。
1.5.3 动物行为学评价:旷场实验[7]:于42d给药结束后,在安静无干扰、弱光照射、无参照物的环境下进行。大鼠适应环境1min后置于旷场箱中心格内,用Smart v3.0记录5min内大鼠活动情况。悬尾实验[8]:于42d给药结束后,将大鼠尾部固定于悬尾测试仪中成倒挂状态,共悬挂6min,适应2min,记录大鼠后4min内的静止时间(放弃挣扎,整个身体相对不动)。
1.5.4 标本采集:末次给药后,各组大鼠禁食不禁水24h,颌下静脉取血,离心取上清液,-20℃保存备用。采血后大鼠安乐死,剖腹截取结肠组织-80℃冻存备用。
1.5.5 ELISA法测定结肠SP、血清5-HT水平:严格按照ELISA试剂盒说明书操作,测定计算各样本的浓度。
1.5.6 qPCR法检测SCF、c-Kit的表达:严格按照试剂盒说明书进行。引物序列见表1。用实时荧光定量PCR仪及其分析软件进行扩增,计算Ct值,通过公式2-△△CT计算mRNA表达量。
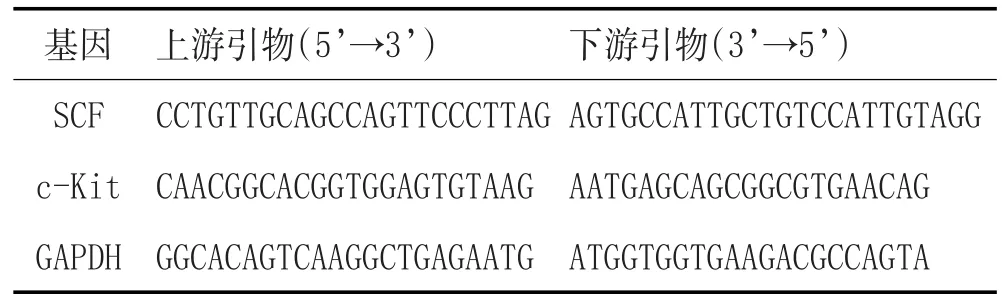
表1 引物序列
1.5.7 相关性分析:用Peasron积差相关系数分析SCF、c-Kit的表达与SP、5-HT水平的相关性。
1.6 统计学方法:采用SPSS 23.0软件进行统计学分析,计量数据以均数±标准差(±s)表示,多组间均值比较采用单因素方差分析,组间两两比较采用LSD-t检验,P<0.05表示差异具有统计学意义。
2 结果
2.1 一般状态:模型大鼠精神萎靡,进食少,毛发松散光泽度低,粪便呈糊状或水样便。治疗后大鼠精神状态改善,进食、活动增加,皮毛较前整齐,粪便转为香肠状。各组大鼠无死亡或脱落。体质量比较见表2。
表2 给药前后大鼠体质量的比较(±s,g)
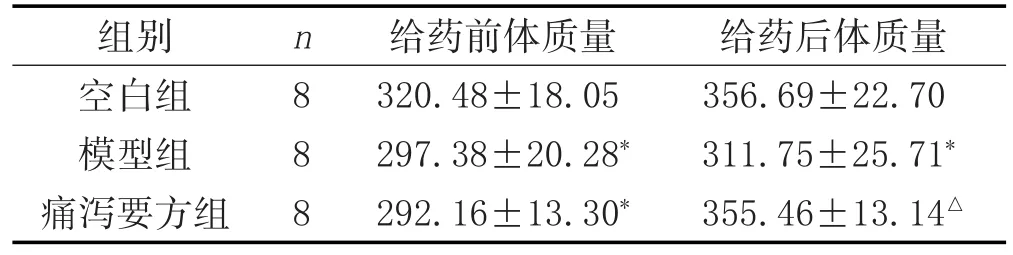
表2 给药前后大鼠体质量的比较(±s,g)
注:与空白组比较,*P<0.01;与模型组比较,△P<0.01。
给药后体质量356.69±22.70 311.75±25.71*355.46±13.14△组别空白组模型组痛泻要方组n8 8 8给药前体质量320.48±18.05 297.38±20.28*292.16±13.30*
2.2 各组大鼠粪便含水量、Bristol积分及稀便率的比较:见表3。
表3 给药前后各组大鼠粪便含水量、Bristol积分及稀便率变化(±s)

表3 给药前后各组大鼠粪便含水量、Bristol积分及稀便率变化(±s)
注:与空白组比较,*P<0.01;与模型组比较,△P<0.01。
组别空白组模型组痛泻要方组给药后2.50±4.63 35.76±14.56*14.21± 8.34△n 8 8 8粪便含水量(%)给药前31.92±8.15 57.49±8.19*55.48±7.06*给药后31.62±8.31 56.86±6.05*33.88±7.85△Bristol积分(分)给药前3.00±0.76 6.00±0.76*6.13±0.84*给药后3.25±0.71 6.25±0.71*3.38±0.92△稀便率(%)给药前3.60±5.10 35.67±10.49*34.34±15.28*
2.3 动物行为学评价:各组大鼠旷场实验、悬尾实验的结果比较见表4。
表4 各组大鼠旷场实验及悬尾实验的比较(±s)
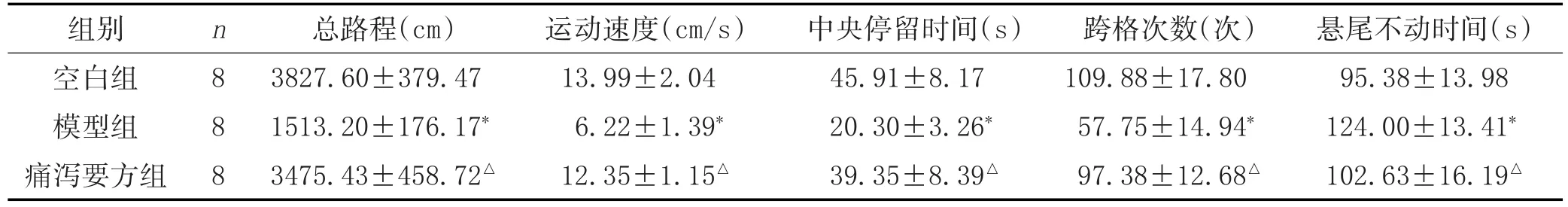
表4 各组大鼠旷场实验及悬尾实验的比较(±s)
注:与空白组比较,*P<0.01;与模型组比较,△P<0.01。
组别空白组模型组痛泻要方组悬尾不动时间(s)95.38±13.98 124.00±13.41*102.63±16.19△n8 8 8总路程(cm)3827.60±379.47 1513.20±176.17*3475.43±458.72△运动速度(cm/s)13.99±2.04 6.22±1.39*12.35±1.15△中央停留时间(s)45.91±8.17 20.30±3.26*39.35±8.39△跨格次数(次)109.88±17.80 57.75±14.94*97.38±12.68△
2.4 各组大鼠血清5-HT、结肠SP水平比较:见表5。
表5 痛泻要方对大鼠血清5-HT、结肠SP水平的影响(±s)
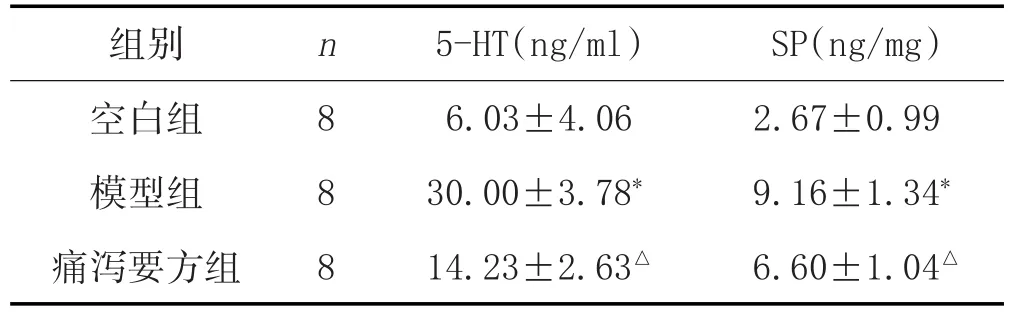
表5 痛泻要方对大鼠血清5-HT、结肠SP水平的影响(±s)
注:与空白组比较,*P<0.01;与模型组比较,△P<0.01。
组别空白组模型组痛泻要方组SP(ng/mg)2.67±0.99 9.16±1.34*6.60±1.04△n 8 8 8 5-HT(ng/ml)6.03±4.06 30.00±3.78*14.23±2.63△
2.5 各组大鼠结肠组织SCF、c-Kit mRNA表达比较:见表6。
表6 痛泻要方对大鼠结肠组织SCF、c-Kit mRNA表达的影响(±s)
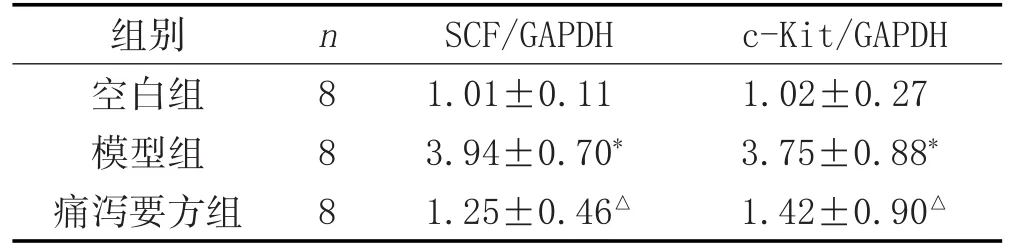
表6 痛泻要方对大鼠结肠组织SCF、c-Kit mRNA表达的影响(±s)
注:与空白组比较,*P<0.01;与模型组比较,△P<0.01。
组别空白组模型组痛泻要方组c-Kit/GAPDH 1.02±0.27 3.75±0.88*1.42±0.90△n8 8 8 SCF/GAPDH 1.01±0.11 3.94±0.70*1.25±0.46△
2.6 SCF、c-Kit mRNA表达与SP、5-HT水平的相关性分析:见表7。
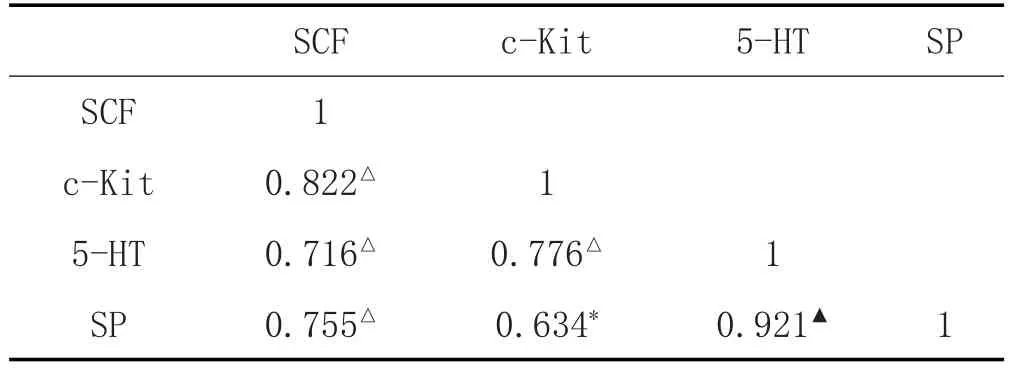
表7 SCF、c-Kit mRNA表达与SP、5-HT水平的Pearson相关系数r
3 讨论
IBS-D属于中医学“腹痛”“泄泻”“郁证”范畴,本病病位在大肠,与肝、脾、肾密切相关,肝郁脾虚是导致IBS-D发生的重要病机。痛泻要方以白术为君,苦甘而温,燥湿补脾和中;白芍为臣,泻肝火,敛逆气,缓急止痛;陈皮为佐,辛苦而温,理气燥湿,醒脾和胃;再配伍少量防风,与术、芍相伍,辛能散肝,香能舒脾,风能胜湿以助止泻之功,又为脾经之引经药。四药相合,脾健肝和,痛泻自止。本研究发现,经痛泻要方治疗后,IBS-D模型大鼠粪便含水量、Bristol积分及稀便率均下降,表明痛泻要方可通过调节胃肠功能以改善大鼠腹泻的症状,旷场和悬尾实验结果提示,痛泻要方能有效改善肝郁脾虚型IBS-D大鼠的精神状态。
SCF是由骨髓基质细胞产生的一种多功能的酸性糖蛋白,c-Kit是由原癌基因c-Kit编码的I型跨膜糖蛋白,是SCF的配体。SCF/c-Kit信号系统调控着多种细胞的生长、发育、分化和凋亡,c-Kit与SCF结合后,启动Ras/Erk等下游通路,作用于肠道Cajal间质细胞(in‐terstitial cell of Cajal,ICC)、肥大细胞(mast cell,MC)等[3]与IBS-D发病相关的细胞。
国内外多项研究显示[3,9],IBS的发病可能与SCF/c-Kit信号系统过度表达有关。SCF通过c-Kit受体诱导肠道MC发育活化增加[10],引起MC分泌5-HT、类胰蛋白酶等,作用于神经末梢相应受体,导致内脏高敏及肠动力紊乱,类胰蛋白酶可激活肠神经释放SP[11],SP、5-HT作用于ICC表面受体,将信号传递给平滑肌细胞,起到调节作用[12]。因此SCF/C-Kit信号系统过表达可能是IBS-D内脏疼痛感知、胃肠动力紊乱的共同环节之一。
本研究中,模型组大鼠结肠中SCF、c-Kit表达升高,痛泻要方灌胃后大鼠结肠组织SCF、c-Kit的mRNA表达明显降低,提示痛泻要方可明显降低肝郁脾虚证IBS-D大鼠SCF/c-Kit系统的过表达。同时,大鼠结肠SCF、c-Kit的表达与5-HT、SP水平呈显著正相关关系,一定程度上验证了脑肠轴中SCF/c-Kit信号系统对5-HT、SP的调节在IBS-D的发生发展中的作用。痛泻要方可能通过SCF/c-Kit信号系统调节5-HT、SP水平,从而改善IBS-D脑肠轴功能异常来达到治疗作用。但是SCF/c-Kit信号系统涉及Ras/Erk、JAK/STAT等多条下游通路[3],痛泻要方治疗IBS-D的具体靶点有待进一步研究。
