补肾平喘方对过敏性哮喘小鼠气道炎症改善效果的实验研究*
2021-07-24袁江程申李岚
袁江 程申 李岚
浙江省中医院 浙江 杭州 310006
支气管哮喘可由机体内源性、外源性免疫系统共同作用引起,内毒素、感染、尘螨均可引起气道炎症[1]。调查显示,我国哮喘患者已达3000万以上,而小于3岁发病的患儿占50%,发病率、死亡率呈逐年递增的趋势[2]。目前,哮喘在临床上以药物对症治疗为主,无法避免免疫系统失衡及激素依赖等问题[3]。中草药复方在防治哮喘方面具有较大的优势,临床研究表明,给予补肾平喘方及其加减方可有效增强哮喘患儿机体免疫力,改善肺功能,具有标本兼治之效[4]。该方对小儿哮喘的改善作用及机制,目前研究仍然有限。因此,本研究探讨补肾平喘方对OVA致过敏性哮喘小鼠气道炎症的改善效果,为补肾平喘方的临床应用提供参考。
1 材料与方法
1.1 实验动物:5周龄BALB/c小鼠,于上海西普尔-必凯实验动物有限公司购买,动物生产许可证号SCXK(沪)2018-0006。饲养于杭州鹰旸生物科技有限公司动物中心,动物使用许可证号为SYXK(浙)2020-0024。自由饮食摄水,适应性喂养1周。
1.2 主要材料:补肾平喘方(组成:熟地20g,淫羊藿15g,附子、麻黄、桂枝、苏子、紫菀各10g,甘草5g。浸泡0.5h,经煎煮、过滤取药液,煎煮3次,合并浓缩至5g/ml,置于冰箱保存备用);卵清蛋白(OVA)、地塞米松(货号:A8040-10、D8040,solarbio);乙酰甲胆碱(Mch)(货号:USP-1396364,USP);IL-4、IL-5、IL-13、IFN-γ、TNF-α 试剂盒(货号:MM-0165M1、MM-0164M1、MM-0173M1、MM-0182M1、MM-0132M1,酶免);IgE试剂盒(货号:CK-E30441,sino best);NF-κB p65、IκBα、TLR4、Foxp3、GAPDH抗体(货号:ab207297、ab32518、ab95562、ab215206、ab8245,Abcam);p-NF-κB p65、p-IκBα抗体(货号:AF2006、AF2002,Affinity)。
1.3 慢性哮喘模型建立及分组:适应性喂养1周后,第1、7、14d,仅空白组腹腔注射200μl生理盐水,模型组、补肾平喘方低、高剂量组、地塞米松组小鼠腹腔注射致敏混悬液[10μg OVA+1mg Al(OH)3],致敏第16d起,空白组雾化吸入10ml生理盐水,其余小鼠雾化吸入含0.1g OVA(30min),攻击3次,连续8周[5]。期间,补肾平喘方低、高剂量组于攻击前1h分别予15、30g·kg-1·d-1补肾平喘方灌胃,地塞米松组予1mg·kg-1·d-1地塞米松,空白组、模型组予等体积生理盐水,每组各6只。
1.4 气道高反应性测定:末次OVA攻击后24h,小鼠呼吸稳定后依次吸入50μl的生理盐水,6.5、12.5、25、50、100mg/ml Mch,EMKA动物肺功能检测系统监测气道阻力。
1.5 炎症细胞计数:麻醉处死小鼠,收集支气管肺泡灌洗液(BALF)、血标本及肺组织。BALF离心,沉淀行瑞士-吉姆萨染色分类计数细胞总数及嗜酸性粒细胞、巨噬细胞、淋巴细胞、中性粒细胞数量。
1.6 ELISA检测:ELISA测定BALF中IFN-γ、IL-4、IL-5、IL-13、TNF-α水平和血清中IgE含量。
1.7 HE、AB-PAS染色:取肺组织切片,分别行HE、ABPAS染色以观察气道周围炎症细胞浸润情况、黏液分泌及杯状细胞增生情况。
1.8 Western blot检测:取适量肺组织,裂解,提取总蛋白,BCA法测定蛋白浓度。Western blot检测肺组织中 p-NF-κB p65、NF-κB p65、p-IκBα、IκBα、TLR4、Foxp3蛋白表达水平。
1.9 统计学处理:应用SPSS 19.0统计软件,计量资料用均数±标准差(±s)表示,两组间用t检验比较,P<0.05为差异有统计学意义。
2 结果
2.1 各组气道高反应性情况:由表1可知,随吸入Mch浓度的升高,OVA诱导的各组气道阻力显著升高。而与模型组相比,补肾平喘方高剂量组可显著下调气道阻力(P<0.05或P<0.01),低剂量组仅在Mch浓度为50、100mg/ml时显著下调气道阻力(P<0.05)。
表1 各组气道阻力结果比较 [±s,cmH2O/(ml·s)]

表1 各组气道阻力结果比较 [±s,cmH2O/(ml·s)]
注:与模型组比较,*P<0.05,**P<0.01。
Mch(mg/ml)0 6.25 12.5 25 50 100地塞米松组97.90±7.38 99.55±12.03 113.79±13.37*124.34±11.43**167.40±19.62**177.66±10.56**空白组100±6.38 104.10±7.02 100±5.36**120.00±14.11**113.33±3.21**132.00±19.17**模型组99.55±4.36 116.53±15.31 150.38±14.86 189.20±14.72 260.44±17.49 371.42±17.90补肾平喘方低剂量组101.48±3.62 111.71±9.47 125.05±7.92 173.78±9.80 215.72±20.02*308.23±26.59*补肾平喘方高剂量组97.15±3.21 105.50±11.94 121.53±7.74*161.10±5.95*188.04±21.01*254.27±25.56**
2.2 各组炎症细胞计数情况:见表2。与空白组相比,模型组BALF中总细胞个数及各炎症细胞数量均显著升高(P<0.01)。与模型组相比,各给药组均可显著降低炎症细胞数量(P<0.05或P<0.01)。
表2 各组炎症细胞计数(±s,105/ml)
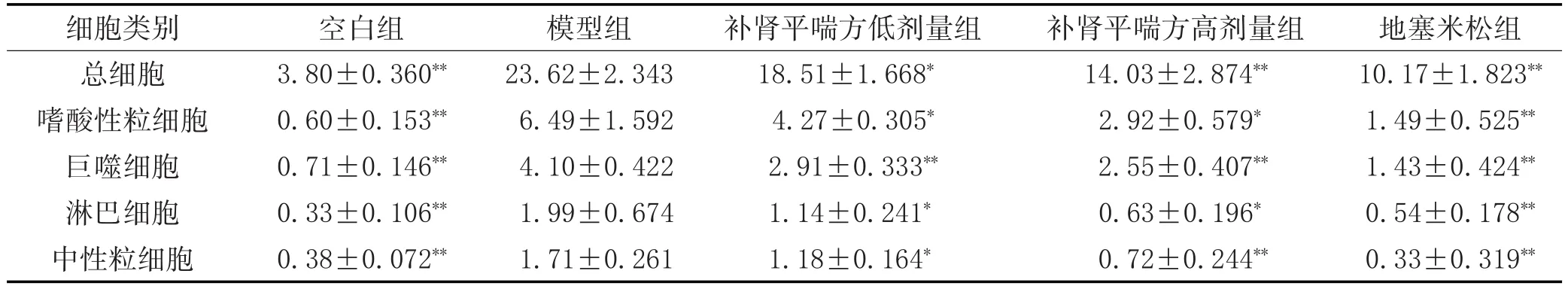
表2 各组炎症细胞计数(±s,105/ml)
注:与模型组比较,*P<0.05,**P<0.01。
细胞类别总细胞嗜酸性粒细胞巨噬细胞淋巴细胞中性粒细胞空白组3.80±0.360**0.60±0.153**0.71±0.146**0.33±0.106**0.38±0.072**模型组23.62±2.343 6.49±1.592 4.10±0.422 1.99±0.674 1.71±0.261补肾平喘方低剂量组18.51±1.668*4.27±0.305*2.91±0.333**1.14±0.241*1.18±0.164*补肾平喘方高剂量组14.03±2.874**2.92±0.579*2.55±0.407**0.63±0.196*0.72±0.244**地塞米松组10.17±1.823**1.49±0.525**1.43±0.424**0.54±0.178**0.33±0.319**
2.3 各组气道炎症因子变化情况:由表3可知,与空白组相比,模型组炎症因子水平显著升高(P<0.01)。与模型组相比,给药组IFN-γ、IL-5、IL-13水平呈不同水平的降低(P<0.05或P<0.01)。
表3 各组气道炎症因子及血清IgE检测结果比较 (±s)

表3 各组气道炎症因子及血清IgE检测结果比较 (±s)
注:与模型组比较,*P<0.05,**P<0.01。
指标IFN-γ(ng/ml)IL-4(pg/ml)IL-5(pg/ml)IL-13(pg/ml)TNF-α(ng/ml)IgE(ng/ml)地塞米松组0.724±0.164**60.358±5.656**61.505±4.027**38.795±4.687**0.897±0.076**136.522±18.707**空白组0.795±0.163**54.483±7.774**41.548±5.491**22.023±4.950**1.253±0.164**88.044±12.242**模型组1.329±0.138 75.545±8.845 90.495±11.951 57.573±11.024 1.825±0.183 262.610±35.462补肾平喘方低剂量组1.134±0.120*67.098±7.307 76.630±6.792*44.428±3.392*1.600±0.164*210.455±27.935*补肾平喘方高剂量组1.032±0.118**63.940±6.959*70.775±8.241**45.753±1.441*1.464±0.148 181.81±21.213**
2.4 各组血液中IgE水平:见表3。与空白组相比,模型组血液中IgE水平显著升高(P<0.01)。与模型组相比,各给药组IgE水平显著降低(P<0.05或P<0.01)。
2.5 HE、AB-PAS染色:见图1。由图1a可知,空白组肺组织结构完整,无明显炎性细胞浸润;而模型组炎症细胞浸润明显。中、高剂量补肾平喘方处理后,炎症细胞浸润较模型组显著减少。由图1b可知,空白组支气管、肺组织结构清晰;而模型组黏液分泌明显增多,支气管杯状细胞增生。中、高剂量补肾平喘方处理后,黏液分泌、杯状细胞增生受到抑制。

图1 a:HE染色(×200,400);b:AB-PAS染色(×200,400)。
2.6 Western blot检测:见图2。与空白组相比,模型组p-NF-κBp65/NF-κBp65、p-IκBα/IκBα与 TLR4表达水平显著升高(P<0.01),Foxp3表达水平显著降低(P<0.01)。与模型组相比,给药处理可降低p-NF-κBp65/NF-κBp65、p-IκBα/IκBα与TLR4表达,提高Foxp3表达。

图2 肺组织中相关蛋白表达
3 讨论
哮喘在中医学中属“哮症”“喘症”等范畴,病性本虚标实,与脾、肺、肾三脏亏虚有关,肺肾气虚,宿痰伏于肺为其主要病机,治宜补肺益肾、平喘化痰为要[6]。补肾平喘方为临床经验方,可有效抑制哮喘患儿机体炎症反应,改善肺功能[4]。是方中,淫羊藿为补命门、益精气、补肾壮阳之要药;附子回阳救逆,补火助阳,散寒止痛,为君药;配以麻黄、桂枝发汗解表、宣肺平喘、通阳降逆,苏子、紫菀降气消痰、止咳平喘,可达祛邪之效,为臣药;熟地补肾滋阴、益精填髓,为佐药;甘草为使药,调和药性。方剂配伍切合哮喘病机,恰为对症之良方。且现代药理学研究表明,淫羊藿苷可上调肺组织Nrf2、HO-1表达,同时可抑制氧化应激反应,起到平喘的作用[7];附子可增强免疫力、抗炎镇痛[8]。
气道慢性炎症是哮喘的病理基础。Th1/Th2失衡在诱导气道炎症进展中具有至关重要的作用。IFN-γ由Th1细胞产生,可激活巨噬细胞;IL-4、IL-5、IL-13由Th2细胞分泌,可诱导嗜酸性粒细胞产生和募集,且能促进IgE生成,在哮喘中起着重要作用[9]。此外,研究证实,在哮喘中,TLR4可调控TNF-α等炎性因子水平表达,NF-κB作为TLR4的下游靶点,其活化也可起到加重炎症反应的作用[10]。本研究中,补肾平喘方除了可以显著降低气道阻力,减少炎性细胞浸润外,还可显著降低IFN-γ、IL-4、IL-5、IL-13、TNF-α及IgE水平,下调哮喘小鼠肺组织中p-NF-κBp65、p-Iκ-Bα与TLR4蛋白表达,上调Foxp3蛋白表达。说明补肾平喘方可调节Th1/Th2平衡并介导TLR4/NF-κB信号,减轻气道炎症反应,发挥防治哮喘的作用。
综上所述,补肾平喘方可有效改善过敏性哮喘小鼠气道炎症,发挥平喘作用。
