山黧豆根腐病病原菌亚洲镰孢菌的分离鉴定
2021-07-05邢会琴王春明金社林周天旺
邢会琴, 王春明, 金社林, 周天旺, 郭 成
(1. 河西学院农业与生态工程学院, 甘肃 张掖 734000;2. 甘肃省农业科学院植物保护研究所, 甘肃 兰州 730070)
山黧豆(Lathyrussativus)作为豆科(Leguminosae)山黧豆属(Lathyrus)一年生作物,广泛种植于世界各地[1]。其营养丰富,含有蛋白质、氨基酸、淀粉、碳水化合物和脂肪等[2],为饲肥兼用作物[3],主要分布在干旱、半干旱地区[4]。目前常被用作绿肥作物在生产上推广应用。山黧豆具有抵御各种逆境的优良性状,对环境的适应性强,能在干旱、贫瘠、盐碱和水涝等恶劣条件下生长[5-7],且山黧豆作为豆科作物,本身具有很强的固氮能力[8],在其生长过程中,形成的根瘤可以固定空气中存在的氮素,固定的氮素一部分用于山黧豆自身生长所需,另外一部分增加了土壤中的氮素含量,具有改良土壤、培肥地力的功效。山黧豆是可持续农业发展农业模式中的重要作物[9],尤其适宜种植于我国西北地区干旱、高寒、贫瘠的山区及丘陵沟壑区[10]。研究表明,长期种植林生山黧豆的人工草地土壤盐分含量明显降低,土壤pH值显著降低[11]。近年来,在山黧豆种植过程中根腐病发生率日益增加,本研究于2018年8月在四川省南充市调查时发现,山黧豆根腐病发生严重,通过采集病样、分离纯化共获得39株单孢分离物,并采用贴菌饼法和拌菌土法接种山黧豆对其致病性进行研究,结果发现其中3株分离物对山黧豆具有很强的致病性。为了确定这3株分离物的分类地位,本研究通过形态学和翻译延伸因子(Translation elongation factor 1-agene,EF-1α)序列分析对其进行鉴定,旨在为山黧豆根腐病的综合防控提供理论依据。
1 材料与方法
1.1 病样采集及症状观察
2018年8月从四川省南充市采集感病的山黧豆植株,观察记录发病症状,并带回实验室进行分离鉴定。
1.2 病原菌分离纯化
采用组织分离法[12],将发生根腐病的山黧豆根部清洗干净,植株的根颈部作为分离材料,切取发病部位根段浸泡在70%乙醇中进行表面消毒30~60 s后,无菌水冲洗3次,用灭过菌的剪刀将消过毒的发病根段剪成2 mm×5 mm大小的组织块,用灭菌滤纸吸干组织块表面的水分,置于PDA(DifcoTMPotato Dextrose Agar 39 g、蒸馏水1 000 mL)平板上,每皿放5个组织块,将平皿倒置于培养箱中,25℃恒温黑暗培养。待接种组织块边缘长出菌丝后,根据颜色和形态的差异轻轻挑取菌丝接种到PDA平板上进行初步纯化后,采用稀释法[13]进行单孢分离,并将分离物接种于PDA斜面上培养好后4℃保存备用。
1.3 致病性测定
贴菌饼法:将供试菌株Shan-27,Shan-28和Shan-29接种到PDA平板上培养5 d后,用灭菌打孔器打取直径5 mm的菌饼贴于催芽后的山黧豆胚根处,对照贴空白PDA,将接种后的山黧豆放置于培养皿内,以无菌水浸湿的滤纸进行保湿,2 d后移去菌饼,正常保湿培养,逐天观察山黧豆胚根发病情况。
拌菌土法:接种体的制备参考玉米镰孢茎腐病繁殖体的制备[14]略作修改,将供试菌株Shan-27,Shan-28和Shan-29接种到PDA平板上培养7 d后,用灭菌打孔器打取直径10 mm的菌饼5块,接种于灭菌的玉米粒基质中,室温培养15 d后备用。将山黧豆种子在75%乙醇中浸泡5 min进行表面消毒后,用无菌水冲洗3次,晾干后播种于装有灭菌蛭石的花盆中(每盆播种20~25粒),每盆接种10 g接种体(分别接种了分离物Shan-27,Shan-28和Shan-29菌株的玉米粒),对照不接菌,每处理3次重复,置于室温下正常管理,逐天观察发病症状,于播种后25 d统计发病率并拍照。
1.4 病原菌的形态观察
将分离物接种于PDA平板上于25℃恒温培养,并观察菌落形状、色泽及生长速度等特征。培养5 d后在显微镜下观察分生孢子的形状、大小、隔膜数等。参考Leslie等的镰孢菌实验手册[15]对病原菌进行形态学鉴定。
1.5 EF-1a序列分析
在PDA培养基上将菌株Shan-27,Shan-28和Shan-29进行培养,直接刮去菌丝后用滤纸吸干水分备用。选用EF-1α引物[16]进行PCR扩增。参考Geiser等[17]的方法进行PCR扩增并测序。获得的序列与从GenBank数据库中获得的相关镰孢菌EF-1α基因序列进行比较,利用Megalign 7.1软件以NJ法构建系统发育树,确定菌株Shan-27,Shan-28和Shan-29的分类地位。
2 结果与分析
2.1 山黧豆根腐病田间发病症状
通过田间调查发现,受害山黧豆植株初期叶片发黄,随着病情进一步扩展植株出现萎蔫、倒伏,严重者植株枯死(图1A),拔出植株观察其根茎部发现发病植株地下部分须根数减少,根系生长受阻,严重的根系变褐腐烂。正常山黧豆植株叶色浓绿,根系发达,生长良好(图1B)。

图1 山黧豆根腐病田间发病症状Fig.1 The symptom of L.sativus root rot in the field注:A为发病山黧豆;B为正常山黧豆Note:A,disease L.sativus;B, normal L.sativus
2.2 山黧豆根腐病分离纯化结果
通过组织块分离、单孢纯化,从感病植株根颈部共分离得到39株分离物,其中3株分离物初步鉴定为禾谷镰孢菌复合种(F.graminearumspecies complex)(菌株编号为:Shan-27,Shan-28,Shan-29),分离频率为7.69%。
2.3 致病性测定结果
选取初步确定的3株禾谷镰孢菌复合种(F.graminearumspecies complex)分离物,采用胚根贴菌饼法接种山黧豆胚根处。结果表明,接种山黧豆后胚根均能发病,发病部位初现褐色,进而随着病斑的扩展,整个根系及根尖均变褐(图2A),3个菌株的发病率均达到100%,而对照均无明显发病症状(图2B)。从病根处再次分离得到的菌株其性状均与第一次分离获得的菌株相同。
用初步确定的3株禾谷镰孢菌复合种分离物的带菌基质拌土接种山黧豆种子。结果表明,接种后山黧豆植株均能发病。接种后20 d植株出现萎蔫,随着病情进一步发展,植株倒伏、枯死(图3A),拔出植株,可见其根颈部发褐,严重的根系变褐腐烂、生长受阻(图3B),对照均未发病(图3C,D)。对发病根茎部进行病原菌再分离、纯化培养,得到与原接种所用菌株相同的病原菌,分离率为100%。说明分离物Shan-27,Shan-28及Shan-29是山黧豆根腐病的致病菌。同时致病性测定表明,分离物Shan-27,Shan-28和Shan-29接种山黧豆后,引起的植株发病率分别为73.75%,66.22%和89.20%,3个菌株均表现对山黧豆具有较强致病性,可作为后续研究菌株。

图2 接种菌株Shan-29后山黧豆根茎部发病症状Fig.2 The symptom of L.sativus after inoculation with Shan-29 strain注:A为接种7 d后的症状;B为对照Note:A,the symptom after inoculation seven days;B,the control

图3 接种菌株Shan-29后山黧豆发病症状Fig.3 The symptom of L.sativus after inoculation with Shan-29 strain注:A,B为接种后25 d发病症状;C,D为对照Note:A,B,the symptom after inoculation twenty-five days;C,D,the control
2.4 病原菌菌落形态及显微特征
该菌在PDA培养基上气生菌丝白色(图4A),絮状、繁茂、致密,培养7 d后菌落背面产生玫瑰红色素(图4B)。25℃和28℃条件下在PDA上培养3 d的平均生长速度分别为20.2 mm·d-1和20.7 mm·d-1。在CLA上培养20 d后显微观察产生大型分生孢子,大型分生孢子体长(2.95~4.88)μm×(14.65~40.48)μm,隔膜多见4~5个,偶见3个或6个,顶胞呈鸟嘴状,稍弯,足胞不明显(图4C,D)。
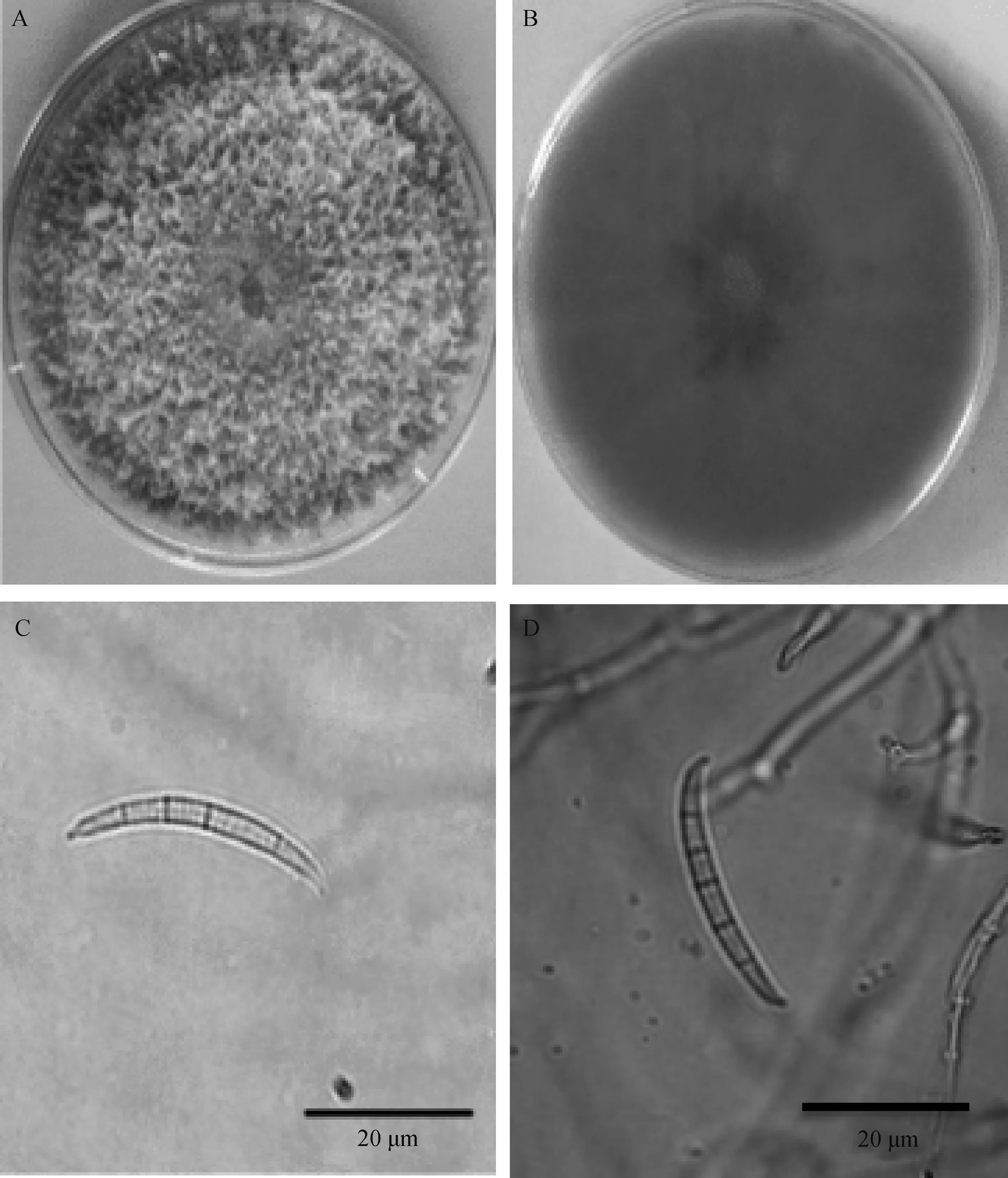
图4 菌株Shan-29形态特征Fig.4 The morphology of Shan-29 strain注:A为PDA上培养7 d的菌落形态;B为PDA上培养7 d的菌落背面及产生的色素;C,D为分生孢子Note:A,the colony front morphology on PDA after cultivation seven days;B,the colony back morphology on PDA after cultivation seven days;C,D,conidium
2.5 EF-1α基因序列分析
测序后所得序列经与GenBank数据库中镰孢菌属EF-1α基因序列比对发现:菌株Shan-27,Shan-28和Shan-29的EF-1α基因序列与亚洲镰孢菌(KM062024,LC546964和LC500692)的亲缘关系最近,同源性达99%以上。利用Megalign 7.0软件,采用NJ法构建基于EF-1α基因序列系统发育树,3个菌株与亚洲镰孢菌(KM062024,LC546964和LC500692)均聚类于同一分支上。因此,结合形态学观察与分子生物学分析,将分离获得的3个致病菌株Shan-27,Shan-28和Shan-29鉴定为亚洲镰孢菌(F.asiaticum)。

图5 基于EF-1α建立的菌株Shan-29,Shan-28和Shan-27的系统发育树Fig.5 Phylogenetic tree of isolated Shan-29,Shan-28 and Shan-27 based on EF-1α
3 讨论
根腐病是豆科作物重要的土传病害之一,给豆科作物的种植带来了巨大的经济损失。据报道多种病原真菌可引起豆科作物根腐病。国内王春华等[18]报道木贼镰孢菌(F.equseti)、尖孢镰孢菌(F.oxysporum)、终极腐霉菌(Pythiumuultimum)和立枯丝核菌(Rhizoctoniasolani)均能引起新疆花芸豆(Phaseolusvulgaris)根腐病;郑培娥[19]在对新疆大豆(Glycinemax)根腐病病原菌种类的研究中发现,尖孢镰孢菌(F.oxysporum)、禾谷镰孢菌(F.graminearum)、茄腐镰孢菌(F.solani)、茄腐镰孢菌蓝色变种(F.solanivar.coeruleum)、立枯丝核菌(R.solani)、燕麦镰孢菌(F.avenum)和瓜果腐霉菌(P.aphanidenatum)是引起新疆大豆根腐病的病原菌;吴仁峰等[20]对武汉豇豆(Vignaunguiculata)根腐病病原菌研究中发现,茄腐镰孢菌可引起该地区豇豆根腐病;杨帅等[21]研究认为,层出镰孢菌(F.proliferatum)可引起江苏省和安徽省大豆根腐病;张河庆等[22]研究认为,共享镰孢菌(F.commune)可引起四川省成都市豇豆根腐病;闫文雪等[23]对山东省豇豆根腐病的病原菌类型研究中发现,茄病镰孢菌大豆专化型(F.solanif.sp.glycines)可引起该地区豇豆根腐病;从丽丽等[24]对内蒙古临河、山西阳高县和河北廊坊紫花苜蓿根腐病病原研究中发现,三线镰孢菌(F.tricinctum)、腐皮镰孢菌(F.solani)和层出镰孢菌具有较强致病性,可引致苜蓿根腐病发生。国外Suleiman M N等[25]认为,瓜果腐霉与立枯丝核菌是尼日利亚豇豆根腐病的致病菌;Satish L等[26]认为,菜豆壳球孢菌(Macrophominaphaseolina)可引起印度豇豆根腐病。本研究结果表明,引致四川省南充市山黧豆根腐病的病原为亚洲镰孢菌(F.asiaticum)。由此可见,引起不同豆科植物根腐病的病原菌不尽相同,不同地区的优势菌也存在明显差异。亚洲镰孢菌是瘤座孢科(Tuberculariaceae)镰孢菌属(Fusarium)的重要植物病原真菌,可引起多种植物病害,如侵染小麦(Triticumeastivum)、大麦(Hordeumvulgare)和玉米(Zeamays)等引起赤霉病、茎腐病、穂腐病等[27-29],但作为山黧豆根腐病的病原菌在国内外鲜有报道。
亚洲镰孢菌作为禾谷镰孢菌复合种之一,其在形态上很接近其姊妹种禾谷镰孢菌,因此采用传统的形态学方法很难准确将其区分开来;为了更准确、可靠地将其鉴定到种,本研究在形态学研究的基础上,通过EF-1α基因序列分析进一步明确其分类地位,将其鉴定为亚洲镰孢菌。
本研究明确了亚洲镰孢菌可引起南充市山黧豆根腐病,但在四川省其他地区或其他种植山黧豆省份是否也分布有亚洲镰孢菌还有待于进一步研究。
4 结论
经调查发现,2018年8月四川省南充市山黧豆根腐病发生严重,从病株上分离获得3株分离物对山黧豆具有较强致病性,通过形态学观察和EF-1α基因序列分析将3个致病菌株确定为亚洲镰孢菌(F.asiaticum)。本研究明确了四川省南充市山黧豆根腐病的病原分类地位,对该病害的进一步研究和防治提供了科学依据。
