纳米晶Cu3SnS4的制备与带隙调整
2021-06-30胡永茂赵占强谢再新段卓琦李汝恒
胡永茂,赵占强,谢再新,段卓琦,周 豹,李汝恒
(大理大学工程学院,云南大理 671003)
Ⅰ-Ⅳ-Ⅵ族Cu-Sn-S化合物(CTS)包含的元素无毒、资源丰富、价格低,具有使用成本低、环境友好的特点。CTS与铜铟镓硒(CIGS)相比,具有对环境更加友好的元素成分,与铜锌锡硫(CZTS)相比,没有Zn元素,避免了半径相近的铜锌原子相互占位而形成 的 带 尾 态〔1-2〕。CTS主 要有Cu2SnS3、Cu3SnS4和Cu4SnS43种,均为P型半导体,带隙范围为0.8~1.7 eV,光吸收系数为~104cm-1〔1,3〕。纳米晶Cu3SnS4具有合适的带隙和较高的光吸收系数,在太阳能利用、气敏传感和热电转换等领域中被广泛应用和深入研究〔3〕。然而,由于其晶体结构的多样性和较宽范围的带隙值,在实际应用中需要进行优化和调整。
Cu3SnS4的矿物名称为“硫锡铜矿”,英文名称为“kuramite”,晶体结构主要有四方相、立方相和斜方相3种〔3〕,见图1。Cu3SnS4的电子结构与CuS相似,其中的Cu具有+1和+2两种价态,具有较高的空穴浓度(~1022cm-3),呈现金属性。理论研究表明,Cu-Sn-S组成的化合物中,Cu3SnS4有仅次于Cu2SnS3的较宽广的稳定区域,见图2〔4〕。在制备纳米晶Cu3SnS4的过程中,存在易挥发的SnS中间相,容易造成最终化合物组成元素比例的差异,不同的Sn∕S和Cu∕Sn比例直接影响最终产物的晶体结构〔5〕。
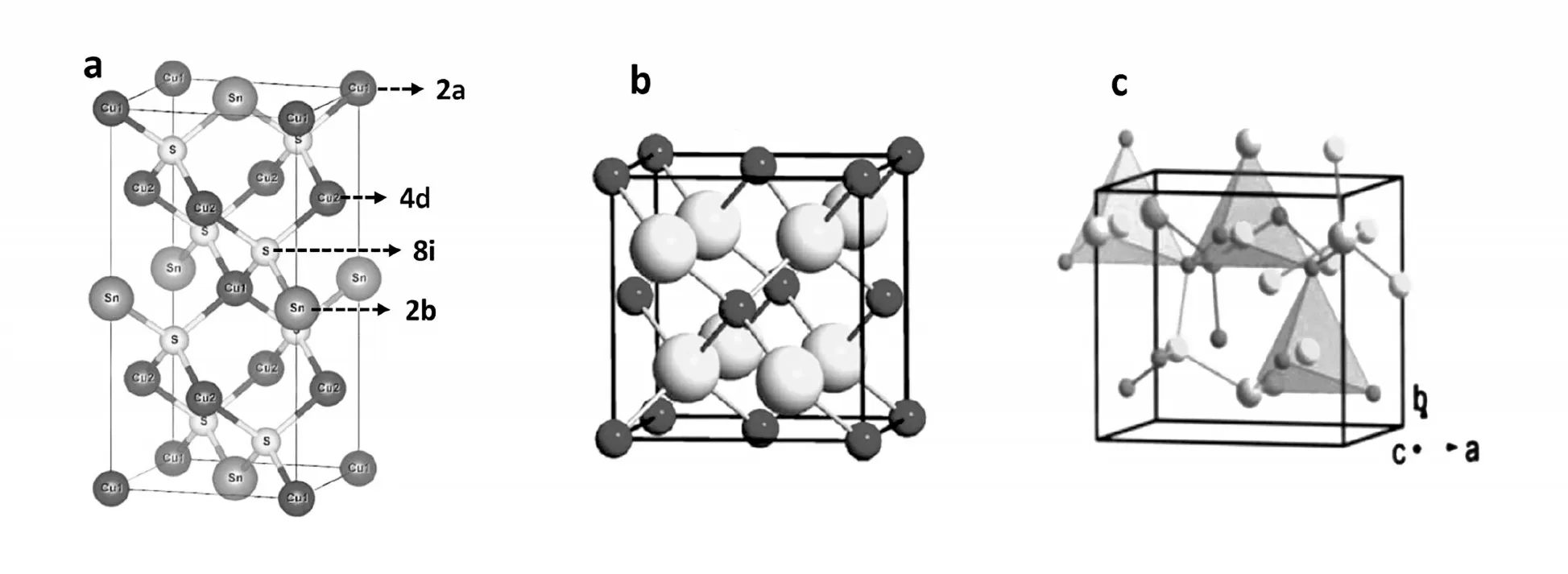
图1 Cu3SnS4的晶体结构
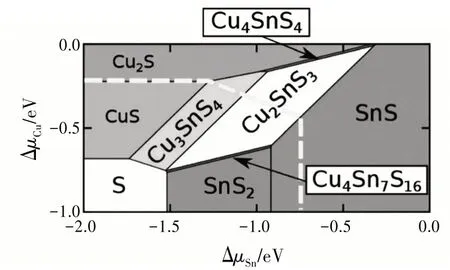
图2 Cu-Sn-S系统化学势相空间的理论计算示意图
1 纳米晶Cu3SnS4的制备
纳米晶Cu3SnS4的制备方法较多,主要有磁控溅射法、真空蒸镀法、旋涂法等制备纳米晶薄膜,溶剂热法、喷雾热解法和球磨法等制备纳米晶粉体。
1.1 磁控溅射和共蒸发法制备薄膜 Fernandes等〔6〕运用直流磁控溅射顺序沉积Sn-Cu金属前躯体薄膜并进行硫化,制备出了Cu2SnS3和Cu3SnS4薄膜。溅射腔本底气压为6×10-4Pa。溅射过程在工作气压为2×10-1Pa的Ar中进行,溅射Cu和Sn薄膜的功率密度分别为0.16 W∕cm2和0.11 W∕cm2。前躯体薄膜沉积好后移入管状炉,通入流速为40 mL∕min的N2,工作压强设定为55 Pa。样品分别在350、400和520℃下硫化。为消除样品结晶过程中形成的杂相,他们对样品进行了KCN化学处理:样品依次加入10%w∕w的KCN溶液和50%V∕V的乙醇∕去离子水溶液,之后用去离子水洗涤。最后,所有样品在N2环境下干燥。通过X射线能谱(EDS)和电感耦合等离子体(ICP)分析,发现硫化后的薄膜厚度均有不同程度的增加。当硫化温度升高到520℃时,Sn的损失量增加,同时伴随有Cu2-xS生成。扫描电子显微镜(SEM)显示,所制备出的薄膜表面粗糙并存在稀疏空隙结构。
Robles等〔7〕运用共蒸发法,通过改变铜蒸发速率rCu和衬底温度Tsus等参数,在钙钠玻璃基板上制备出1.5 mm厚度的Cu3SnS4和Cu4SnS4薄膜。实验中,锡源温度固定在1 100℃,对应的蒸发速率为rSn=6 nm∕min,铜源温度设定在1 170~1 200℃,对应的蒸发速率为rCu=10~16 nm∕min。硫化(退火)温度设定为500℃。研究发现,当铜蒸发速率和衬底温度分别为rCu=10 nm∕min,Tsus=450℃时,获得了1.5 mm厚的正交相纳米晶Cu3SnS4薄膜,其带隙为1.4 eV,电阻率为7.9×10-4Ω·cm;在rCu=10 nm∕min和Tsus≤350℃条件下制备的产物为CuS和Cu2SnS3混合物,退火后获得了正交相的纳米晶Cu3SnS4薄膜;在rCu=16 nm∕min和Tsus=350℃条件下制备的CuS和Cu2SnS3混合物退火后,获得了正交相的纳米晶Cu4SnS4薄膜,其平均晶粒尺寸为36 nm,带隙为1.2 eV,电阻率为8.2×10-2Ω·cm。
1.2 溶剂热法制备粉体 溶剂热法是一种利用高压和高温环境提高固体在溶剂中的溶解度,同时提高反应速率制备纳米材料的方法。Hu等〔8〕将0.3 mmol的CuCl2·2H2O,0.1 mmol的SnCl2·2H2O(或0.1 mmol的SnCl4·5H2O)和0.4 mmol的硫脲(CSN2H4)依次添加到高压釜中,接着加入乙醇至高压釜总体积的90%,将高压釜密封,并在200℃下保持12 h。自然冷却后,经洗涤、干燥,制备出了四方相的 纳 米 晶Cu3SnS4粉 体。Chen等〔9〕将CuAc2·H2O(0.06 mmol),SnS4·5H2O(0.02 mmol)和硫代乙酰胺(0.08 mmol)加入高压釜中,先在室温下搅拌30 min,随后将温度升至200℃保持12 h后自然冷却至室温,然后将沉淀物滤出,用无水乙醇和去离子水洗涤数次,最后将最终产物在60℃下干燥。获得的产物为四方相3D分层的花状纳米Cu3SnS4微球。纳米Cu3SnS4微球的形成机理解释为:在初始反应阶段,Cu2+离子倾向于与硫代乙酰胺反应形成CuS。形成的CuS将在反应过程中聚集并形成小的3D分层结构。随着反应的进行,新形成的CuS微球将与溶液中剩余的Cu+、Sn4+和S2-反应,并形成结构稳定且结晶度良好的花状纳米Cu3SnS4微球。这些微球的结晶度和尺寸随反应时间的增加而逐渐增加,最终形成具有3D分层的花状纳米Cu3SnS4微球。Chen等〔10〕将Cu、Sn和S(或Se)粉溶于乙二胺中配置成前躯体溶液,在250~300℃温度范围内保持10~12 h,制备了Cu4SnS4和Cu2SnS3纳米棒以及Cu3SnS4和Cu2SnSe4纳米颗粒。X射线衍射(XRD)分析发现,实验获得的Cu4SnS4、Cu2SnS3纳米棒为斜方相,Cu3SnS4纳米颗粒为四方相,Cu2SnSe4纳米颗粒为立方相。
Nazari等〔11〕将CuCl2·2H2O(2 mmol),FeCl2·4H2O(Xmmol,X=0.0,0.2,0.4,0.6,0.8,1.0),SnCl2·2H2O(1-Xmmol)和硫脲(3 mmol)加入40 mL的乙二醇中,均匀搅拌直至获得乳状悬浮液后转移至高压釜中,然后移至温度为220℃的烤箱中保持24 h,最后经冷却、洗涤和干燥后获得Cu3FexSn1-xS4纳米粉体。分析表明,无Fe原子加入的纯Cu3SnS4(X=0.0)的晶体结构为四方相;当加入的Fe含量为20%时,仍然保持Cu3SnS4的四方相结构;继续增加Fe的含量至40%、60%、80%时,Cu3SnS4的四方相结构转变成了Cu2FeSnS4的四方相结构,并且发现当Fe含量达到80%时形成四方相结构的花状Cu2FeSnS4纳米粉体,其带隙值为1.45 eV。
Guan等〔12〕将CuCl2·2H2O(2 mol∕L),Zn(CH3COO)2·2H2O(1 mol∕L),SnCl2·2H2O(1 mol∕L)和H2NCSNH2(4 mol∕L)加入40 mL乙二醇溶液中,在45℃的环境下持续搅拌40 min,形成透明的黄色胶状前驱体溶液。将该液体移至高压釜中并在200℃下保温24 h,然后自然冷却至室温。最后,经过乙醇和去离子水洗涤并干燥处理后获得了花状Cu2ZnSnS4(CZTS)纳米粉体,其带隙值为1.29 eV。
Maheskumar等〔13〕采用溶剂热法制备了纳米晶Cu3SnS4粉体,研究了去离子水、N,N-二甲基甲酰胺和聚乙二醇3种不同溶剂对最终产物的影响。实验发现,通过改变溶剂,可以实现Cu3SnS4的形貌和带隙的调整。利用上述3种溶剂制备的Cu3SnS4形貌分别为不规则的片状结构、中孔结构和羽毛状结构,带隙值分别为1.33、1.65和1.19 eV。Liu等〔14〕将3 mmol的CuCl2·2H2O,1 mmol的SnCl2·2H2O和4 mmol的硫脲溶解在40 mL的C6H18N4溶液中,获得蓝色前躯体(Ⅰ),然后将前躯体(Ⅰ)在130℃下保温30 min,再将温度升高至180℃并保温30 min后,前躯体(Ⅰ)转化为黑色前躯体(Ⅱ)。将Mn2+加入前躯体(Ⅱ),当MnC4H6O4·4H2O浓度增加到0.016 mol∕L时,Cu2Cu1-xMnxSnS4(CMTS)的带隙从1.67 eV降到了1.45 eV。当前驱体(Ⅱ)中的MnC4H6O4·4H2O浓度超过0.012 mol∕L时,Mn2+替代Cu2+会引起晶粒细化并在晶粒边界处形成非晶层。
1.3 喷雾热解法制备薄膜和粉体 Prabhakar等〔15〕将CuCl2·2H2O(0.2 mol∕L),MnCl2·2H2O(0.1 mol∕L),SnS2·2H2O(0.1 mol∕L)和硫脲(0.1 mol∕L)加入去离子水中获得前躯体溶液。通过喷雾热解法制备出纳米CMTS薄膜。通过对薄膜厚度的优化和Na元素掺杂,使得CMTS太阳能电池的功率转换效率提高到0.73%。Patel等〔16〕采用CuCl2·2H2O、SnCl4·5H2O和硫脲作为前躯体,采用喷雾热解法制备了Cu2SnS3薄膜。实验发现,所制备的Cu2SnS3与Cu3SnS4并存,随Cu浓度的增加,其带隙从1.73 eV降低到了1.29 eV。Guo等〔17〕将CuCl2·H2O(0.18 mol∕L),SnCl4·H2O(0.1 mol∕L)和硫脲(1.4 mol∕L)溶解于蒸馏水中,制备出Cu2SnS3前驱体溶液(Ⅰ),将浓度均为0.1 mol∕L的MgCl2·6H2O或CuCl2·H2O溶解于装有蒸馏水的蒸馏器中,制备出Cu2+或Mg2+前驱体溶液(Ⅱ)。以这两种前躯体溶液为原材料采用超声喷涂法合成了纯Cu2SnS3和Cu2XSnS4(X:Cu,Mg)纳米薄膜。通过SEM分析,发现薄膜表面光滑,颗粒细小。Cu2MgSnS4薄膜由不规则的小颗粒组成,而Cu2CuSnS4薄膜则由形如花椰菜的芽状颗粒组成。制备的P型Cu2SnS3、Cu2CuSnS4和Cu2MgSnS4纳米晶薄膜带隙值分别为1.40、1.65和1.76 eV。
1.4 球磨法制备纳米粉体 近年来,虽然关于纳米晶Cu3SnS4的光学性质和形貌结构研究成为热点,但很少有运用球磨法制备纳米晶Cu3SnS4粉体的报道。Maheskumar等〔18〕分别采用溶剂热法和球磨法制备纳米晶Cu3SnS4粉体,并进行了比较分析。该研究组将3 mmol的CuCl2·2H2O,1 mmol的SnCl2·2H2O和4 mmol的硫脲溶解在90 mL的乙二醇中连续搅拌30 min,获得前躯体溶液。然后,将前驱体溶液移至高压釜中密闭,在180℃下加热2 h后,自然冷却至室温,用去离子水和无水乙醇洗涤数次,经真空干燥后制备出较高纯度的纳米晶Cu3SnS4粉体。从SEM图片观察到大量均匀的花状微球,且这些微球由许多相互交叉的纳米薄片组成。作为对比,该研究组将Cu、Sn和S按照3:1:4的摩尔比进行混合作为前躯体,放入装有直径为5 mm ZrO2研磨球的容器中,分别研磨20、30、40、50和60 h,制备出纳米晶Cu3SnS4粉体。发现随球磨时间的延长,样品颗粒逐步细化,小颗粒之间的相互作用增加,表现出强烈的聚集性,同时带隙逐渐增加。研磨60 h后的Cu3SnS4出现正方相结构的衍射峰,没有二次杂质峰,样品具有较高的光吸收系数。
除上述制备纳米晶Cu3SnS4的常用方法之外,也有一些不太常用的方法,如Lokhande等〔19〕报道了一种利用热注入技术(hot injection technique)制备纳米晶Cu3SnS4粉体的方法。先将一定量的CuSO4·XH2O和SnSO4·2H2O溶解在油胺(OLA)中形成混合溶液,该混合溶液置于三颈烧瓶中并用Ar净化,随后将溶液温度升至160℃保持30 min,之后将温度升至240℃,同时注入硫粉。整个实验中的升温速率为5℃∕min。待体系反应30 min后,经沉淀、洗涤和干燥后得到纳米晶Cu3SnS4粉体。XRD分析发现,生成物在Cu∕Sn比为1.75时形成四方相的纳米Cu3SnS4粉体。
综上所述,无论是制备纳米晶薄膜还是粉体,磁控溅射法和溶剂热法是比较常用的方法。磁控溅射法虽然成膜率高,重复型好,但成本相对较高,而且需要考虑靶材成分的择优溅射问题。溶剂热法可以通过改变工艺条件控制最终产物的晶体结构、形貌和尺寸,可选择的溶剂类型多样,具有成本低、可控性好、易操作的特点,有利于大规模生产。
2 纳米晶Cu3SnS4的带隙调整
由于纳米晶Cu3SnS4结构的多样性和较宽的带隙值范围,在实际应用中,需要进行优化和调整。Cu3SnS4的带隙调整是近年来的研究热点之一。调整纳米化合物的带隙可以从两方面入手,一是改变制备条件,获得不同结构和形貌的晶体;二是通过掺杂和元素取代,达到带隙调整的目的。
2.1 通过改变晶体结构调整带隙 Su等〔20〕采用连续离子层吸附反应(SILAR)法,用氟化铵作为Sn2+的络合剂,将CuSO4和SnSO4溶液作为混合阳离子溶液制成前躯体Cu-Sn-S化合物(CuxS+SnxS)。将前躯体在充有N2的管状炉中,分别在400、450和500℃温度下硫化1 h,获得了纳米晶Cu2SnS3、Cu5Sn2S7和Cu3SnS4薄膜。3个样品中,Cu3SnS4具有最高的载流子浓度、最低的电阻率和较高的光吸收系数,其带隙值为1.47 eV。
Robles等〔7〕采用共蒸发法制备Cu3SnS4薄膜,研究了Cu和Sn的不同蒸发速率、衬底温度和退火过程对薄膜的影响。研究发现,在150~450℃的衬底温度和10~16 nm∕min的Cu蒸发速率下制备出纯的Cu3SnS4薄膜。当衬底温度升高到450℃时,制成的薄膜为正交相Cu3SnS4与CuS共存,用KCN溶液处理去除过量的CuS后,得到了斜方相的Cu3SnS4薄膜,其带隙为1.4 eV,电阻率为7.9×10-4Ω·cm。Fernandes等〔6〕和Guan等〔21〕分别运用直流磁控溅射法和连续离子层吸附反应法制备出了Cu2SnS3和Cu3SnS4纳米粉体。两项工作重点分析了不同的硫化温度下纳米粉体的电化学性能。结果显示,所制备的四方相Cu2SnS3的带隙为1.35 eV,立方相Cu2SnS3的带隙为0.96 eV,斜方相Cu3SnS4的带隙为1.60 eV。Maheskumar等〔18〕通过球磨法和溶剂热法制备了不同形态的纳米晶Cu3SnS4粉体。由莫特-肖特基图确定的能带位置与理论数值非常接近,价带边缘为1.594~1.608 eV,导带边缘为-0.026~0.077 eV。
Maheskumar等〔13〕研究了在去离子水(最终产物标记为CTS-DI),N、N-二甲基甲酰胺(最终产物标记为CTS-DMF)和聚乙二醇(最终产物标记为CTSPEG)的影响下,通过溶剂热法制备了不同形貌的纳米晶Cu3SnS4粉体。根据电负性的概念估算了Cu3SnS4的价带和导带边缘位置。使用经验公式计算零电荷的导带(ECB)和价带(EVB)电势,结果表明溶剂的使用对产物形貌、带隙、光吸收和光电性能均具有显著影响。所使用的经验公式为〔17〕:
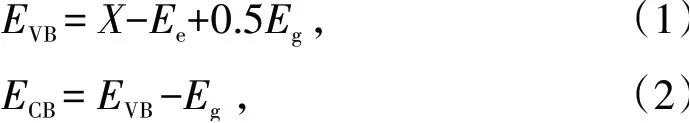
式中:X是半导体的绝对电负性,它是组成原子的绝对电负性的几何平均值;Ee为自由电子相对于正常氢标度的能量,采用值为4.5 eV;Eg为材料的光学带隙。计算结果如图3〔13〕所示,CTS-DI、CTS-DMF和CTS-PEG的带隙分别为1.33、1.65和1.19 eV。
表1列出了不同方法制备的纳米晶Cu3SnS4的晶体结构、形貌及带隙。
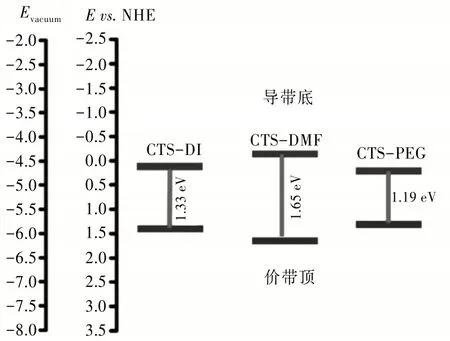
图3 溶剂热法使用不同溶剂制备的纳米晶Cu3SnS4能带结构示意图

表1 不同方法制备的纳米晶Cu3SnS4的晶体结构、形貌和带隙
2.2 通过掺杂和元素取代调整带隙 通过对Cu3SnS4进行掺杂或进行一定量的元素取代是一种调整其带隙的有效方法。Nazari等〔11〕采用溶剂热法,用Fe原子取代Sn原子,获得纳米晶Cu3FexSn1-xS4粉体。实验发现,无Fe原子加入的纯CTS(X=0.0)为四方相结构,带隙值为1.18 eV;当加入的Fe含量为20%时,仍然保持Cu3SnS4的四方相结构,带隙值变为1.26 eV;继续增加Fe的含量至40%和60%时,Cu3SnS4的四方相结构转变成了Cu2FeSnS4的四方相结构,带隙值分别为1.31 eV和1.42 eV;当Fe含量达到80%时形成四方相结构的花状Cu2FeSnS4纳米粉体,带隙值为1.62 eV。此外,也有Fe原子取代Cu原子,获得纳米晶Cu3-xFexSnS4粉体的报道,调整后的带隙值在1.54~1.76 eV〔22〕。
除了掺Fe以外,通过掺入Zn、Mn、Se、Ni和Co等也可以实现纳米晶Cu3SnS4的带隙调整。缪彦美等〔23〕采用固相反应法将Cu2S、ZnS、Sn和S按照1:1:1:2.4的摩尔比混合并在研钵中手工研磨60 min后倒入石英管中真空密封,以4.4℃∕min的升温速率分别升至400、450、500、550、600和650℃烧结30 h后自然冷却至室温,得到纳米晶Cu2ZnSnS4(CZTS)粉体。分析发现,当烧结温度为400℃和450℃时,产物含有CuS,当温度高于500℃时,产物为单一的CZTS,所得CZTS在可见光区具有较高的吸光度,带隙约为1.5 eV。
Liu等〔14〕通过掺入Mn元素合成了Cu2Cu1-xMnx-SnS4(CCMTS)纳米片。研究发现,适当的Mn掺入可以将CCMTS带隙从1.67 eV降低到1.45 eV,当Mn2+掺入浓度小于0.016 mol∕L时,样品的光吸收系数几乎保持不变,当Mn2+浓度增加到0.016 mol∕L时,样品在可见光区的吸收明显减弱。
Chen等〔24〕通过无毒旋涂技术成功制备出纳米 晶Cu2MnSnS4(CMTS)薄膜。首先将CuCl2·2H2O(7.04 mmol),SnCl2·2H2O(4.0 mmol),Mn(CH3COO)2·4H2O(4.8 mmol)和硫脲(32 mmol)加入20 mL的以少量乙酰丙酮作为添加剂的乙二醇溶液中。在50℃下用磁力搅拌器搅拌30 min,得到均匀、清晰、透明的溶液。将制备好的溶液在300℃的温度下,以3 000 r∕min旋转涂覆在钠钙玻璃上,然后移至N2气氛的退火炉中,以速率8℃∕s加热至570℃后,保持3 min再自然冷却至室温。结果表明,随着退火温度的增加,带隙逐渐减小,退火时间延长至13 min时观察到CMTS相的分解,表明退火时间对于二次相的抑制和制备高质量的CMTS薄膜至关重要。
Al-Zahrani〔25〕采用喷雾热解技术,将0.1 mol∕L的氯化铜,0.05 mol∕L的氯化钴,0.05 mol∕L的SnCl4和0.2 mol∕L的硫脲加入蒸馏水溶剂中,在50℃下磁搅拌1 h,得到均匀的棕色溶液。将该溶液放置在衬底温度为300℃,气压为3.039×105Pa的环境中,制备出厚度分别为160、230、297和345 nm的Cu2CoSnS4薄膜。分析发现,制备出的薄膜表面平滑,多晶颗粒均匀,带隙值随着薄膜厚度的增加从1.41 eV降低到1.12 eV。
Wang等〔26〕先将1 mmol的CuSO4·5H2O,0.5 mmol的NiCl2·6H2O,0.5 mmol的SnCl2·2H2O,3 mmol的硫脲和1.5 g的PVP溶解于55 mL的乙醇中并搅拌3 h后,将溶液转移到高压釜中真空密封,并移至烤箱中在230℃下保持24 h。然后,将高压釜自然冷却至室温,用异丙醇和去离子水洗涤数次,通过10 000 r∕min离心5 min分离出纳米颗粒,将最终产物在50℃真空干燥12 h,制备出立方相结构的花状纳米晶Cu2NiSnS4粉体。分析发现,该粉体由花状纳米颗粒组成,这种花状的纳米颗粒由平均厚度约400 nm的纳米薄片聚集而成,带隙值为1.41 eV。
表2列出了部分通过掺杂和元素取代调整纳米晶Cu3SnS4带隙的结果。
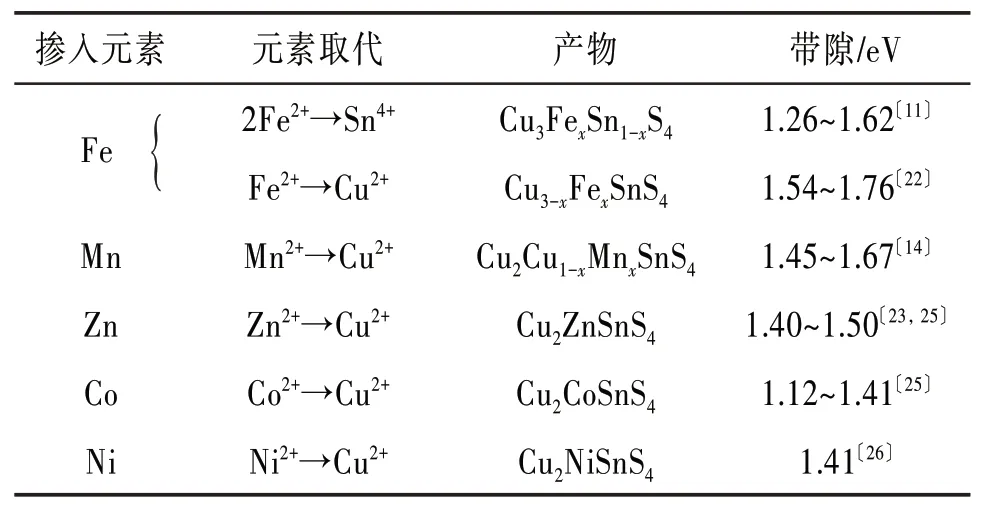
表2 纳米晶Cu3SnS4经掺杂和元素取代后的带隙
3 结语与展望
本文从制备和带隙调整两方面对纳米晶Cu3SnS4的研究进行了综述,介绍了磁控溅射、溶剂热法、球磨法和喷雾热解法等〔27〕制备纳米晶Cu3SnS4粉体和薄膜的方法,以及通过改变Cu3SnS4的晶体结构和形貌或者掺入其他元素进行带隙调整的研究结果。纳米晶Cu3SnS4主要有立方相、四方相和斜方相3种晶体结构,其晶体结构随制备工艺和条件参数的改变而变化。Fe、Mn、Co、Ni、Zn等元素的加入不仅可以改变纳米晶Cu3SnS4的形貌,而且可以对纳米晶Cu3SnS4的带隙和光吸收效率进行调整。
随着“光伏平价时代”的到来,纳米晶Cu3SnS4凭借其较高的光吸收系数、丰富的自然资源、优良的电学性能和催化性能,成为在太阳能电池、气敏元件、光电催化、热电转换等领域具有潜在应用的材料之一。开发工艺简单、成本低、重复性好的制备工艺仍然具备一定的挑战性,这也是将来纳米晶Cu3SnS4研究的重点和热点之一。
