奥希替尼对大鼠脊髓损伤后血脊髓屏障通透性的影响
2021-06-27李在望曹婷婷涂景梅
李在望 曹婷婷 王 倩 涂景梅 韩 晶
1.暨南大学第二临床医学院 南方科技大学第一附属医院 深圳市人民医院神经内科,广东深圳 518020;2.江苏省盐城市第一人民医院神经内科,江苏盐城 224001
脊髓损伤(spinal cord injury,SCI)是一种严重的致残性疾病,不仅给患者带来巨大的身心损害,而且给家庭和社会带来沉重的负担[1]。SCI 后的神经功能缺损是由初始的机械暴力所致的组织损伤和继发性损伤共同造成的[2]。而SCI 后继发性损伤与血脊髓屏障的破坏密切相关[3]。血脊髓屏障(blood spinal cord barrier,BSCB)为血液与脊髓之间介导氧气、营养物质及代谢产物交换的屏障结构,与血脑屏障类似,对于维持内环境相对稳定具有重要意义[4]。近年来研究发现表皮生长因子受体(epidermal growth factor receptor,EGFR)信号通路参与细胞屏障功能的调节,而微血管损伤与EGFR 过度活化密切相关[5]。目前有多个研究证实EGFR 抑制剂对中枢神经损伤有保护作用[6-8],然而相关机制尚未明确。奥希替尼是第3 代EGFR 抑制剂,具有良好的血脑屏障渗透性能有效的作用于中枢神经系统[9],为此,本研究应用奥希替尼干预SCI 大鼠,观察其对SCI 后BSCB 通透性和经神功能缺损的影响,以探讨EGFR 抑制剂对SCI 的保护作用机制。
1 材料与方法
1.1 实验动物
健康8 周龄雌性SD 大鼠60 只,SPF 级,体重200~250 g,购自常州卡文斯实验动物有限公司,实验动物生产许可证号SCXK(苏)2016-0010,实验动物合格证号:201822084。动物饲养于动物实验研究中心。SPF 饲养环境:室温22℃,相对湿度65%,昼夜交替时间12 h,自由摄食和饮水。实验动物的饲养、造模、给药、取材方案均取得暨南大学试验动物管理中心伦理委员会批准。
1.2 主要试剂与材料
奥希替尼(MedChemExpress 公司,货号:HY-15772S);伊文思蓝(EB)染料(solarbi 公司,G5570);BCA 蛋白定量试剂盒(北京康为世纪公司生物科技有限公司,货号:CW0014);鼠抗Albumin(Abcam,货号:ab10241);兔抗水通道蛋白-4(AQP-4)(Abcam,货号:ab46182);鼠抗β-actin(Abcam,货号ab8226);驴抗鼠荧光二抗Alexa Flour 488(Thermo Fisher Scientific,货号:A-21202);Hoechest 33342(Thermo Fisher Scientific,货号:62249)。
1.3 大鼠SCI 模型的制备及分组
60 只8 周龄雌性SD 大鼠(200~250 g)按照随机数字表法分为假手术组(n=20)和SCI 模型组(n=40)。术前禁食12 h,采用1%戊巴比妥钠40 mg/kg 腹腔注射进行麻醉。备皮、消毒、铺单,选取T9~11段,背部正中切口切开皮肤,分离各层皮下组织,咬除T9~11棘突及椎板,暴露T10段脊髓。假手术组大鼠不进行打击损伤,止血后,依次缝合竖脊肌、皮下组织及皮肤,碘伏清理局部皮肤,外用红霉素预防感染。SCI 模型组大鼠以暴露的T10段脊髓为打击点,应用10 g 打击棒自由落下(高度为1.25 cm)进行打击。打击后立刻移开打击棒,观察到大鼠双下肢痉挛抖动、脊髓表面充血水肿(此为造模成功的特征)[10-11],各组行肌肉和皮肤缝合。消毒、复温,将大鼠放回笼中,按摩膀胱挤尿3 次/d。采用随机数字表法将40 只SCI 模型大鼠分为损伤组和奥希替尼组,每组20 只。奥希替尼组给予浓度为0.4 mg/mL 奥希替尼溶液灌胃(2 mL/d),假手术组和损伤组给予生理盐水灌胃(2 mL/d),三组均干预3 d。
1.4 脊髓组织含水量测定
大鼠SCI 后3 d 取各组大鼠(每组3 只)T10节段脊髓(以损伤灶为中心长1 cm)组织,称湿重,放入60℃恒温干燥箱24 h,称干重,脊髓含水量=(湿重-干重)/湿重×100%。
1.5 Western blot 法检测AQP-4 表达
各组大鼠(每组5 只)于伤后3 d 时快速剥取损伤节段脊髓组织,加人裂解液冰上孵育并彻底匀浆,离心后留取上清,BCA 法测定蛋白浓度。聚丙烯酰胺凝胶电泳分离蛋白;全湿式电转法转移到PVDF 膜上;5%封闭液(1 g 奶粉+20 mL TBST)封闭2 h,分别加入一抗(兔抗AQP-4,1∶1000 稀释);内参为β-actin(1∶500 稀 释),4℃孵 育过夜。用TBST 溶液洗涤10 min×3 次;加入二抗(HRP 标记羊抗鼠IgG,1∶1000稀释),4℃过夜;TBST 洗膜10 min×3 次,加ECL 发光显示液在暗室中摄像,凝胶成像分析系统进行分析。
1.6 EB 染料渗漏实验
大鼠SCI 后3 d 将各组大鼠(每组3 只)腹腔注射2%EB 染料(溶于0.9%生理盐水)6 h 后,采用1%戊巴比妥钠40 mg/kg 腹腔注射进行深度麻醉。大鼠仰卧位固定于泡沫板上,打开胸腹腔,生理盐水心脏灌流,并采用4℃4%多聚甲醛(PFA)溶液300 mL 灌流固定脊髓组织,先快后慢,可见肢体僵硬,表示灌流成功[12]。然后取出脊髓组织,将脊髓组织依次放入4%PFA、20%、30%蔗糖溶液24 h 脱水,冰冻切片机切片,片厚20 μm,载玻片贴片,盖玻片覆盖,通过荧光显微镜进行观察。
1.7 免疫荧光检测脊髓Albumin 含量
大鼠SCI 后3 d 将各组大鼠(每组5 只)麻醉、心脏灌流,冰冻切片机切片,片厚6 μm,载玻片贴片,放入切片盒中,放入-20℃冰箱储存。取出载玻片,PBS清洗3 min×3 次,0.5%TritonX-100 破膜15 min,PBS清洗3 min×3 次,驴血清封闭1 h,加入鼠抗Albumin一抗,PBS 代替一抗作阴性对照,放入湿盒,4℃过夜。PBS 清洗10 min×3 次,加入驴抗鼠荧光二抗Alexa Flour 488(驴血清1∶200 稀释)1 h,避光,PBS 清洗10 min×3 次,采用Hoechest 33342 染核,冲洗、封片,荧光显微镜观察。
1.8 动物行为学评分
在SCI 后第1 天和以后每周观察各组剩余大鼠行为学的改变。共观察8 周。应用BBB 评分评定大鼠脊髓神经功能,最小值为0 分,表示未见后肢运动;最大值为21 分,表示功能完全正常[13-14]。
1.9 统计学方法
采用SPSS 22.0 统计软件处理数据,计量资料用均数±标准差()表示,组间比较采用t 检验;重复测量采用重复测量方差分析。以P <0.05 为差异有统计学意义。
2 结果
2.1 脊髓含水量测定及AQP-4 表达
SCI 后3 d 损伤组脊髓含水量明显高于假手术组(P <0.01),奥希替尼组含水量明显低于损伤组(P <0.05)(图1A)。损伤组AQP-4 蛋白表达量明显高于假手术组(P <0.01),奥希替尼组AQP-4 蛋白表达量明显低于损伤组(P <0.01)(图1B~C)。

图1 EGFR 抑制剂奥希替尼对SCI 后脊髓组织水肿及AQP-4 蛋白表达量的影响
2.2 EB 染料渗漏实验及荧光检测实验
SCI 后3 d 脊髓组织假手术组无EB 染料聚集,损伤组EB 染料大量聚集于损伤处,奥希替尼组EB 染料聚集程度较损伤组轻(图2A,见封三)。EB 染料在荧光显微镜绿色激发光下呈红色,假手术组无明显红色荧光,损伤组可见大量荧光,奥希替尼组次之(图2B见封三)。损伤组荧光强度明显高于假手术组,差异有高度统计学意义(P <0.01),奥希替尼组荧光强度明显低于损伤组,差异有统计学意义(P <0.05)(图2C,见封三)。
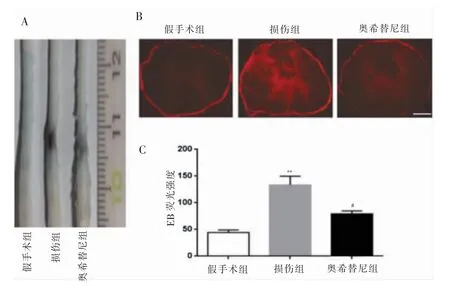
图2 EGFR 抑制剂奥希替尼对SCI 后EB 染料渗入脊髓组织的影响
2.3 免疫荧光测定白蛋白含量
SCI 后3 d 大鼠脊髓组织冰冻切片白蛋白免疫荧光染色,损伤组脊髓组织上白蛋白荧光强度较假手术组增强,而奥希替尼组荧光强度较损伤组减弱(图3,见封三)。

图3 EGFR 抑制剂奥希替尼对SCI 后白蛋白渗人脊髓组织的影响
2.4 大鼠运动功能评分
SCI 前各组大鼠运动功能评分完全正常,SCI 后1 d,假手术组评分完全正常,奥希替尼组与损伤组BBB 评分均为0 分,两组大鼠损伤程度一致。重复测量方差分析显示,损伤组总体BBB 评分明显低于假手术组(F组间=16894.283,P组间<0.001;F组间=413.918,P时间<0.001;F交互=68.511,P交互<0.001),提示造模成功。SCI 后7 d,奥希替尼组与损伤组运动功能BBB评分均开始逐渐上升,而奥希替尼组BBB 评分上升趋势更加明显,重复测量方差分析显示:奥西替尼组与损伤组组间比较、时间点比较及交互作用等方面的差异均有统计学意义(F组间=11.798,P组间=0.014;F时间=86.504,P组间<0.001;F交互=0.967,P交互=0.473)。见图4。

图4 SCI 后各组大鼠运动功能评分
3 讨论
SCI 后的神经功能缺损由原发性损伤和继发性损伤两种机制所致,而脊髓继发性损伤与血脊髓屏障的破坏密切相关[3]。近年来研究发现EGFR 活化与细胞屏障功能的调节密切相关[5,15]。已有研究证实,EGFR过度活化可导致血脊髓屏障通透性明显增加,这是引发继发性损伤的重要原因[16-17]。而EGFR 抑制剂奥希替尼是第三代EGFR 酪氨酸激酶抑制剂,能有效抑制EGFR 的过度活化,而且该药能有效通过血脑屏障而作用于中枢神经系统[18-19],因此,本研究中应用奥希替尼抑制BSCB 细胞EGFR 过度活化,以观察其是否能减轻BSCB 的破坏并改善SCI 大鼠的神经功能缺损。
脊髓含水量的测定可间接反映BSCB 破坏的程度[20]。研究证实,当BSCB 损伤时AQP-4 蛋白表达量会明显增高,因此通过检测AQP-4 蛋白的表达情况也可检测BSCB 的损伤情况[21-22]。在SCI 后检测EB 和白蛋白的含量可以准确判断BSCB 通透性改变的程度[4]。该研究联合应用脊髓含水量测定、AQP-4 蛋白表达量检测、EB 染料渗漏及脊髓中白蛋白含量测定等方法细致评估了奥希替尼对SCI 后BSCB 通透性的影响。本研究结果显示,损伤组脊髓含水量、AQP-4蛋白表达量、EB 及白蛋白含量均明显高于奥希替尼组,这提示奥希替尼可减轻SCI 后BSCB 的破坏。
同时,本研究还证实奥希替尼能有效促进SCI 后大鼠运动功能的恢复。这与以前的EGFR 抑制剂干预SCI 的研究结果是一致的[7-8,23-25]。然而,EGFR 促进SCI 恢复的机制一直尚未明确。本研究提示奥希替尼的治疗作用与其能减轻BSCB 的破坏密切相关,因为BSCB 的破坏在SCI 后继发性损伤中起着关键性作用[3]。而BSCB 组成细胞EGFR 过度活化可导致血脊髓屏障通透性明显增加[15,20],故推测奥希替尼是通过有效抑制BSCB 组成细胞EGFR 的过度活化而减轻了BSCB 的通透性,进而改善了由此导致的继发性损伤。
综上所述,EGFR 抑制剂奥希替尼可有效抑制大鼠SCI 后BSCB 的破坏并促进大鼠神经功能的恢复。该研究结果为临床应用EGFR 抑制剂治疗SCI 提供了新的方法和思路。
