水合物法模拟海底封存CO2气体的实验
2021-06-26姚远欣周雪冰李栋梁梁德青
姚远欣,周雪冰,李栋梁,梁德青
(1中国科学院广州能源研究所,广东广州510640;2中国科学院天然气水合物重点实验室,广东广州510640;3广东省新能源和可再生能源研究开发与应用重点实验室,广东广州510640;4中国科学院广州天然气水合物中心,广东广州510640;5天然气水合物国家重点实验室,北京100028;6中国科学院大学,北京100049)
工业革命以来,人类对化石能源的广泛利用排放了大量的CO2,这是造成当今全球气候变暖的主要原因,气候变暖会导致一系列的环境问题和社会问题,甚至影响人类的生存发展。为了实现可持续发展,除了要严控温室气体排放外,发展碳捕集与封存技术(CCS)[1]同样是抑制全球气候变暖的重要途径,通过CCS技术从火电厂等大型排放源捕集CO2,再运输到指定位置(地底、海底)永久封存CO2,可以减少CO2的排放量,有望在未来极大地改善气候问题。水合物法海底封存技术[2]是一种重要的CCS技术,可以将CO2通入有合适热力学条件和孔隙条件的海底地层或枯竭废弃的海洋油气井中,在地层中形成稳定的CO2水合物,从而实现CO2的长久封存。国内外通常使用在高压低温下湿润的多孔介质来模拟海底地层,再向其通入CO2来进行封存实验的研究。Zhang等[3]研究发现,在13.8~26.7nm的孔径范围内,多孔介质孔径越小,水合物诱导时间越长,平均形成速率越大,储气能力越强。Oya等[4]发现CO2饱和溶液在地下孔隙中形成的水合物晶体大小为100μm左右,水合物晶体占据孔隙空间,使水合物形成层的孔隙率和渗透率降低。Hassanpouryouzband等[5-6]的研究发现,N2和CO2按一定比例注入地层可以促进CO2的封存,实验最多封存了92%的CO2气体,研究还发现使多孔介质温度升高会使水合物先释放N2,而CO2却保留在了水合物中,这为CO2的长久封存提供了保障。Almenningen等[7]研究了岩心尺度上二氧化碳-水的渗流过程和水合物形成过程,证实了水合物仅在孔隙的水相中成核,发现孔隙充填型水合物的生长模式有效地降低了砂岩的渗透率。Liu等[8]发现当CO2水合物形成后再次向地层注水,水合物将进一步形成,促进了CO2的封存。陈强等[9]发现水合物生成过程会使多孔介质的阻抗增大,还利用水合物的阻抗值计算多孔介质中水合物的饱和度,得到了多孔介质中水合物饱和度随时间的增长曲线。Song等[10]发现提高CO2流动压力和降低CO2流速有利于CO2水合物的形成。Zhang等[11]发现CO2-CH4置换开采法配合热增产方法可以有效提高CO2的地质封存效率。在实际的工程封存过程中,待封存CO2的压力高、投放量大,可能会对封存区域内的水、砂和泥土等介质的运移产生一定的影响,进而影响封存量和封存效果,而封存过程中CO2不同的进气方向会改变这些介质的运移路径和区域排布,进而影响封存区域内重力、温度和压力条件,最终影响封存区域内的封存量和封存效果。但是现有研究中对CO2进气方向和选择控制适宜封存地层的研究较少,为了探究这一问题,本实验利用自主研发的反应釜研究了不同进气方向下CO2的封存效果,并研究了不同初始水饱和度和不同盐度对封存效果的影响,为工程实际操作时选择和控制封存地层条件,以及控制合理的封存进气方向提供了依据。
1 材料和方法
1.1 材料与设备
实验系统与装置如图1所示。反应釜内径56mm、高425mm,设计压力为15MPa,釜体中央沿轴向平均分布了5个监测点,每个检测点均安装了测量压力、温度和电阻率的测量装置,如图1(b)、5个位点沿釜体自下而上分别定义为1号、2号、3号、4号、5号位,5号位靠近进气口一端,缓冲罐容积982mL。为了模拟地层环境,使用恒压柱塞泵为釜内湿砂提供10MPa的轴压,转动轴承带动反应釜和进气口同时转动可以实现不同方向的进气,电阻测试装置量程为0~220kΩ,温度传感器采用精度±0.1℃的Pt100型铂电阻温度传感器,压力传感器量程0~15MPa,精度为0.1%F·S,恒温槽调节范围为-30~85℃,数据使用Aigent34970采集仪采集,每30s采集一次。
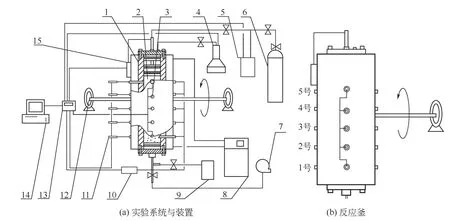
图1 实验系统与装置示意图
实验气体采用了广州粤佳气体公司的纯度为99.9%的CO2气体,蒸馏水自制,封存地层介质为孔隙度40.35%,粒径为0.30~0.45mm的天然砂。图2为天然砂在不同比例下的扫描电镜(SEM)图,可以看出,在砂的表面存在许多的孔隙和纹理,为水合物的生成提供了良好的反应位点。

图2 天然砂的SEM图
1.2 实验方法
实验前先将洗净的天然砂放在干燥箱中70℃烘干12h至完全干燥,之后将1590g的干燥天然砂与蒸馏水或NaCl溶液均匀混合,制成不同初始水饱和度的湿砂,在反应釜中放入湿砂并压实。安装好设备并检漏,打开恒压柱塞泵对湿砂施加10MPa的轴压,之后使用真空泵对釜内进行三次抽真空并用CO2气体驱替釜内气体,随后转动轴承使进气口处于不同的进气方向,设定恒温槽温度为5℃,静置12h。向缓冲罐中通入4.2MPa的CO2气体,待温度和气压稳定后,打开缓冲罐阀门向反应釜缓慢通入CO2,当反应釜气压达到1.8MPa时关闭阀门,静置5min直到温度平衡,使釜内CO2基本达到溶解平衡,随后第二次进气,打开缓冲罐阀门缓慢通入剩余CO2直至缓冲罐与反应釜内气压平衡,此时气压在3MPa左右,观察压力曲线,24h后在气压稳定至基本不再下降时停止实验。表1列出了18组的实验条件(下文中的组均用Case1、Case2等表示)为了避免水合物记忆效应[12]造成的实验误差,每次实验都需要重新填装样品。

表1 实验条件(温度5℃、压力3MPa)
第二次进气后CO2在水中先溶解,之后CO2水合物在孔隙内开始成核生成,釜内气压不断下降,待釜内压力稳定而不再被消耗时的压力为p1,此时视作在这一实验条件下水合物不再生成,达到其在这一状态下的封存能力。所以,在一次实验中参与生成CO2水合物的CO2气体物质的量nh(mol)的计算如式(1)。
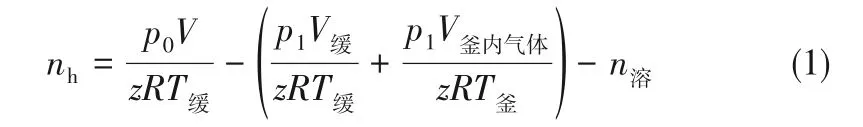
式中,p0为未进气时的缓冲罐内气压,MPa;T釜为反应釜内温度,K;V缓为缓冲罐内体积;T缓为缓冲罐内温度,K;V釜内气体为反应釜内的气体体积,mL;n溶为反应结束后剩余水对CO2溶解的物质的量,mol;z为CO2压缩因子,由改进的Peng-Robinson状态方程[13]计算得到;R是气体常数;V釜内气体为釜内气体的体积,计算见式(2)。

式中,1046.8为反应釜的内体积,mL;0.435为天然砂的孔隙率;Vh是水合物体积,mL;水合物的体积膨胀系数为1.1[14];Vw为溶解了CO2的剩余水的体积,mL;在水合物存在的体系条件下,2MPa、278.15K下的蒸馏水中最多可溶解CO2的摩尔分数为0.019[15],3.5%NaCl溶液的溶解物质的量分数为0.017[16],假设未生成水合物的水都溶解了CO2,所以实验中水合物的CO2封存量和CO2溶解量的关系见式(3)。
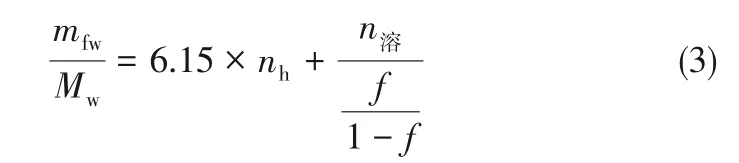
式中,mfw为初始水的质量,g;Mw为水的摩尔质量,g/mol;f为CO2溶解于水中的物质的量分数;CO2水合物在3MPa、5℃下水合数[17]为6.15,通过式(1)~式(3)可计算出nh。
水生成水合物的转化率C的计算见式(4)。当水转化为CO2水合物时,体积膨胀1.1倍,Sw为初始水饱和度,Sw=10%、40%、70%。所以沉积物的水合物饱和度计算式为式(5)。
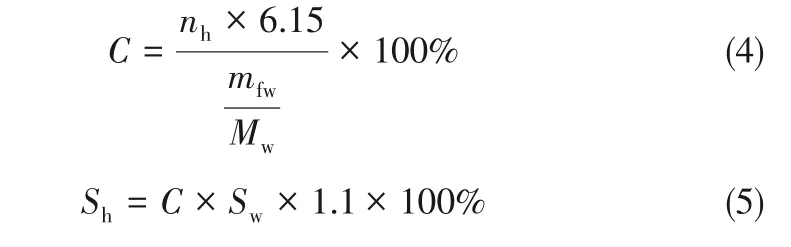
2 结果与讨论
2.1 水合物耗气量
图3是封存过程中釜内压力随时间变化的曲线,除Case18外,其余每组实验中5个位点的压力变化曲线均相同,因此统一使用4号位点的压力变化代表釜内的压力变化,通过测量釜内的压降,计算了CO2的水合物封存量(固态封存)和溶解封存量(液态封存),如图4所示。从图4可以看出,3种进气方向在耗气量上的区别,横置进气的耗气量略大于顶部进气,而底部进气的耗气量最少,这一趋势在水饱和度70%和40%的情况下较为明显。底部进气耗气量少这一现象与直观印象相反。对于这一现象,本文根据对水合物在沉积物孔隙中赋存状态(悬浮型、接触型、胶结型)[18]的研究做出一个合理的猜想,静置时部分孔隙中的水由于重力逐渐渗流至湿砂底部,所以在底部进气时,初期CO2与底部饱和度较高的水在进气口附近快速生成大量的致密水合物,底部湿砂中的一部分水或CO2被砂和已生成的水合物阻隔,无法生成水合物,如图5(a)、图5(b),快速生成的水合物堵塞了砂的孔隙,阻挡了CO2与水的反应,反应釜中可能存在众多这样的“包裹体”,这使得底部进气的耗气量最少。如图3(c)~(f)的较高水饱和度的实验组中,压力下降曲线并不“光滑”,即压力下降速率不像图3(a)、(b)中的一样均匀变小,这一现象也可能是因为在进气后湿砂中存在这样的“包裹体”,“包裹体”的生成和破裂致使压力下降速率并不稳定。图3(f)中,Case18曲线是Case18实验中4号位点的压力曲线,1575min的时刻出现了非常明显的气压下降,而其他位点未出现这一压力突降现象,根据这一现象可以推断,在4号位压力检测口处可能恰好形成了若干“包裹体”,这些“包裹体”外致密的水合物封闭了4号位点周围的部分气体和水,在1575min时由于水合物的生长膨胀导致“包裹体”破裂,“包裹体”内的水迅速形成水合物消耗了CO2,使气压下降,这一猜想需要实验和检测的进一步验证。在顶部进气和横置进气时,进气口始终面对含水较少、孔隙较大的湿砂,即使在进气口附近,CO2与少量因毛细作用[19]附着在砂上的水分快速生成水合物后仍然能保持很好的气液流动通道[20]。如图5(b),底部部分高含水率的区域在初期没有发生大量生成水合物而阻碍反应进一步进行的现象,因此顶部进气和横置进气的耗气量较大,因为横置进气时的反应釜釜体水平放置,静置后釜内的水更加均匀地沿釜体轴向分布,气液接触面积更大,所以最终的耗气量更大。因为10%水饱和度实验的含水量少,多数的水都以毛细作用附着在砂的表面,孔隙率非常大,底部水量较少,所以不同进气方向实验的耗气量区别不大。
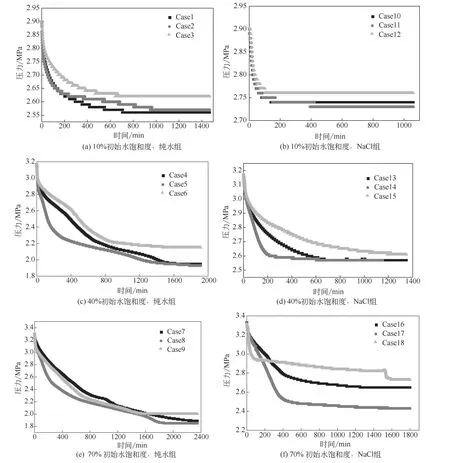
图3 不同封存过程中压力随时间变化曲线
图3可以看出相同水饱和度下纯水湿砂与3.5%NaCl溶液湿砂实验的耗气量对比,可以看出NaCl溶液湿砂的耗气量仅能达到纯水湿砂的40%~70%,这是因为NaCl是一种水合物热力学抑制剂[21],水中盐离子的电场作用破坏了水分子通过氢键形成的类四面体团簇结构[22],使水分子在形成水合物笼时需要更多能量重组氢键结构,所以在相同的温度、压力条件下更难生成水合物,导致在湿砂中生成的CO2水合物更少。根据式(1)~式(5)还可以计算CO2封存过程中的固态封存量与液态封存量,结果如图4。对于70%水饱和度的实验组,虽然总的封存量较大,但其中CO2溶解封存(液态封存)的比例较高,CO2在水中较为活跃,不利于长久封存,因为水合物封存(固态封存)可以减少CO2在地层中的运移,而液态封存比例较高这一现象在NaCl溶液实验组中更加明显,说明了封存区域应该选择在盐浓度低的地层,以实现更有效的封存。
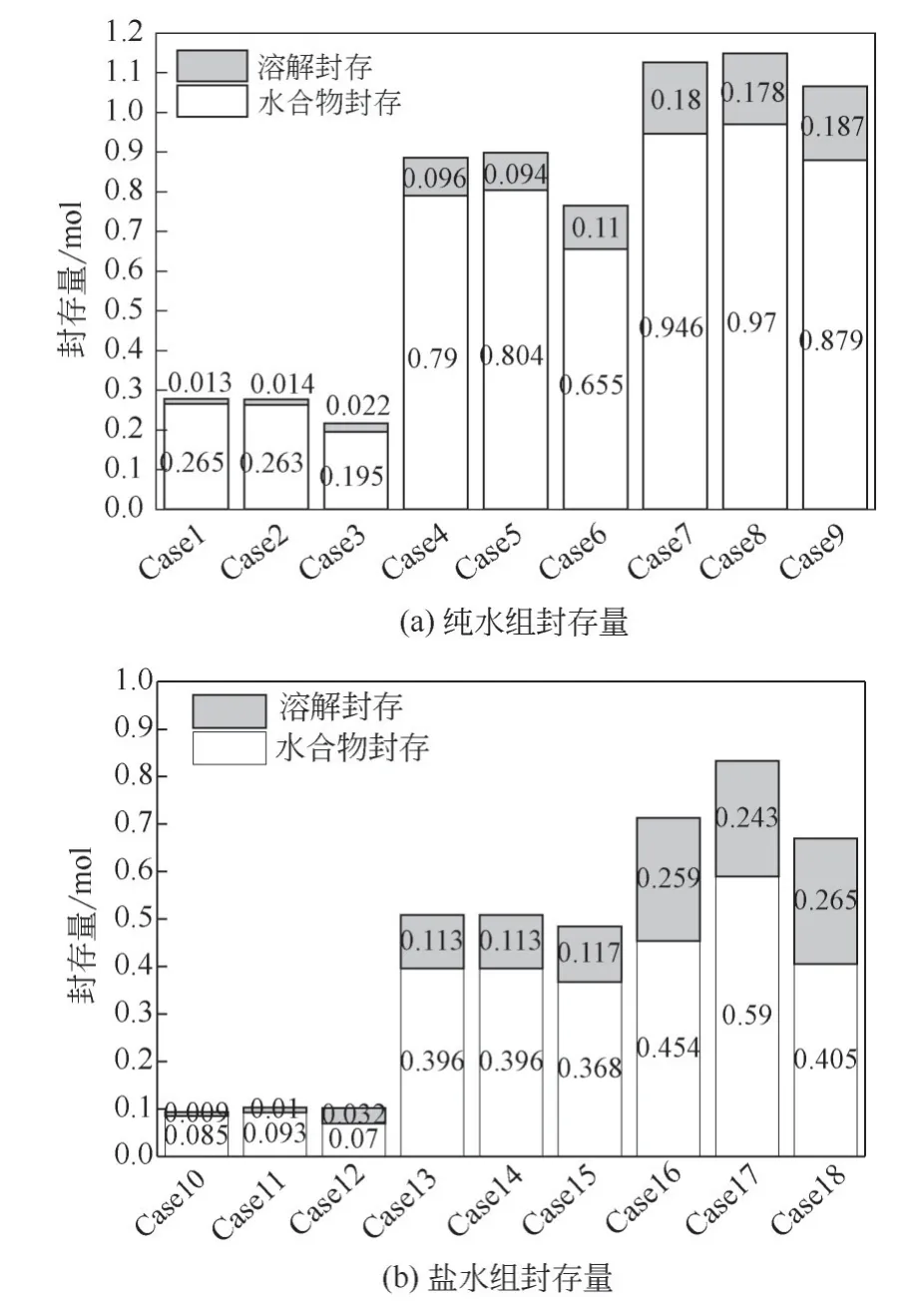
图4 不同条件下CO2封存量的比较
2.2 水合物转化率与沉积物的水合物饱和度
表2为实验完成后各实验组的水合物转化率和沉积物的水合物饱和度。10%水饱和度实验有50%~70%的水合物转化率,见图5(b),反应开始后,孔隙中与CO2直接接触的水形成了水合物,这一层水合物膜与天然砂将剩余的水夹在中间,这层膜阻碍了CO2进入剩余水,所以水合物生成速率逐渐减小,最终反应停止,所以即使水量少(10%)且水分布足够分散,封存都无法实现100%的水合物转化率[23];40%水饱和度实验有40%~60%的转化率,水合物饱和度在20%左右;70%水饱和度的转化率较低,但饱和度更高。高的水合物饱和度有利于湿砂的胶结,使地层的力学性能更稳定[24],有利于地层稳定和CO2封存,实验中含水率较高的实验更容易实现高的水合物饱和度,有利于CO2封存。
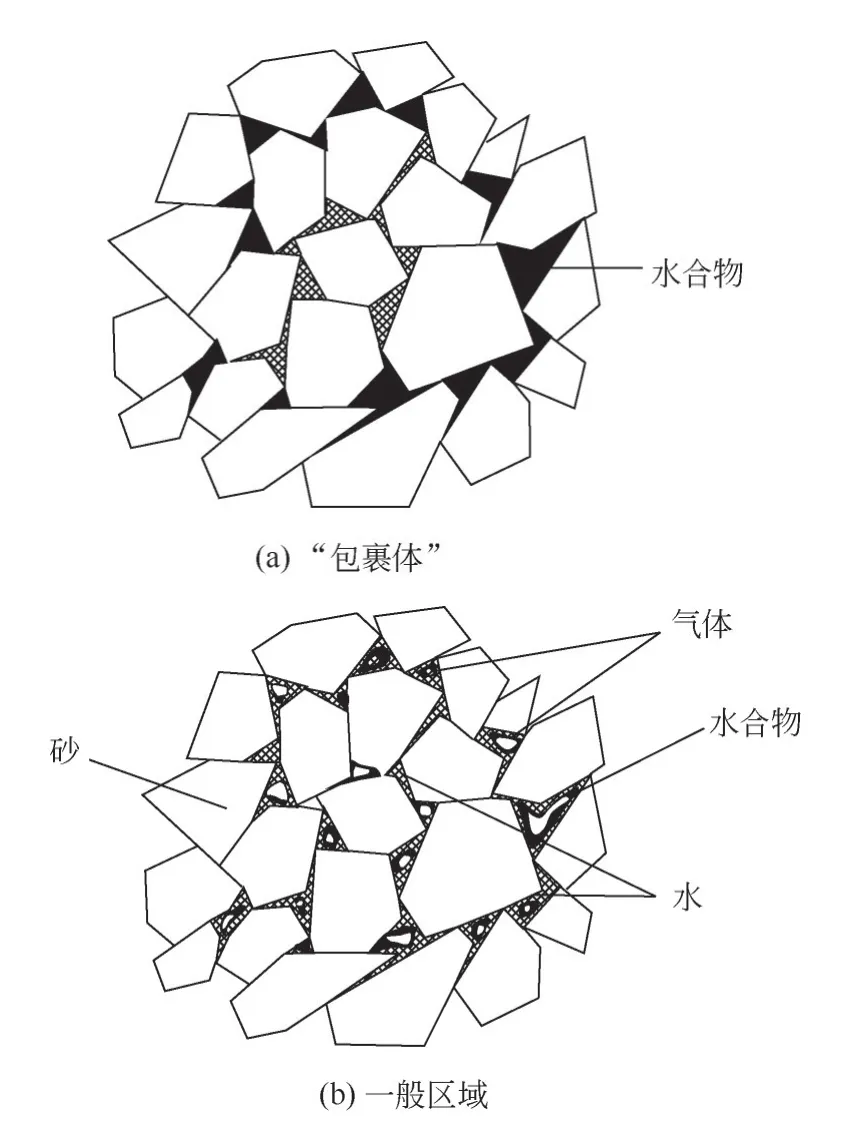
图5 CO2水合物在砂中的分布
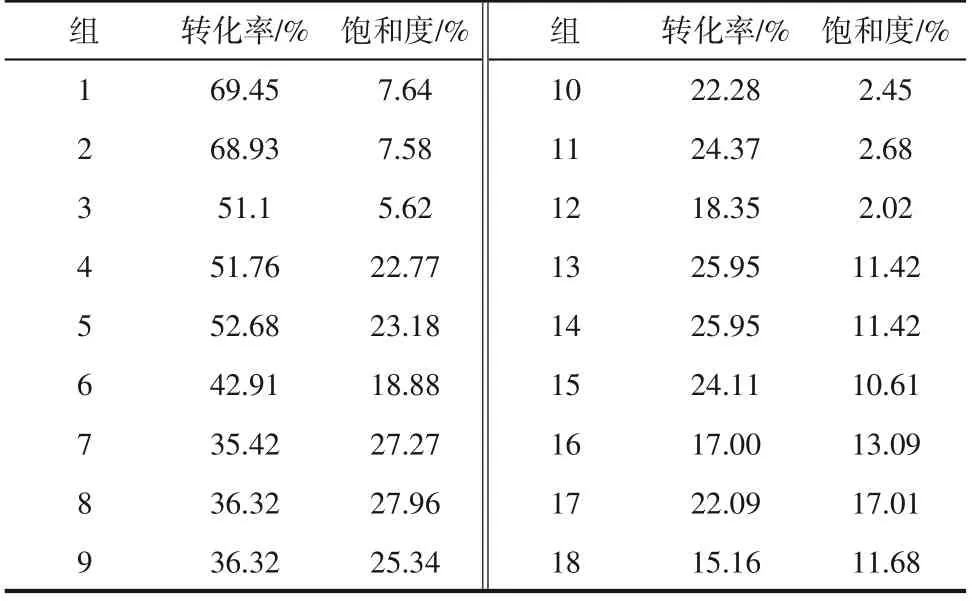
表2 水合物转化率与沉积物的水合物饱和度
2.3 封存过程的温度
选用纯水组40%初始水饱和度和NaCl组70%初始水饱和度的实验分析封存过程中的温度变化。图6显示了实验在封存开始后一段时间内釜内不同位置的温度变化,图中的1、2、3、4、5线条分别代表不同位置的1~5号监测点的温度变化,可以通过温度变化大致推断不同位置水合物的成核情况[25]。第一次升温是反应釜内气压由1.8MPa升至3MPa时CO2溶于水后放出的溶解热导致的。在5~20min内,除Case18外,其余各组各位点均发生了温度的第二次骤升,此时水合物开始成核(从温度第一次骤升到温度第二次骤升的一段时间称为生成水合物的诱导时间),在50min之后水合物生成速率减慢,水合物成核没有引起温度传感器的明显反应,釜体温度一直稳定在5℃附近。因为CO2水合物的诱导时间有随机性[26],所以各实验、各位点的诱导时间并不同。在Case16中,因为顶部进气方式使得1号、2号位因重力原因含水量较大,CO2没有与水充分混溶,温度第二次骤升后,1号、2号位在18min左右均出现了第三次温度骤升,即水合物的又一次快速生成,这说明釜内不同位置的CO2水合物的成核情况不同。Case5和Case17的温度变化趋势基本相同,各点“诱导时间”的长短顺序为1号>2号>3号>4号>5号,这可能是因为进气过程把部分水吹向了底部的1号位,而4号、5号位水量少,水与CO2充分接触,成核迅速,诱导时间短。Case6和Case18中,进气口在下,进气过程使底部5号位高含水率区域大量溶解了CO2,因此溶解放热较多,导致第一次升温幅度较大,Case18中4号、5号位的升温幅度明显高于其他位点,这可能是因为在前5min的溶解过程中高饱和度的水与大量CO2的充分接触过程已经完成了部分水合物的快速成核,这进一步解释了2.1节中的“包裹体”猜想,底部进气时底部高含水率区域气液充分混溶,部分水合物快速形成,阻碍了一些水与CO2的接触与反应。5~30min内Case18各点温度稳定保持在5℃以上,并未出现大幅的升降,这可能是因为前期完成成核诱导的部分水与水合物微粒经过气液的吹送,分布于釜内各处,加速诱导其他位置未成核的水向水合物转变[27],使釜内出现了较长时间的快速的水合物成核过程,图3(f)中Case18的压力曲线前期降压速率明显快于其他实验组的现象也证明了这一点。图6(d)~(f)中的温度波动较大,是因为Case16、Case17和Case18三个实验组的初始水饱和度较高(70%),进气和生成水合物的过程中,釜内供气体停留的体积较小,釜内气液流动更加剧烈;其次,在不同的时间段釜内气体压缩放热、介质换热、生成水合物放热现象均较为明显地出现,釜内不同位置成核诱导时间区别较大,因此温度波动较大,在40min后温度变化的总体趋势开始趋于减小。
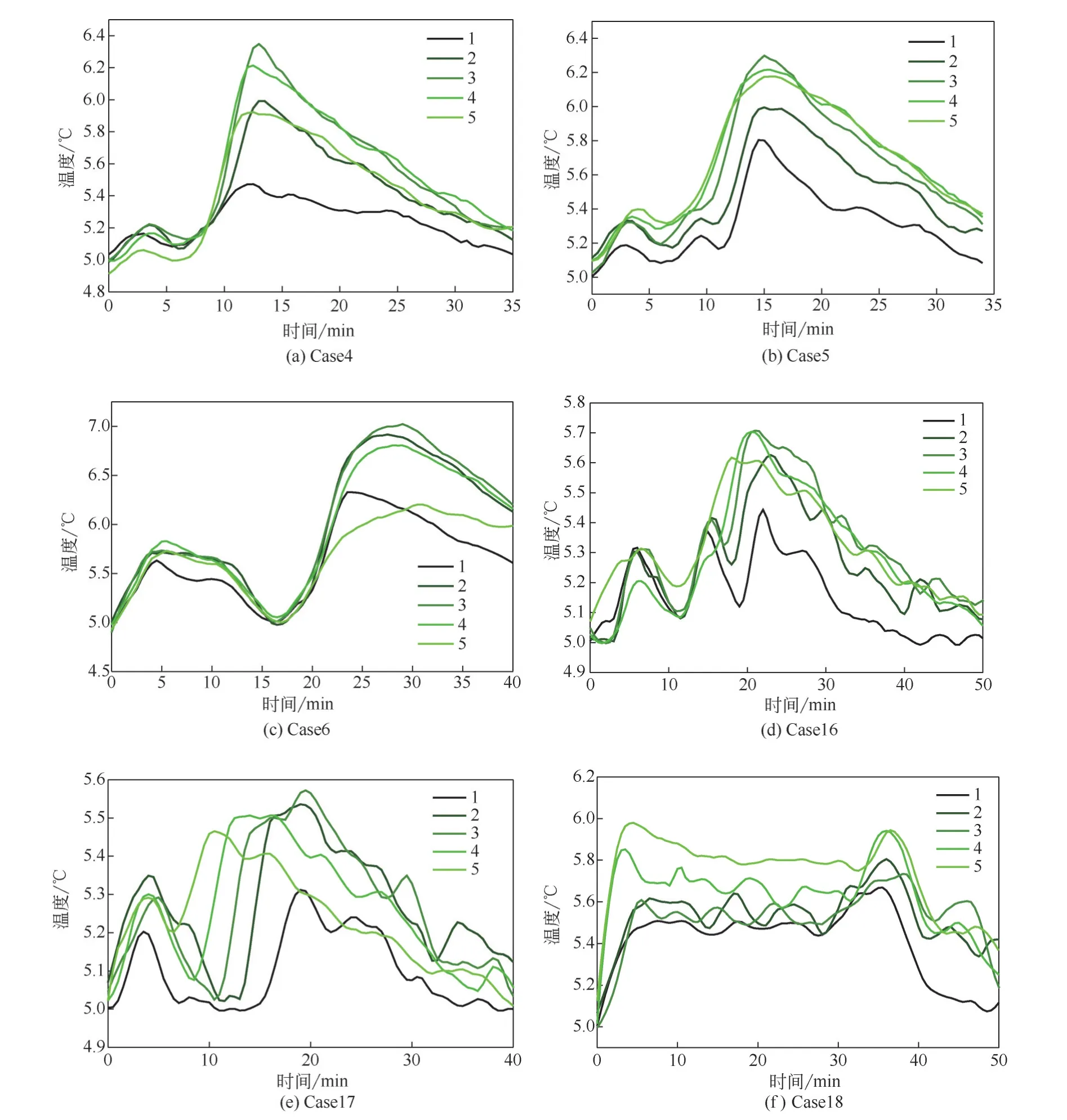
图6 水合物生成过程中温度的变化
2.4 电阻率
电阻率是探测水合物生成的重要方法之一,水合物的生成通常会使多孔介质的电阻率增加,根据测量的电阻值,可由式(6)计算出电阻率。

式中,ρ为电阻率,Ω·m;r为测量的电阻值,Ω;S为电阻丝截面面积,m2;L为两电阻丝间湿砂的长度,m。
图7表示了纯水组水饱和度为40%和70%在进气之后5个位点电阻率,图中的1、2、3、4、5线条分别代表不同位置的1~5号监测点的电阻率变化,在经过各自的诱导期后,5个位点的电阻率均以不同速度升高(本文数据受测量装置量程的限制,装置可测量的最大电阻率为40Ω·m)。实验开始后,部分电阻率出现了一定程度的下降,这是因为CO2溶解后碳酸电离出的离子降低了水的电阻率,随后水合物开始成核,初期电阻率较小,随着孔隙水被高绝缘性的水合物逐渐占据,大大减慢了水中离子的迁移效率,电阻率逐渐增大,证明了水合物的存在[28]。因为重力效应,底部水较为富集,所以Case7中1号、2号位和Case6中5号位的电阻率较低且增长速率较慢,而横置进气的Case8各点的电阻率增长较为一致。在图7中出现的电阻率的剧烈波动是因为水合物生成导致体积膨胀,部分水合物或砂被膨胀的水合物挤入或挤出电阻率的测量区域,影响电阻率的大小,但电阻率总的变化趋势是增大的,证明了水合物的生成。
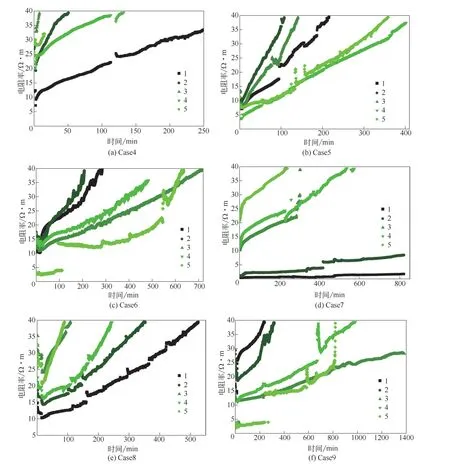
图7 电阻率变化
2.5 封存速度
CO2封存过程中的一个重要指标是该地层的CO2封存速度[29],本文使用封存过程所消耗的时间为封存速度。根据图3可知,封存过程的压力通常在前期下降较快,而后期下降非常慢,使用压力不再下降时的时间难以清楚地表示封存速度,所以使用达到该实验总压降值的80%所消耗的时间表示湿砂的封存速度。如表3所示,可以看出,在不同进气方式下,横置进气的实验组达到其基本封存能力所消耗的时间较少,速度较快,可能是因为横置进气有着更大的气液接触面积,水与CO2充分接触,反应快速所致;高初始水饱和度的实验耗时较长,封存速度较慢,因为其含水较多,同时供CO2气体停留的体积过小,气液接触面积小,封存速度较慢,40%初始水饱和度实验的封存速度几乎比70%初始水饱和度快一倍,而NaCl溶液组的封存速度明显快于纯水组,但总的封存量不如纯水组大。所以在工程操作控制封存地层条件时,在考虑其总封存量的基础上,较小的初始水饱和度能实现较快的封存速度,如果初始水饱和度过大则会导致封存速度较慢,封存成本增加。
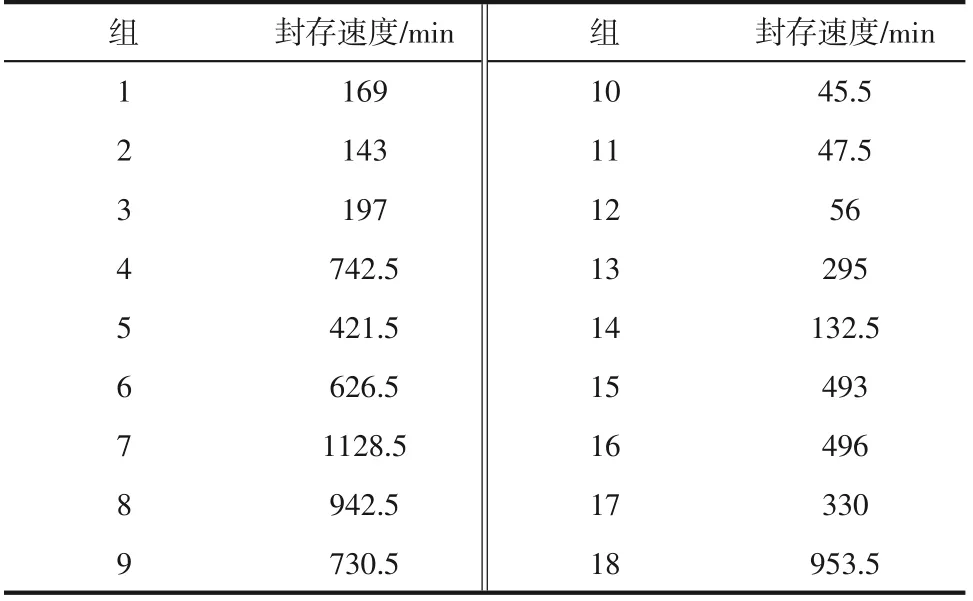
表3 CO2封存速度
3 结论
(1)横置进气的CO2封存量略大于顶部进气封存量,底部进气封存量最小。
(2)底部进气过程中,CO2在溶解的同时完成部分水合物的成核,釜体底部水合物迅速生成,反应速度快,但也可能隔绝了一些水与的CO2的接触,阻碍了反应进行。
(3)初始水饱和度越高,反应后的水合物饱和度就越高,水合物转化率越低,CO2固态封存的比例也越低,NaCl溶液的总封存量低于纯水封存,固态封存比例也低于纯水封存。
(4)横置进气方式下的封存速度较快,初始水饱和度越高,封存速度越慢,NaCl溶液的封存速度明显快于纯水封存,因此在实际工程操作时应当合理地选择和控制地层的初始水饱和度与NaCl溶液度。
