基于分子模拟的气体水合物结构特征及储气特性研究
2022-09-28向雪妮张卓雅
向雪妮,黄 亮,周 文,邹 杰,张卓雅
(1.成都理工大学能源学院,四川成都610059;2.中国石油大学(北京)重质油国家重点实验室,北京102249)
天然气水合物分布广泛,烃类资源丰富且高效清洁,其特点引起人们的广泛研究[1-4]。在水合物储层中,大量烃类气体赋存于水分子构成的笼形结构,在标准状态下,这些烃类气体体积可达到固体体积的150~170 倍[5]。目前,天然气水合物已成为常规能源重要的接替资源[6],已探明储量高达230 万亿立方米,但其中可开采储量不到三分之一[7]。为实现天然气水合物资源的高效开发,迫切需要加强相关基础理论攻关。
水合物储气技术具有贮存和释放容易,成本低和安全性高等优点[8],受到了研究者的青睐。目前,水合物已成为甲烷和氢气等载能气体运输以及储存的首选替代材料[9]。此外,利用水合物封存二氧化碳也是实现碳中和目标的研究热点之一。由于气体在水中的溶解度小,气体水合物形成难度较大且气体含量较低[10],如何提高水合物的储气密度是亟待解决的科学问题。
水合物苛刻的生成条件导致实验手段受到极大限制,分子模拟方法可以突破实验测试条件的限制,成为水合物研究的重要技术手段[11-16]。ALAVI 等[17]采用蒙特卡洛模拟研究了SII 和SH 型甲烷水合物的笼占据率和最佳储气条件。OHGAKI 等[18]研究了二氧化碳在水合物中置换甲烷的微观机理。颜克凤[19]和张庆东等[20]研究了天然气水合物中的气体吸附行为和影响因素。颜克凤、胥萍等[21,10]采用分子模拟研究了水合物的微观结构和储氢机理。尽管国内外学者针对气体水合物的结构稳定性和储气能力开展了一些研究,但几种典型天然气水合物在微观上的结构特征差异和储气特性尚待明确。为此,该文通过构建SI、SII 和SH 型气体水合物的分子模型,明确3种典型水合物的结构特征差异,通过开展客体分子的吸附模拟,阐明3种水合物的储气特性差异。
1 分子模拟细节
模拟在Materials Studio 7.0 软件中开展。Materials studio 为美国Accelrys 公司开发的新一代全尺度材料模拟平台。它不仅拥有Microsoft 标准用户界面,能够快捷实现模型搭建、参数设定以及结果的可视化分析,而且融合了多种模拟方法和功能模块,能够实现从原子结构解析到宏观性能预测的全尺度科学研究。该文选用Materials studio 7.0 软件,不仅可以实现水合物建模前的处理操作,也可以完成水合物结构表征和吸附模拟的工作,还可以开展模拟平衡后水合物中氢键、储气量和吸附热等结果的后处理分析。
水合物分子模型的构建基于Visualizer 界面开展。首先,基于水合物的空间群和晶格参数,构建水合物的晶胞结构。然后,输入水合物中氧原子坐标,并采用自动加氢构建水合物的初始晶体结构。最后,固定晶体中全部的氧原子,对氢原子进行几何优化,得到水合物的稳定结构。几何优化中选择Smart算法,共进行5 000 步优化,力场选择CVFF(一致性价力场)。优化中动态监测体系能量的变化,当能量趋于最低并保持稳定状态,表明水合物晶体结构达到平衡状态。
在水合物微观结构表征中,通过perl脚本分析水合物的所有氢键数目及长度。采用探针法分析结构中的孔隙空间。水合物孔隙的计算包括两种方式,分别基于Connolly Surface 和Solvent Surface 开展。Connolly Surface 的方式反映了水合物原始的孔隙结构,而基于Solvent Surface的方式考虑了球形探针分子尺寸的影响,对应于客体分子的可接触孔隙结构。对于孔径分布,基于水合物的骨架结构在Linux系统下利用Porosityplus程序得到孔径与孔隙直径之间的关系。
水合物对甲烷和二氧化碳的吸附行为采用巨正则蒙特卡洛方法模拟。吸附模拟之前,需要对甲烷和二氧化碳赋力场,并进行几何优化,几何优化和后续的吸附模拟均采用CVFF 力场。气体逸度由Peng Robinson状态方程获取。吸附模拟温度值低于300 K,压力介于3 ~50 MPa,水合物在此温度压力条件下处于相对稳定状态。当水合物中气体平均吸附量随模拟时间趋于平缓,表明气体吸附达到平衡。
2 气体水合物分子模型
表1 为3 种典型水合物晶胞结构[22],3 种水合物的氧原子坐标见表2。构建并优化后的水合物分子模型见图1。3种典型水合物中,SI型和SII型水合物的晶胞均为立方形晶体,而SH 型水合物的晶胞为六方形晶体。SII型水合物单胞中水分子数最多,而SH型水合物单胞中水分子数最少。3 种典型水合物单胞晶体中均含有小胞腔和大胞腔,SH 型水合物单胞晶体中还含有中胞腔。

表1 3种典型水合物晶胞结构Table 1 Cell structures of three typical hydrates
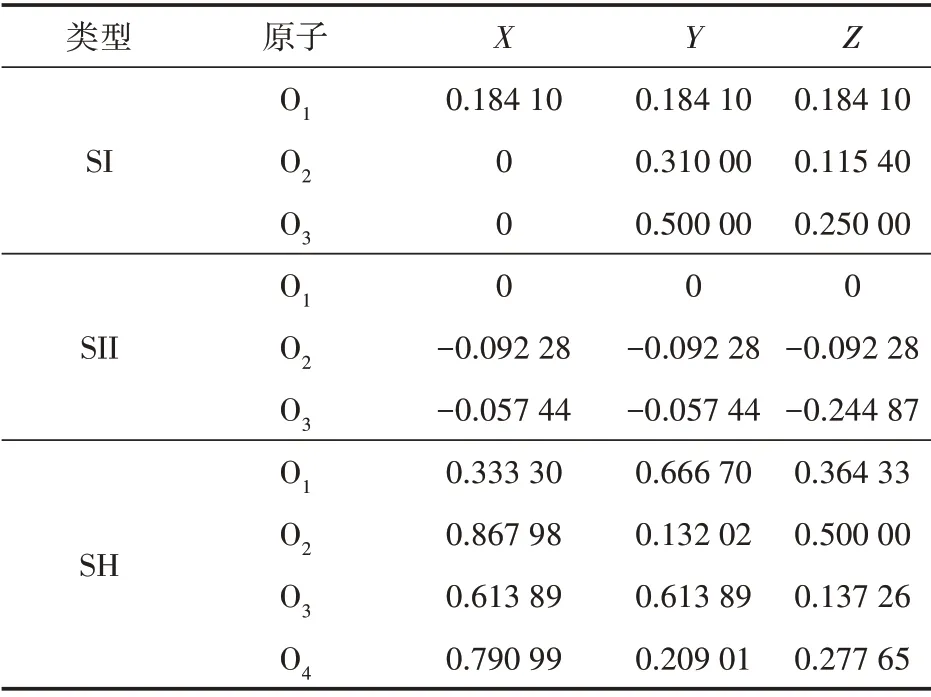
表2 3种典型水合物氧原子坐标Table 2 Oxygen atom coordinates of three typical hydrates
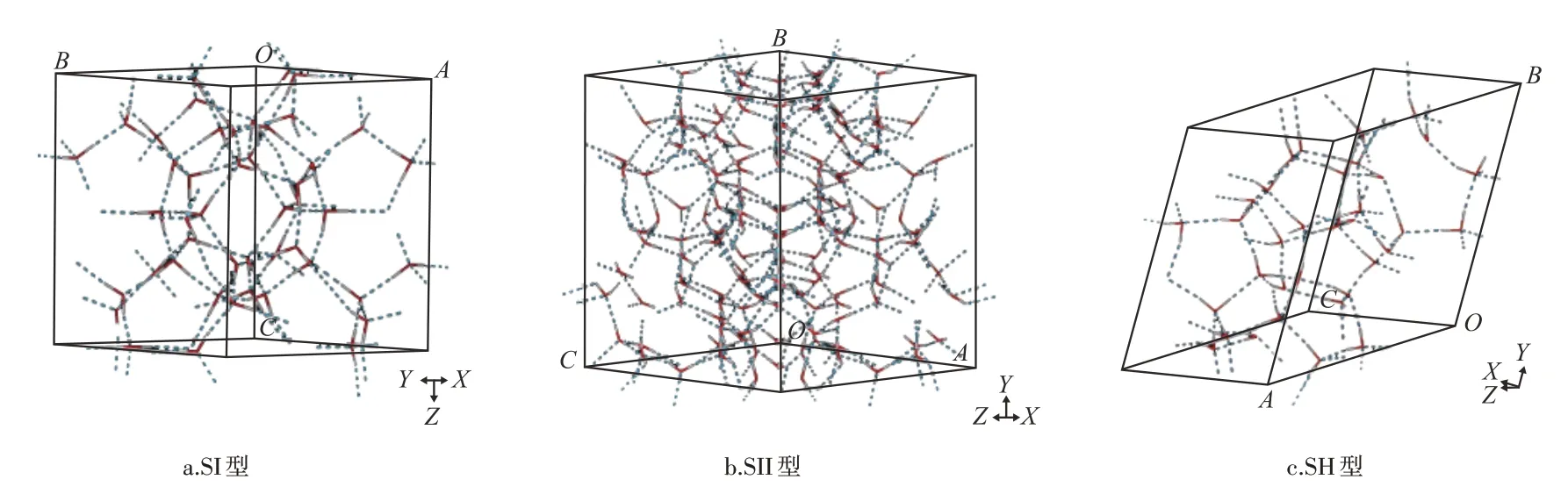
图1 3种水合物优化后分子模型Fig.1 Optimized molecular models of three hydrates
3 气体水合物微观表征
在气体水合物中,水分子间通过氢键作用形成笼形结构。对于不同类型的气体水合物,受氢键受体与供体距离和角度的影响,氢键的数目和长度存在差异,使得水合物中的笼形结构也各不相同。水合物的笼形结构为客体分子提供了赋存的孔隙空间,表征水合物的微观结构,如其内部的氢键、孔隙结构和孔径分布对水合物储气特性分析具有重要意义。
3.1 3种典型水合物的氢键
图2 为3 种水合物的氢键数目和长度分布。SI型水合物单胞中一共含有92 个氢键,氢键最长为1.644Å,最短为1.560Å,平均长度为1.615Å。SII型水合物单胞中共含有272 个氢键,氢键最长为2.432Å,最短为1.772Å,平均长度为1.930Å。SH 型水合物单胞中共含有68 个氢键,氢键最长为2.481Å,最短为1.779Å,平均长度为1.831Å。3 种水合物中,SII 型水合物的氢键数目最多且平均长度最大,而SI 型水合物最长氢键和最短氢键的长度差值最小。

图2 3种水合物的氢键数目和长度分布Fig.2 Hydrogen bond number and length distribution of three hydrates
3.2 3种典型水合物的孔隙结构
图3 为3 种水合物基于Connolly Surface 方法计算的孔隙分布。基于Connolly Surface 方法,SI 型水合物的骨架体积为857.57Å,自由体积为543.35Å,孔隙度为38.8 %。而基于Solvent Surface 方法,由甲烷探针计算出的SI 型水合物孔隙度为0.4 %,远小于Connolly Surface 方法计算结果。SII 型水合物基于Solvent Surface 方法,由甲烷和二氧化碳探针计算出的孔隙度分别为0.9%和2.0%,采用Connolly Surface方法测得的孔隙度为45.5 %。SH 型水合物由Connolly Surface方法计算的孔隙度为48.4%,用甲烷和二氧化碳为探针,采用Solvent Surface 方法测出的孔隙度分别为1.8%和3.3%。3 种典型水合物中,SI型和SH 型水合物的孔隙连通性较好,而SII 型水合物的孔隙连通性相对较差。SII型水合物中氢键数目最多,交错的氢键将水合物中的孔隙空间分割为较多不连通的小孔隙。
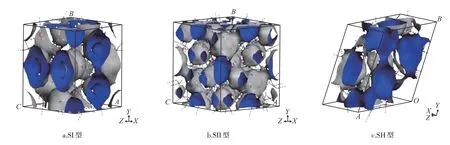
图3 3种水合物孔隙分布(Connolly Surface)Fig.3 Pore distribution of three hydrates(Connolly Surface)
3.3 3种典型水合物的孔径分布
图4 为3 种水合物的孔径分布。SI 型水合物的孔径分布曲线上出现两个明显峰,表明结构中存在两种类型的孔隙。其中,较小的孔隙直径约为3.9Å,较大的孔隙直径约为4.2Å。两个峰对应的孔隙直径较为接近,反映出孔隙的分布较为集中。SII 型水合物孔径分布曲线上主要出现两个明显的峰,表明SII型水合物中也主要存在两种类型的孔隙。相对于SI型水合物,SII 型水合物孔径分布曲线上两个峰对应的孔隙直径差值较大,表明其孔隙分布相对分散。其中,较小的孔隙直径介于4.0Å ~4.2Å,较大的孔隙直径介于5.6Å ~5.7Å。SH 型水合物孔径分布曲线上主要出现3 个较为明显的峰,表明SH 型水合物中主要存在3 种类型的孔隙。其中,较小的孔隙直约为3.3Å,中间孔隙直径介于3.9Å ~4.4Å,较大的孔隙直径约为6.4Å。3种典型气体水合物中,SI型水合物的孔隙分布最为集中,SH 型水合物的孔隙分布最为分散。SH 型水合物不仅具有最小直径的孔隙(3.3Å),还具有最大直径的孔隙(6.4Å)。水合物中最大孔隙直径的顺序为SH 型>SII 型>SI 型,与3 种水合物中最长氢键的大小顺序一致。
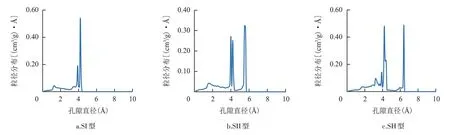
图4 3种水合物的孔径分布Fig.4 Pore size distribution of three hydrates
4 气体水合物微观储气特性
水合物中气体的吸附量可反映水合物的储气能力,气体的吸附热可反映气体的赋存稳定性。采用巨正则蒙特卡洛方法模拟甲烷和二氧化碳在水合物中的吸附行为,分析温度、压力、水合物类型和气体类型对气体吸附量和吸附热的影响规律。
4.1 水合物吸附特征
以SI型水合物为例,研究温度、压力和气体类型对水合物吸附特征的影响。图5 为甲烷和二氧化碳在SI型水合物中的等温吸附曲线。SI型水合物对甲烷的吸附量随着压力的增大而增加,随着温度的增加而降低,在高压区,3 个温度之间吸附量的差别较小。SI 型水合物对二氧化碳的吸附量也随压力的增大而增加,随着温度的增加而降低,在高压区,280 K下吸附量增加的趋势小于275 K 和265 K。因此,在低温高压下,水合物储气效率更高。此外,相同温度压力下,在SI型水合物中,总体上甲烷的吸附量大于二氧化碳的吸附量。
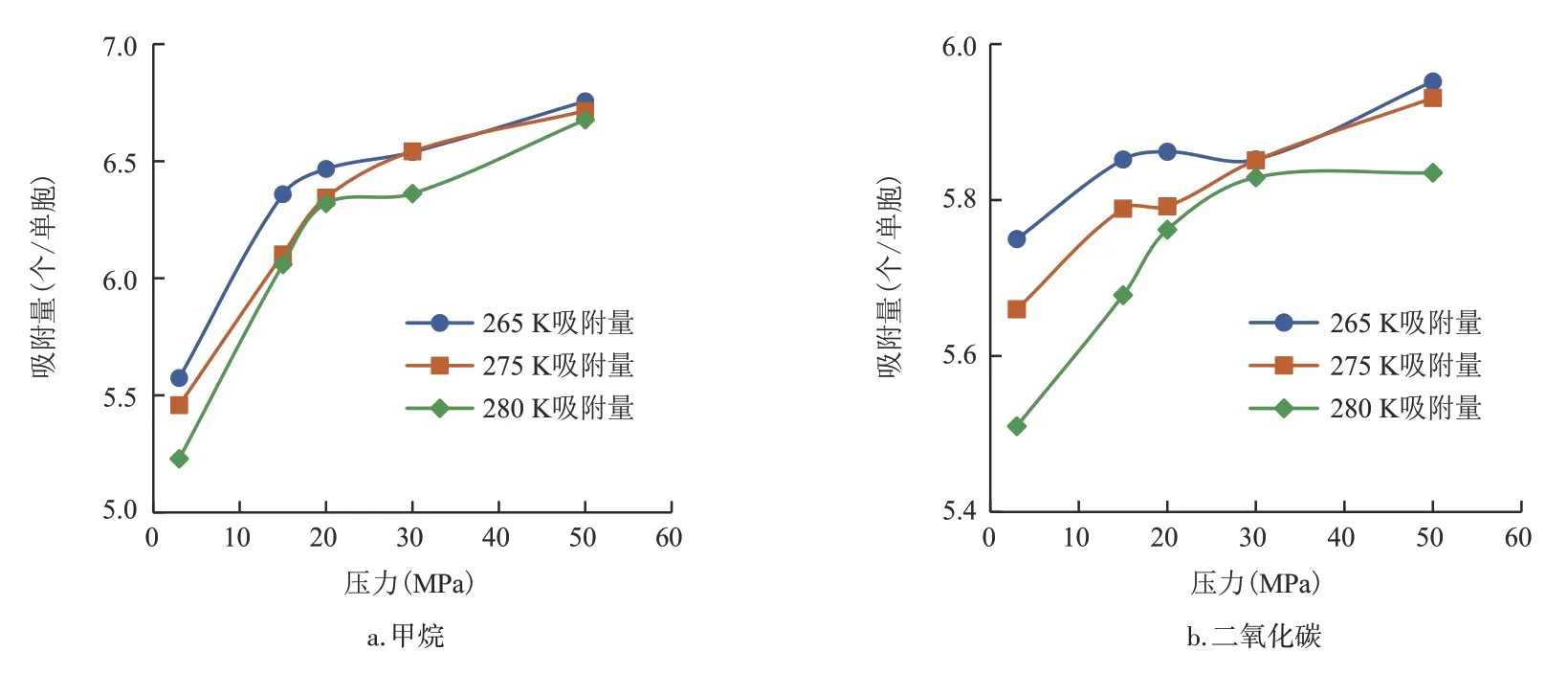
图5 SI型水合物对甲烷和二氧化碳的吸附量Fig.5 Adsorption capacity of SI hydrate for methane and carbon dioxide
图6 为甲烷和二氧化碳在SI 型水合物中的等量吸附热。在SI 型水合物中,甲烷的吸附热随着压力的增加而增加,随着温度的降低而增加。相比高压区,吸附热在低压区随压力的变化相对平缓。二氧化碳的吸附热同样随着压力的增加而增加,随着温度的降低而增加。高压区,二氧化碳吸附热的增量趋于平缓。而在低压区,相比275 K和265 K,二氧化碳吸附热在280 K下随压力增加幅度更大。
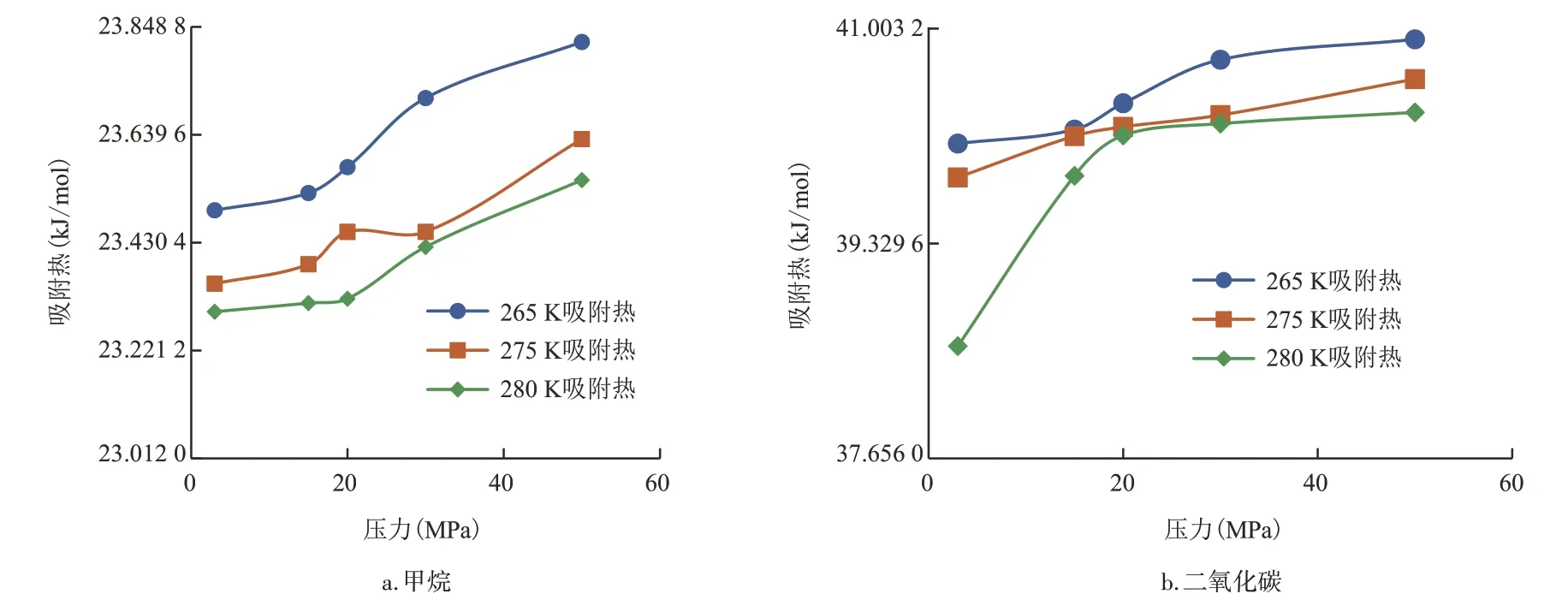
图6 SI型水合物对甲烷和二氧化碳的吸附热Fig.6 Adsorption heat of methane and carbon dioxide by SI hydrate
4.2 3种水合物的储气特性差异
图7 为3 种水合物对甲烷和二氧化碳的吸附量对比图。在265 K 下,SII 型水合物对甲烷的吸附量在3 种水合物中最大,SI 型水合物和SH 型水合物对甲烷的吸附量相差较小。3 种水合物中,SII 型水合物对二氧化碳的吸附量最大,其次是SH 型水合物,最低为SI 型水合物。SII 型水合物对甲烷和二氧化碳的吸附量均为最大,可由水合物的孔隙结构差异解释。3 种水合物中,SI 型水合物的孔隙度最小,储气能力最低。虽然SH 型和SII 型水合物的孔隙度接近,但是SH 型水合物中含有较多的小孔隙(约3.3Å),气体分子基本无法进入。因此,SII 型水合物具有最大的有效储气空间,使得其对气体的吸附能力最大。
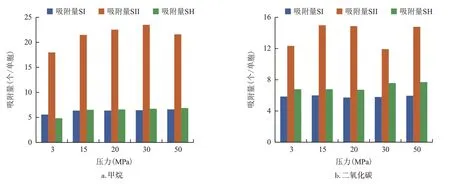
图7 265 K下3种水合物中甲烷和二氧化碳的吸附量对比Fig.7 Comparison of adsorption capacity of methane and carbon dioxide in three hydrates at 265 K
图8 为3 种典型水合物对甲烷和二氧化碳的吸附热对比图。3种水合物中,SI型水合物对甲烷分子的吸附热最大,SII型和SH型水合物对甲烷的吸附热比较接近。在50 MPa 下,SI 型水合物中甲烷吸附热为23.819 512 kJ/mol,SII 型和SH 型水合物中甲烷吸附热分别为20.899 080 kJ/mol 和20.175 248 kJ/mol。SI 型水合物吸附二氧化碳分子产生的吸附热最大,其次是SH 型水合物,最小为SII 型水合物。在50 MPa 下,SI 型、SH 和SII 型水合物中二氧化碳的吸附热 分 别 为40.919 52 kJ/mol,37.706 208 kJ/mol 和37.358 9 kJ/mol。3 种水合物中,SI 型水合物对甲烷和二氧化碳的吸附热均为最大,该现象与水合物的结构特征有关。相比SII 型和SH 型水合物,SI 型水合物中的氢键长度最短,孔隙尺寸最小,气体分子与水合物孔隙的相互作用势最大,进而使得气体的吸附热最大。总体上,3种水合物中甲烷吸附量大于二氧化碳吸附量,而二氧化碳的吸附热大于甲烷吸附热。甲烷的分子尺寸(3.8Å)大于二氧化碳分子尺寸(3.3Å),二氧化碳分子能够进入水合物中更小的孔隙,因而使得其吸附热大于甲烷。

图8 265 K下3种水合物中甲烷和二氧化碳的吸附热对比Fig.8 Comparison of adsorption heat of methane and carbon dioxide in three hydrates at 265 K
5 结论
1)在3 种典型水合物中,SI 型水合物的氢键最短,SII 型水合物的平均氢键长度最大且氢键数目最多,SH 型水合物的氢键数目最少。SII型水合物中交错的氢键将孔隙空间分割为较多不连通的小孔隙,使得其孔隙连通性差于SI 型和SH 型水合物。水合物中最大孔隙直径的顺序为SH型>SII型>SI型,与3种水合物中最长氢键的大小顺序一致。
2)3 种典型水合物中,甲烷和二氧化碳的吸附量以及吸附热均随压力增大而增加,随温度增加而降低。高压有利于提升水合物对甲烷和二氧化碳的储气量,低温可增加水合物中甲烷和二氧化碳吸附的稳定性。
3)3 种典型水合物中,SII 型水合物具有最大的有效储气空间,使得其对甲烷和二氧化碳的吸附量最大;SI 型水合物中的氢键长度最短,孔隙尺寸最小,气体与水合物孔隙的相互作用势最大,使得甲烷和二氧化碳的吸附热最大。
4)3 种典型水合物中,甲烷吸附量大于二氧化碳吸附量,但二氧化碳吸附热大于甲烷吸附热,表明二氧化碳储存量虽小于甲烷,但二氧化碳与水合物的吸附稳定性大于甲烷。
