致病性小肠结肠炎耶尔森氏菌分离鉴定及三重PCR检测方法的建立
2021-06-17张楠驰苟小兰
张楠驰,苟小兰,王 利
(西南民族大学,青藏高原动物遗传资源保护与利用国家教育部重点实验室,动物科学国家民委重点实验室,四川成都 610041)
小肠结肠炎耶尔森氏菌(Yersinia enterocolitica)属于肠杆菌科、耶尔森氏菌属[1]。小肠结肠炎耶尔森氏菌是一种人畜共患病原菌,也是一种重要的食源性致病菌,很多国家都已将该菌列为进出口食品的常规检测项目[2]。小肠结肠炎耶尔森氏菌可导致人和动物患急性腹泻、脑膜炎、心肌炎等临床疾病,极易感染免疫力低下的初生动物和婴儿,对人和动物机体健康造成一定的威胁[3-4]。该菌具有广泛的宿主性,传播范围广、感染频率高,可感染家畜、家禽、鸟类及昆虫等[5]。该菌广泛分布于自然界,在水、土壤、动物以及食物中均可被检测出,可通过人、动物、食物、水源等介质进行传播,也是少数能在冷藏温度下生长的肠道致病菌之一[4,6-8]。致病性小肠结肠炎耶尔森氏菌可能含有ystA、ystB、yadA和virF等多个毒力基因[9]。检测位于染色体上的黏附侵袭位点基因ail可鉴定食品中致病性小肠结肠炎耶尔森氏菌,该方法被ISO/TS18867:2015等标准所采用[9]。intB基因是耶尔森氏菌属所携带的耶尔森氏菌强毒力岛(High-pathogenicity island,HPI)毒力基因中的一段基因,耶尔森氏菌侵袭蛋白(Invasin,inv)在致病性小肠结肠炎耶尔森氏菌中表达[10]。因此同时检测ail、intB和inv基因可鉴定样品中是否含有致病性小肠结肠炎耶尔森氏菌。
我国目前检测动物和食品中致病菌的方法主要是传统的微生物学检测方法,虽然结果较为可靠,但具有检测速度慢、程序复杂和成本高等缺点。因此,需要建立一种快速、准确、有效地检测小肠结肠炎耶尔森氏菌的方法。快速检测细菌的分子生物学检测技术主要有常规PCR技术、多重PCR技术等。常规PCR技术主要是扩增细菌的一条特异性基因,而不同细菌间16S rDNA基因、23S rDNA基因序列具有一定同源性,这将对该检测方法的特异性产生一定的影响[11-12]。多重PCR技术具有高效性、系统性、经济简便性等特点,与常规PCR技术相比具有更高的特异性,被应用于病原微生物的检测和基因分型鉴定等方面,在细菌快速检测方面也有着重要的临床意义和广泛的应用前景[13-14]。本实验室从病鲫鱼心脏中鉴定出菌株fsznc-10,设计并建立一种可以快速、准确、有效的鉴定该菌的多重PCR方法,以期为防治和检测由该菌引起的人和动物共患疾病的研究提供参考依据。
1 材料与方法
1.1 材料与仪器
患病鱼 来源于四川省某养殖场发现的一批腹部轻微出血、肿胀、肛门红肿的鲫鱼;营养肉汤培养基 北京奥博星生物技术有限责任公司;CIN-1培养基及配套试剂、改良Y培养基 杭州微生物试剂有限公司;PremixTaq(TaKaRa Taq Ver.2.0 plus dye)、核酸分子量标准品(DL2000 Marker) 大连宝生生物有限公司;细菌基因组DNA提取试剂盒 天根生物有限公司;细菌生化鉴定管 杭州微生物试剂有限公司;标准革兰氏染色试剂盒 北京雷根生物技术有限公司;假结核耶尔森氏菌(Yersinia pseudotuberculosis)、维氏气单胞菌(Aeromonas veronii)、哈维氏弧菌(Vibrio harveyi)、门多萨假单胞菌(Pseudomonas mendocina)、霍乱弧菌(Vibrio cholerae)、嗜水气单胞菌(Aeromonas hydrophila)、弗劳地枸橼酸杆菌(Citrobacter freundii)、中间气单胞菌(Aeromonas media)、粪肠球菌(Enterococcus faecalis)、大肠埃希氏菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)、类志贺邻单胞菌(Plesiomonas shigelloides)、霍氏肠杆菌(Enterobacter hormaechei)和无丙二酸枸橼酸杆菌(Citrobacter amalonaticus) 均保藏于西南民族大学动物科学国家民委重点实验室;85条健康成年鲫鱼(516.05±20.04 g) 购自成都某市场。
ESJ200-4电子天平 沈阳龙腾电子有限公司;HZQ-X100恒温振荡培养箱 四川新科仪器有限公司;SteriLGARD IIIADVANCE生物安全柜 Baker公司;DHP-9052电热恒温培养箱 上海齐欣科学仪器有限公司;DHG-9203A高温鼓风干燥箱 上海一恒科技有限公司;WGZ-2XJ细菌浊度计 上海昕瑞仪器仪表有限公司;DYY-6B稳压稳流电泳仪 北京市六一仪器厂;13395H2X生物显微镜 Leica公司;KW-1000DC恒温水浴锅 金坛市科析仪器有限公司;S1000 Thermal Cycler基因扩增仪、GEL DOC2000凝胶成像系统 伯乐公司。
1.2 实验方法
1.2.1 病料及处理 接种环无菌处理后,在病鱼心脏取样并接种于营养琼脂培养基中,28 ℃恒温培养18 h观察。
1.2.2 菌株分离和生理生化鉴定 挑取1.2.1中外观一致的单菌落,并对其进行细菌纯化培养后转入营养肉汤培养基培养,28 ℃、180 r/min培养18 h。采用革兰氏染色法对细菌菌体进行染色,显微镜下观察其颜色和形状。采用细菌生化鉴定管进行生化鉴定,鉴定标准参照《伯杰细菌鉴定手册》和《鱼类及其他水生动物细菌实用鉴定指南》[15]。
1.2.3 细菌基因组DNA提取及16S rDNA序列分析
根据细菌基因组DNA提取试剂盒说明书,提取分离细菌总DNA。采用本实验室使用的16S rDNA通用引物(F:5'-AGAGTTTGATCCTGGCTCAG-3' /R:5'-CTACGGCTACCTTGTTACGA-3'),以提取的分离菌DNA作为模板进行PCR扩增,PCR产物纯化回收后由生工生物工程(上海)股份有限公司进行双向测序并拼接。将分离菌命名为fsznc-10,拼接后的16S rDNA序列提交至GenBank获取登录号,并在GenBank上进行BLAST序列比对,选取相似度较高的细菌16S rDNA基因序列,利用Mega 5.0软件构建系统进化树。
1.2.4 分离菌毒力基因扩增 采用文献[10]设计的ail、ystB、virF、yadA、intB5对毒力基因引物,由上海生工生物工程技术服务有限公司合成。以提取的菌株fsznc-10 DNA作为模板进行PCR扩增。PCR产物经2.0%琼脂糖凝胶电泳检测。
1.2.5 分离菌药敏试验 采用KB纸片扩散法,培养后的菌液用细菌浊度仪测量细菌浓度后无菌水调至到0.5麦氏,取100 μL涂布于Mueller-Hinton Agar培养基,35 ℃培养18 h后测量结果。药物药敏纸片规格及敏感程度判断标准数据参照第28版CLSI标准。
1.2.6 分离菌致病性能验证 将分离菌分别制备成浓度为3×103~3×108CFU/mL的菌悬液作为试验组,10倍等比稀释,共6个浓度梯度。选取60尾健康鲫鱼,每浓度梯度10尾,分别腹腔注射0.1 mL菌悬液,另选取10尾健康鲫鱼腹腔注射0.1 mL生理盐水作对照,饲养7 d观察发病和死亡情况,参照文献[16]计算分离菌的半数致死量(LD50)。致病菌的再次分离采用改良Y选择性培养基。
1.2.7 特异性引物设计及三重PCR扩增 利用表1中ail和intB毒力基因引物,并根据GenBank公布的小肠结肠炎耶尔森氏菌inv毒力基因设计的一对特异性引物(详见表1)建立检测分离菌(小肠结肠炎耶尔森氏菌)的三重PCR方法。取1.2.3中提取的fsznc-10细菌基因组DNA作为模板,用表1中的ail、intB和inv三对引物分别扩增。反应总体系为25 μL,PremixTaq12.5 μL,上下游引物各1 μL,DNA模板1.0 μL,ddH2O9.5 μL。单重PCR反应条件为94 ℃ 4 min;94 ℃ 45 s、(45~64 ℃)45 s、72 ℃ 40 s,30个循环;72 ℃ 5 min,确定三对引物的共同最佳退火温度。三对引物按照1:1:1的比例进行三重PCR扩增,通过观察目的条带的亮度,调节对应引物对的添加比例,以优化各引物在三重PCR总反应体系中的浓度。三重PCR退火温度在45~64 ℃范围的16个温度梯度进行筛选,以确定三重PCR的最佳退火温度。PCR均采用2.0%琼脂糖凝胶电泳检测。
1.2.8 特异性和敏感性试验 采用细菌基因组DNA提取1.1中保存的各菌种的基因组作为模板,按照优化后的反应条件和反应体系进行三重PCR扩增,以检测该方法的特异性。测定菌株fsznc-10基因组DNA浓度后,用无菌去离子水对DNA样品进行10倍倍比稀释(100~109倍)后作为模板,按照优化后的反应条件进行三重PCR扩增。
1.2.9 三重PCR检测法的临床应用 随机选择15个1.2.1中采集的发病和死亡鲫鱼的心脏组织样品,匀浆后进行细菌基因组DNA提取,采用本研究建立的三重PCR扩增,同时利用CIN-1培养基和改良Y培养基对各心脏组织中的细菌进行分离培养并进行16S rDNA序列分析,比较检测结果。
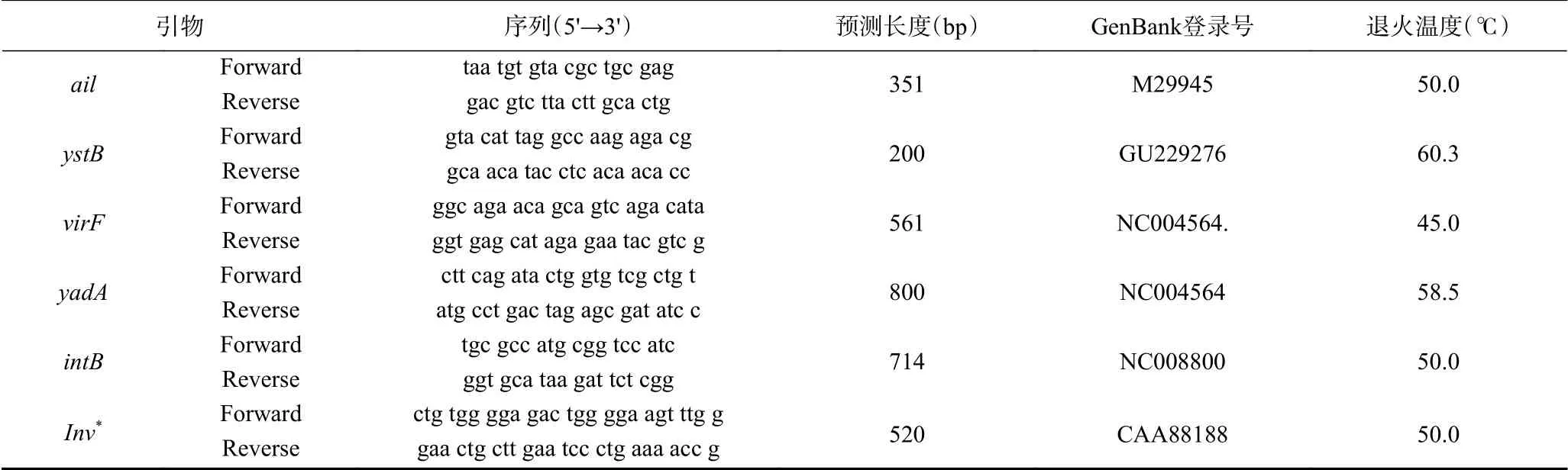
表1 小肠结肠炎耶尔森氏菌毒力基因引物序列Table 1 Primers of the virulence genes in the Y. enterocolitic strains
1.3 数据处理
PCR扩增图谱均有BioradChemiDoc MP凝胶成像系统产生,后由Adobe Photoshop 13.0处理。系统发育树图片由Mega 5.0软件构建,Adobe Photoshop 13.0处理。菌株生化鉴定和耐药表型试验均为三个重复组。
2 结果与分析
2.1 分离菌形态学和理化特性鉴定
将分离菌fsznc-10在营养琼脂培养基中28 ℃恒温培养18 h后,菌落呈现为圆形,直径1.0~3.2 mm,乳白色隆起,边缘整齐,表面光滑湿润。经革兰氏染色后,菌株为革兰氏阴性短杆菌,多单个散在分布或排列成堆。分离菌fsznc-10的主要生理生化试验结果表明分离菌株具有动力性,V-P试验、β-半乳糖苷酶、过氧化氢酶实验结果呈阳性,不利用枸椽酸盐,不分解蔗糖、葡萄糖,不发酵鼠李糖、棉籽糖,还原硝酸盐为亚硝酸盐,不产H2S,部分菌株分解肌醇、七叶苷。参照《伯杰氏系统细菌鉴定手册》[1]和《鱼类及其他水生动物细菌实用鉴定指南》[15],基本符合小肠结肠炎耶尔森氏菌的生化特性。
2.2 分离菌16S rDNA序列分析
分离菌16S rDNA的PCR扩增产物显示其片段约为1500 bp(图1)。测序结果显示,分离菌株16S rDNA片段长度为1424 bp。将分离菌株16S rDNA基因序列提交到GenBank中获得登录号MN416303。16S rDNA基因的系统发育树结果显示,菌株fsznc-10与Yersinia enterocoliticaGM2402聚为一支(图2),置信度为100。结合分离菌株形态学和理化特性,综合判定菌株fsznc-10为小肠结肠炎耶尔森氏菌(Yersinia enterocolitica)。

图1 分离菌16S rDNA基因PCR扩增结果Fig.1 PCR amplification results of 16S rDNA gene of the isolate strain
2.3 分离菌毒力基因扩增
经PCR扩增的方法检测分离菌株毒力基因结果显示,菌株fsznc-10扩增出长度分别约为351、200、561和714 bp的条带(图3)。表明菌株fsznc-10携带ail、ystB、virF、intB毒力基因。
2.4 分离菌药敏试验
菌株fsznc-10对诺氟沙星、庆大霉素、多粘菌素B、阿米卡星和链霉素敏感,对头孢曲松和复方新诺明中度敏感,对氨苄青霉素、呋喃唑酮和头孢噻吩耐药(表2)。表明可采用诺氟沙星、庆大霉素、多粘菌素、阿米卡星和链霉素防治由小肠结肠炎耶尔森氏菌引起的鲫鱼疾病。

图2 菌株fsznc-10 16S rDNA基因序列的系统发育树Fig.2 Phylogenetic tree of strain fsznc-10 16S rDNA gene sequence
2.5 分离菌致病性能验证
经腹部注射最高浓度(3 × 108CFU/mL)分离菌株的鲫鱼,1 d后出现游动缓慢、反应迟钝的症状,部分病鱼鱼鳍基部、上下颚、眼球等部位略有出血点,约36 h开始出现死亡现象,72 h内全部死亡,对照组未见异常或死亡鱼。参照文献[16]计算得出菌株fsznc-10的LD50为7.54×104CFU,表明菌株fsznc-10对鲫鱼具有较强的致病性。从感染死鱼的心脏中分离出的细菌在改良Y平板上呈现粉红色、向上隆起、表面湿润的特征菌落,经16S rDNA序列分析鉴定为小肠结肠炎耶尔森氏菌。
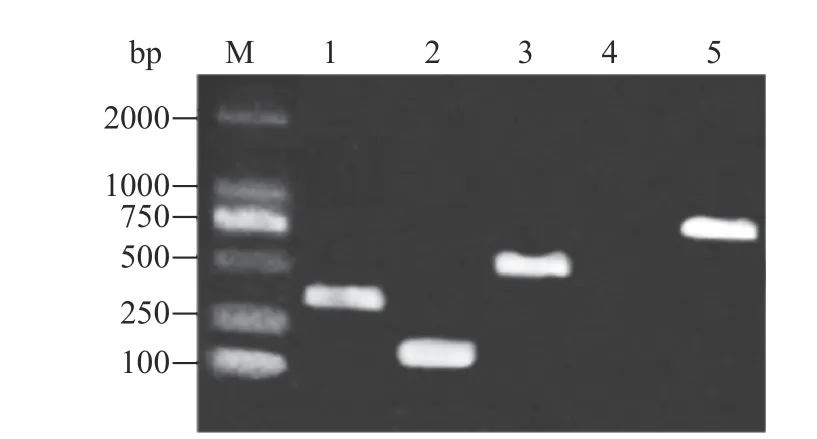
图3 毒力基因的PCR扩增结果Fig.3 PCR amplification of virulence gene

表2 药敏实验结果Table 2 Results of antibiotic sensitivity test
2.6 单一PCR和三重PCR扩增
3对毒力基因的单一PCR扩增结果显示,分别扩增出了约300、500和700 bp的目的条带,测序结果显示各基因片段大小均与预期结果基本一致(图4)。经优化,确定三重PCR最优反应体系为:Premix Taq 12.5 μL,ail上下游引物各1.5 μL,inv上下游引物各1.0 μL,intB上下游引物各0.5 μL,DNA模板2.0 μL,ddH2O 4.5 μL,总体系为25 μL。三重PCR最优反应条件为:94 ℃ 4 min;94 ℃ 45 s,50 ℃ 45 s,72 ℃ 40 s,共30个循环;72 ℃ 5 min。三重PCR扩增结果显示,出现三条清晰条带,且无其他杂带,三对引物之间无干扰,扩增准确。

图4 单一PCR与多重PCR扩增结果Fig.4 Results of single PCR and multiplex PCR amplifications
2.7 特异性和敏感性试验结果
特异性试验结果显示,仅fsznc-10三重PCR扩增结果出现3条清晰目的条带,片段大小分别约为351、520和714 bp,其他菌株均未扩增出三条目的条带(图5),表明所建立的三重PCR方法特异性较强。敏感性试验结果显示(图6),菌株fsznc-10 DNA模板稀释前的浓度为170.40 ng/μL,所建立的多重PCR检测法检测fsznc-10的最低模板浓度为1.704 × 10-6ng/μL,表明该方法敏感性较高。

图5 三重PCR的特异性检测Fig.5 Specificity detection of triple PCR

图6 三重PCR的敏感性试验结果Fig.6 Sensitivity test results of triple PCR
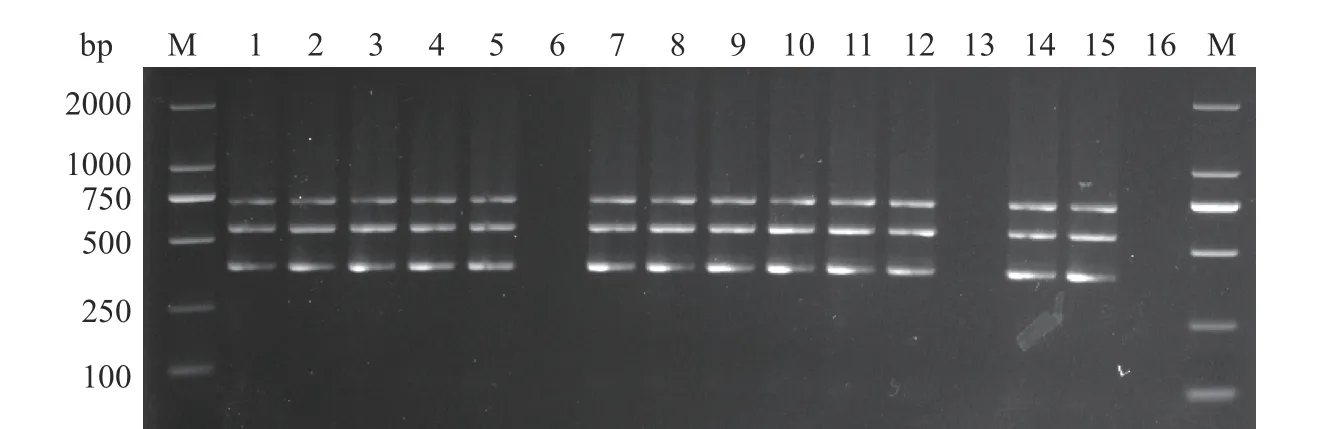
图7 临床样品三重PCR检测结果Fig.7 Triple PCR results of clinical samples
2.8 三重PCR检测法的临床应用
采用本试验建立的三重PCR方法对15个发病鲫鱼心脏组织样品进行检测,结果显示13个样品呈阳性(图7),阳性检测率约为86.67%。另外,采用CIN-1培养基和改良Y培养基对上述各心脏组织中的细菌进行分离培养并进行16S rDNA序列分析,均得到了相同的结果。表明本试验建立的三重PCR方法适合应用于临床样品的检测。
3 讨论与结论
小肠结肠炎耶尔森氏菌作为一种食源性人畜共患致病菌,该菌的检测具有重要的公共卫生意义[17-18]。由该菌引起的临床症状主要表现为急性腹痛、腹泻、呕吐等胃肠现象及结节性红斑、关节炎、骨髓炎、肝炎、败血症等并发症[19]。目前,已有研究人员从粪便、肉类食品等分离到小肠结肠炎耶尔森氏菌并检测到一些毒力基因。许文炯等[20]、姜晓梅等[21]分别检测到鲜肉样品、人粪便中小肠结肠炎耶尔森氏菌均携带ail、ystA、ystB、yadA、virF等毒力因子。YadA、ail、intB、virF和inv毒力因子可介导胶原蛋白、纤粘蛋白和层粘连蛋白等结合从而增加细菌的粘附作用,还能减弱抗菌多肽对细菌的杀伤作用。YstB毒力因子是耶尔森氏菌引起腹泻的重要原因之一。本试验检测到菌株fsznc-10携带ail、ystB、virF、intB毒力基因,未检测到yadA,这与苟小兰等[22]的检测结果基本一致。结合毒力基因检测和致病性能验证试验结果,表明该菌具有较强的致病性。
传统检测小肠结肠炎耶尔森氏菌的方法需通过中温增菌培养、理化鉴定、血清学分析等一系列复杂过程,存在费时费力、操作繁琐等特点,而且检出率不高,不利于及时准确诊断小肠结肠炎耶尔森氏菌。目前报道的小肠结肠炎耶尔森氏菌检测方法主要有荧光定量及酶联免疫吸附技术,这些方法不仅需要昂贵的仪器设备,而且对实验人员的操作技能要求也较高,不利于普及运用[23]。随着分子生物学的迅速发展,相关学者对小肠结肠炎耶尔森氏菌的毒力基因及致病机制有了更加深入细致的了解,这为从分子水平上鉴定小肠结肠炎耶尔森氏菌及评估菌株的毒力提供了理论基础与技术支持。影响多重PCR检测的效果的因素有很多,模板浓度、引物特异性和稳定性等均可影响检测效果。在目前的研究中,有多种形式的多重PCR检测方法,如利用一条或多条保守基因的方法检测一种或多种细菌、利用数条特异性基因同时检测数种细菌等,此类方法通过一条特异性基因或多条非特异性基因(如16S rDNA和23S rDNA序列)来判断样品中是否含有目的细菌,但检测方法的特异性和准确性欠佳[24-26]。本试验采用三条毒力基因检测一种细菌的方法,以提高所建立检测法的特异性和准确性,在临床应用实验中可检测出100%含有小肠结肠炎耶尔森氏菌的样品。该检测方法具有特异性高、敏感性高、准确可靠的特点,并且可在2 h内检测出菌样是否含有小肠结肠炎耶尔森氏菌,同时降低了鉴定细菌的成本。
综上所述,本试验从病鲫鱼中分离出小肠结肠炎耶尔森氏菌,检测该菌携带ail、ystB、virF、intB毒力基因,经分离菌致病性能验证试验验证了该菌为病原菌。利用ail、inv和intB三条毒力基因建立了一种快速、准确地检测小肠结肠炎耶尔森氏菌的三重PCR方法,并检测出该菌对诺氟沙星和庆大霉素等5种抗生素敏感。这为小肠结肠炎耶尔森氏菌的快速检测及防控提供了科学资料。
