海蜇Ⅰ型胶原蛋白的提取及结构特性研究
2021-06-17冯玲玲李春阳
冯玲玲,冯 进,李春阳,
(1.哈尔滨商业大学食品工程学院,黑龙江哈尔滨 150076;2.江苏省农科院农产品加工所,江苏南京 210014)
胶原蛋白是普遍存在于动物结缔组织中的一类纤维状蛋白,也是构成细胞外基质(extracellular matrixc,ECM)的主要成分,占动物总蛋白的25%~30%[1]。它具有由三条肽链相互缠绕而成的三螺旋稳定结构,在维持组织结构和功能的完整性方面起着至关重要的作用。目前,研究人员已根据胶原蛋白的序列同源性和分子结构将其分为29种类型(IXXIX型)[2-3],其中,I型胶原蛋白在研究中最为常见,它含有3条α-链,组成方式一般为[α1(I)]2α2(I)或[α1(I)]3[4]。因其具有优良的生物相容性、生物降解性以及低抗原性,而在食品、材料以及化妆品等领域有着较为广泛的应用。目前,胶原蛋白的制备来源主要为陆生哺乳动物的皮肤和骨骼,但由于多种人畜共患病的爆发以及宗教信仰等问题,使得该种胶原蛋白在实际生产应用中受到了极大的限制[5]。因此,许多研究人员开始将注意力集中在水生胶原蛋白上,例如鲷鱼[6]、海参[7]、金枪鱼[8]等,都已被认为是天然胶原蛋白的提取来源。
海蜇是海蜇属的统称,目前普遍分布于热带、亚热带以及温带沿海地区。随着人工繁育的成功,海蜇数量不断增加,但由于其收获期短、易腐败,大多因并未得到及时处理而失去商品价值,造成了严重的经济和社会影响。海蜇中蛋白质含量约占干物质的60%[9],其中胶原蛋白为主要蛋白,占总蛋白的50%左右[10]。因此,海蜇可作为一种天然安全的胶原蛋白提取来源,极具开发价值。目前,国内外对海蜇胶原蛋白的提取研究较多[11-13],但对其结构特性的相关研究比较少。基于此,本研究采用胃蛋白酶从海蜇中提取胶原蛋白,并通过紫外光谱、傅里叶变换红外光谱、圆二色谱等分析手段对海蜇胶原蛋白结构特性进行系统研究,旨在提高海蜇的产品附加值,减少资源浪费,并为利用海蜇胶原蛋白进一步制备出生物材料和活性肽提供有利的参考。
1 材料与方法
1.1 材料与仪器
沙海蜇加工下脚料(Rhopilema esculentum Kishinouye) 江苏海苑食品有限公司;胃蛋白酶(≥1200 U/g) 国药集团化学试剂有限公司;蛋白Marker(11~245 kDa) SDS-PAGE凝胶制备试剂盒、SDS-PAGE上样缓冲液、羟脯氨酸含量检测试剂盒 北京索莱宝科技有限公司;再生纤维素透析袋(50000 kDa) 上海源叶生物科技有限公司;硫酸、盐酸、氢氧化钠、氯化钠、磷酸二氢钠、磷酸氢二钠、甲醇、苯酚、三氯乙酸、正丁醇、尿素、石油醚、冰乙酸、考马斯亮蓝G-250 以上试剂均为分析纯。
FDU-1200真空冷冻干燥机 东京理化器械株式会社;Nicolet傅里叶变换红外光谱仪 美国Thermo公司;J-1500圆二色光谱仪 日本JASCO公司;AL104电子分析天平 梅特勒托利多仪器有限公司;PHS-2C pH计 上海智光仪器仪表公司;UV-6100紫外分光光度计 上海美普达仪器有限公司;JYSCZ2+垂直电泳槽、JY300HE通用电泳仪电源 北京君意东方电泳设备有限公司;EUROSTAR 40 Digital高速搅拌器 德国IKA公司;SU3500扫描电子显微镜 日立高新技术公司;S-433D全自动氨基酸分析仪 德国Sykam公司;Avanti J-26S XP落地式高速冷冻离心机 美国Beckman Coulter公司。
1.2 实验方法
1.2.1 基本成分分析 水分含量测定:GB 5009.3-2016《食品安全国家标准 食品中水分的测定》[14];灰分含量测定:GB 5009.4-2016《食品安全国家标准 食品中灰分的测定》[15];总糖含量测定:苯酚-硫酸法[16];蛋白质含量测定 GB5009.5-2016《食品安全国家标准食品中蛋白质的测定》[17];总脂肪含量测定:GB5009.6-2016《食品安全国家标准 食品中脂肪的测定》[18];胶原蛋白含量测定:羟脯氨酸含量检测试剂盒。
1.2.2 海蜇胶原蛋白提取 参考张雯等[19]的方法对海蜇胶原蛋白进行提取,稍作修改。取适量海蜇洗净后,切成1 cm×1 cm的小块,以料液比1:10 (w:v)添加正丁醇溶液,搅拌浸泡6 h进行脱脂处理,处理结束后用去离子水清洗皮块至无异味,收集沉淀。所得沉淀以1:15 (w:v)比例置于pH 2.0~2.5的HCl溶液中浸泡14 h,待膨胀均匀后,取出加适量去离子水打浆。皮浆中加入4.0 wt%胃蛋白酶,并用1 mol/L HCl溶液调节pH至2.3后酶解48 h,酶解结束后于10000 r/min离心20 min,取上清液缓慢加入1 mol/L NaOH溶液调节pH至7灭酶后,持续搅拌并加入粉末状NaCl至溶液终浓度为1 mol/L,待NaCl完全溶解后静置过夜,随后将盐析液于10000r/min离心60 min,收集沉淀复溶于0.1 mol/L冰乙酸溶液中,先将其置于0.05 mol/L冰乙酸溶液中透析24 h,再置于去离子水中透析48 h,冻干即得海蜇胶原蛋白样品。以上操作均在4 ℃条件下进行。
1.2.3 氨基酸组成分析 参照GB5009.124-2016《食品安全国家标准 食品中氨基酸的测定》[20],取40 mg海蜇胶原蛋白样品溶解于15 mL 6 mol/L HCl溶液中,加入苯酚3滴,抽真空封口后于110 ℃条件下水解22 h,采用氨基酸自动分析仪对其进行分析。
1.2.4 SDS-PAGE分析 参考Laemmli等[21]的方法,稍作修改。取适量海蜇胶原蛋白样品溶解于0.02 mol/L pH7.2的PBS缓冲液(含1% SDS、3.5 mol/L尿素)中,配制浓度为3 mg/mL的胶原蛋白溶液,按4:1比例与5×样品缓冲液(非还原性电泳的样品缓冲液中不含巯基乙醇)混合均匀,沸水浴5 min后取10 μL进行测定。聚丙烯酰胺凝胶由5%的浓缩胶和8%的分离胶组成,先将电压调至80 V,待样品被压缩为一条线后,调整电压至120 V,待样品至凝胶底部0.5 cm左右时停止。电泳结束后将胶条置于三氯乙酸溶液中固定15 min,考马斯亮蓝G-250中染色1 h,随后反复脱色至胶条上的条带清晰可见即可。
1.2.5 紫外全波长扫描(UV)分析 取适量海蜇胶原蛋白样品溶解于0.5 mol/L冰乙酸溶液中,配制浓度为1 mg/mL的胶原蛋白溶液,在4 ℃下10000 r/min离心5 min后,取上清液进行扫描分析。扫描波数为200~400 nm,速度为2 nm/s,同时以0.5 mol/L 冰乙酸溶液为空白对照。
1.2.6 傅里叶变换红外光谱(FTIR)分析 参考Zhu等[22]的方法,稍作修改。取适量海蜇胶原蛋白样品与干燥的KBr混合均匀并压成薄膜,置于样品室内进行扫描分析。扫描波数为500~4000 cm-1,次数为64次,速度为0.2 cm/s,分辨率为4 cm-1。
1.2.7 圆二色谱(CD)分析 参考Wang等[23]的方法,稍作修改。取适量海蜇胶原蛋白样品溶解于50 mmol/L冰乙酸溶液中,配制浓度为0.3 mg/mL的胶原蛋白溶液,取少量上述溶液置于光程为1 mm的样品池中进行扫描分析。扫描波数为190~260 nm,温度为4 ℃,同时以50 mmol/L冰乙酸溶液为空白对照。
1.2.8 扫描电子显微镜(SEM)分析 取适量胶原蛋白样品置于载物台上,经离子溅喷金处理后,用扫描电镜在10.0 kV的加速电压下放大50、100、250、500、1000倍观察海蜇胶原蛋白微观结构。
1.3 数据处理
采用Excel、Origin软件对数据进行处理和作图,每次实验均重复3次。
2 结果与分析
2.1 基本成分分析
由表1可知,海蜇中大部分都是水分,仅含有不到10%的干物质。在海蜇干物质中,蛋白质含量最大,可达73.03%,羟脯氨酸是胶原蛋白特有的一种氨基酸[24],常被用于计算胶原蛋白的含量。因而根据海蜇中羟脯氨酸的含量,计算得出胶原蛋白的含量为1.96%,占蛋白质总量39.12%。可见海蜇中胶原蛋白含量较为丰富,是一种优质的水生胶原蛋白来源。

表1 海蜇基本成分分析Table 1 Analysis of basic ingredients of Rhopilema esculenta
2.2 氨基酸组成分析
由表2可知,海蜇胶原蛋白中含有7种必需氨基酸(Val、Ile、Leu、Phe、Met、Thr、Lys),占总氨基酸总量的20.19%。主要氨基酸为Gly,占氨基酸总量的25.99%。Gly对于胶原蛋白超螺旋结构的形成至关重要,它具有由单个氢原子构成的极小侧链,可存在于超螺旋的中心且不会发生链变形,从而使三个α螺旋紧密堆积在一起,形成具有疏水性的超螺旋结构[25-26]。据相关文献报道,由于亚氨酸(Pro+Hyp)的吡咯环会限制肽链二级结构变化[27],同时Hyp还通过羟基形成链间氢键[28],维持胶原的三螺旋稳定结构,因此胶原蛋白的亚氨酸含量对其稳定性有很大的影响。海蜇胶原蛋白中亚氨酸含量为15.94%,略低于花鳗鲡鱼(18.9%)[29]和鳗鱼(20%)[30],与鲤鱼(15.4%)[31]胶原蛋白含量相似。此外,海蜇胶原蛋白中还含有丰富的Glu、Asp、Ala和Arg。其中,Glu和Asp是酸性氨基酸,二者对胶原蛋白的等电点影响较大[32]。His和Met含量较低,未检测到半胱氨酸和色氨酸。
2.3 SDS-PAGE分析
海蜇胶原蛋白的SDS-PAGE图谱如图1所示。海蜇胶原蛋白中主要含有一条135 kDa左右的α-链,以及由α-链的分子内和分子间交联所形成的一些二聚体β-链和三聚体γ-链。通过比较海蜇胶原蛋白在还原和非还原条件下的图谱,发现二者条带完全一致,说明海蜇胶原蛋白中不存在二硫键,即不存在含硫氨基酸,这是Ⅰ型胶原蛋白的一个特点[33]。另外,在48~100 kDa之间还观察到少量条带,这些小分子片段可能是由于胃蛋白酶对胶原蛋白的肽酶区域进行部分切割而得到的降解片段[34]。由图可初步判断所提胶原蛋白为I型胶原蛋白,亚基结构为[a1(I)]3,符合大多数水生胶原蛋白的结构特征[35]。
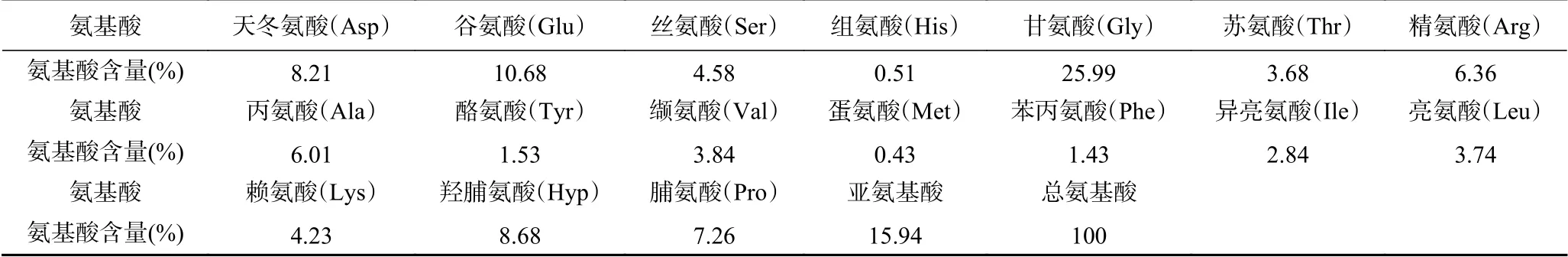
表2 海蜇胶原蛋白的氨基酸组成分析Table 2 Amino acid composition of Rhopilema esculenta collagen
2.4 紫外全波长扫描分析
海蜇胶原蛋白在200~400 nm处的UV谱图如图2所示。其最大吸收峰位于233 nm处,这主要与肽链中含有的-C=O,-COOH和CO-NH2等生色基团在230 nm附近具有明显的吸收峰有关[30]。此外,在275 nm处还可观察到一较弱的吸收峰,结合氨基酸分析,这可能是由于分子内部仍含有少量的酪氨酸,存在共轭双键引起的[36]。以上结果符合I型胶原蛋白的紫外吸收特征,与Zhang[37],蔡路昀[38]等报道的水生胶原蛋白的特性基本相似。

图1 海蜇胶原蛋白的SDS-PAGE电泳图谱Fig.1 SDS-PAGE electrophoresis pattern of Rhopilema esculenta collagen
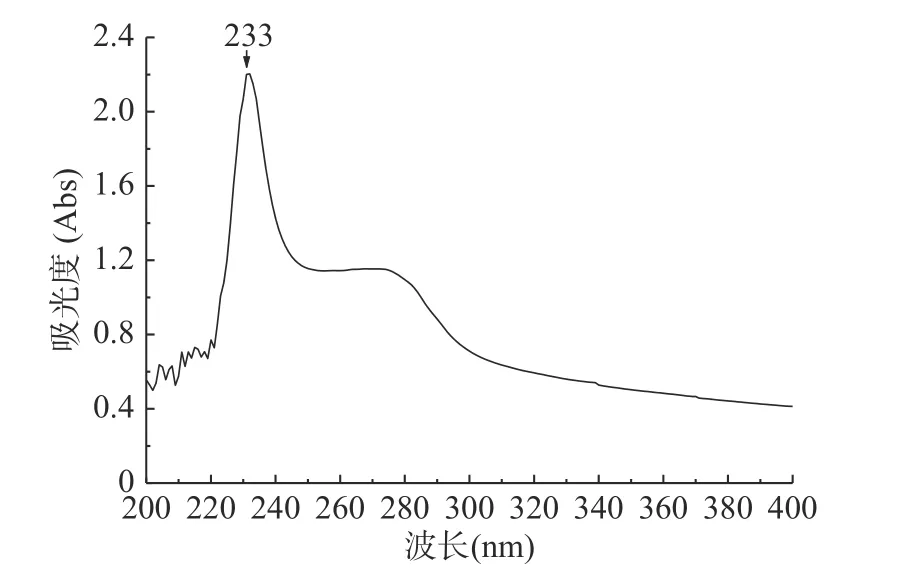
图2 海蜇胶原蛋白的紫外吸收光谱图Fig.2 UV spectrum of Rhopilema esculenta collagen
2.5 傅里叶变换红外光谱分析
海蜇胶原蛋白在500~4000 cm-1处的FTIR谱图如图3所示。在酰胺I、II、III以及A、B带均可观察到明显的特征峰,说明海蜇胶原蛋白具有典型的胶原蛋白红外光谱特征吸收峰。其中,酰胺A带位于3272.06 cm-1处,该峰与胶原蛋白中N-H的伸缩振动以及羰基形成的氢键相关[30]。通常,N-H伸缩振动范围为3400~3440 cm-1[30],但当其与肽链中含有的羰基形成的氢键结合时,其波数会蓝移至3300 cm-1左右[39]。由此可说明海蜇胶原蛋白中存在氢键。此外,在2920.18 cm-1处还观察到由CH2的不对称伸缩振动引起的酰胺B带[40]。
酰胺I、II和III带的伸缩振动与胶原蛋白的氨基酸序列及三螺旋结构直接相关[41-42]。海蜇胶原蛋白的酰胺I带位于1644.5 cm-1处,且吸收最强,该峰与肽链的C=O伸缩振动有关[43-44],说明海蜇胶原蛋白处于交联状态。由N-H弯曲振动与C-N伸缩振动相耦合引起的酰胺II带通常出现在1550~1600 cm-1之间[45-46],当肽链中有氢键存在时波数蓝移[47]。海蜇胶原蛋白的酰胺II带位于1548.08 cm-1处,进一步证明了其肽链中存在氢键。特征频率在1200~1320 cm-1之间,称为酰胺III带[48],主要与酰胺键的C-N伸缩振动和N-H弯曲振动,以及Gly主链和Pro侧链的CH2的摇摆振动有关[22]。有研究称,当酰胺III带的峰值与1400~1454 cm-1范围内的峰值比例为1.0时,胶原蛋白的三螺旋结构是完整的[49]。由图知海蜇胶原蛋白酰胺III带的波数为1238.08 cm-1,其与1454 cm-1谱带之间的峰值比约为1.0,说明所提胶原蛋白具有较完整的三螺旋结构。
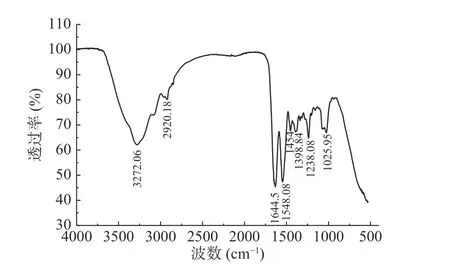
图3 海蜇胶原蛋白的红外吸收光谱图Fig.3 FTIR spectrogram of Rhopilema collagen
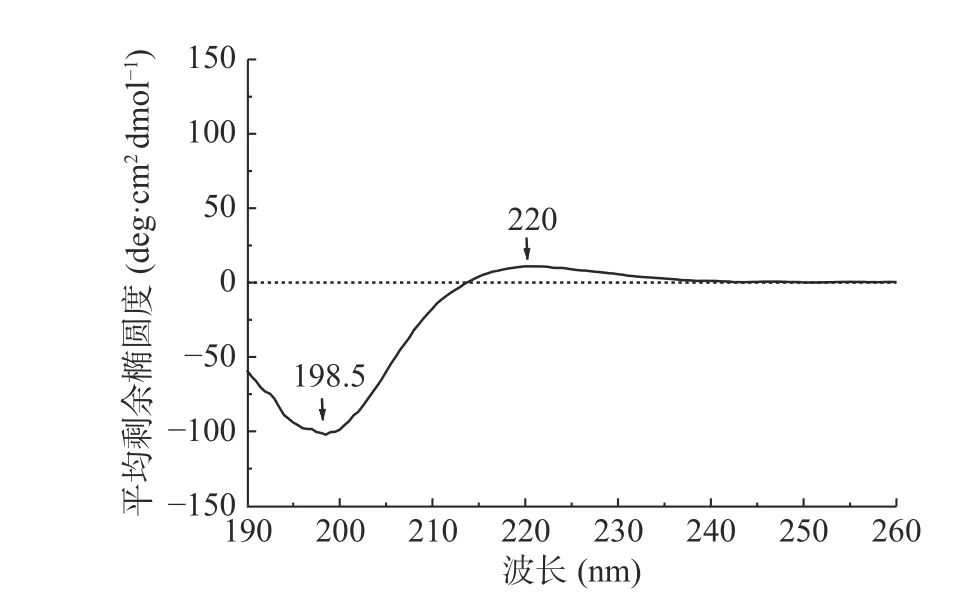
图4 海蜇胶原蛋白的远紫外圆二色谱图Fig.4 Far-UV CD spectra of Rhopilema collagen
2.6 圆二色谱分析
圆二色谱是一种利用生物大分子对左旋和右旋圆偏振光的吸收差异来进行立体结构分析的方法[50],根据电子跃迁能级能量的大小,蛋白质的CD谱可分为远紫外(190~250 nm)、近紫外(250~340 nm)和紫外-可见(400~700 nm)三个区域,远紫外区是肽键所在的吸收范围,对胶原蛋白在此范围内的谱带位置和吸收强弱进行分析,可较直观的反映肽链的立体结构信息[51]。因此,利用远紫外圆二色谱对海蜇胶原蛋白的二级结构进行深入分析,如图4示,海蜇胶原蛋白在198 nm附近出现明显的负吸收峰,在221 nm处有一较弱的正吸收峰,在213 nm处有一交叉点,这是左旋聚脯氨酸构型的典型CD特征,主要表现为β-折叠和无规则卷曲的叠加吸收。此外,圆二色谱的正负峰强度比称为RPN,RPN值是胶原三螺旋结构的特征性指标[52],非变性胶原的RPN值一般在0.12左右[53],观察到海蜇胶原蛋白的RPN值为0.11。以上光谱数据进一步说明了海蜇胶原蛋白保持了较完整的三螺旋结构,与红外吸收光谱分析结论一致。

图5 海蜇胶原蛋白的外观(A)和扫描电镜图(B~F)Fig.5 Rhopilema collagen (A) as viewed in naked eye, and (B~F) SEM micrograph
2.7 微观结构分析
胶原蛋白的微观结构对其生物学功能有着关键性的影响。由图5可知,冻干的海蜇胶原蛋白在肉眼下呈白色海绵状固体,表面有均匀孔隙,触之弹性较好。由SEM图像,观察到海蜇胶原蛋白具有多层聚集、以纤维为主的无规则网状结构。在更高的放大倍数下,发现该结构由相互缠绕的细丝和薄片构成,且表面光滑细腻、疏松多孔,与Arumugam等[54]观察到的龙利鱼胶原蛋白的微观结构相似,说明海蜇胶原蛋白保留了较完整的纤维结构,排布比较疏松,可作为伤口敷料、止血剂或细胞增殖的基质等广泛应用于生物医学工程。
3 结论
采用盐酸-胃蛋白酶法对海蜇胶原蛋白进行制备并分析了其结构特性。氨基酸组成分析表明海蜇胶原蛋白中甘氨酸含量最高,为25.99%,亚氨基酸含量为15.94%,未检测到半胱氨酸和色氨基酸;紫外光谱和SDS-PAGE表明,所提取的海蜇胶原蛋白纯度较高,亚基结构为[a1(I)]3,符合I型胶原蛋白结构特征;傅里叶变换红外光谱和圆二色谱说明海蜇胶原蛋白具有较为完整的三螺旋结构;扫描电镜结果显示其保留了较完整的纤维结构,且疏松多孔,可作为良好的药物载体。海蜇胶原蛋白具备替代陆生哺乳动物胶原蛋白的潜力,在食品、化妆品、生物医药及组织工程等领域有广阔的应用前景。
