残余肿瘤负荷系统评估乳腺癌新辅助治疗疗效的实践问题
2021-06-17可雪璇于佳秀曾祥菲卫亚妮
可雪璇,于佳秀,曾祥菲,卫亚妮,2,步 宏,2,魏 兵
随着乳腺癌新辅助药物试验不断进展以及临床实践中新辅助治疗的广泛应用,新辅助治疗的规范化病理评估备受关注。2020年发布《乳腺癌新辅助治疗的病理诊断专家共识》,旨在推动规范化的新辅助治疗病理评估[1]。鉴于新辅助治疗后仍有较多乳腺癌患者不能达到病理学完全缓解(pathologic complete response, pCR),采用美国癌症联合会(AJCC)ypTNM分期和残余肿瘤负荷(residual cancer burden, RCB)系统分层评估不同程度残余肿瘤成为病理精准诊断的重要内容[1-5]。
2007年M.D.Anderson癌症中心的Symmans等[6]建立RCB系统用于评估新辅助治疗后乳腺癌患者的治疗反应和复发风险。随后研究验证RCB系统的有效性、可重复性,适用于不同亚型乳腺癌治疗后的病理评估[7-11]。国际乳腺协作组推荐将RCB系统作为临床试验中评估新辅助治疗疗效的优选病理方案[2]。尽管国内已有文献介绍RCB评估系统[12],但临床工作中常规使用该系统的单位较少[13],如何处理实践中遇到的具体问题值得深入学习。本文对RCB评估系统的细节问题进行总结和综述,旨在促进该系统的规范运用。
1 系统取材法是RCB评估的基石
RCB系统需要获得乳腺原发灶残余肿瘤范围(mm×mm)、残余肿瘤的细胞密度(%)、原位癌所占比例(%)、阳性淋巴结枚数和淋巴结残余转移癌的最大径(mm),将其输入网络计算器(www.mdanderson.org/breastcancer_RCB)计算RCB指数。再根据1.36和3.28两个截断值,将患者划分为四种不同的RCB分级:RCB-0/pCR;RCB-Ⅰ/肿瘤少量残余;RCB-Ⅱ/中等量残余;RCB-Ⅲ/广泛残余。RCB-0和RCB-Ⅰ患者预后较好,复发风险低[6]。
目前,国内病理科乳腺癌标本取材的最大问题是欠缺规范化和标准化。由于缺乏取材标准操作程序、肿瘤无金属标志物定位、病理收费限制等,新辅助治疗后标本取材不足或过度取材仍较为普遍。准确报告RCB评分需要对治疗后标本进行系统取材[2,5]:(1)结合临床和影像学明确治疗前肿瘤所在的具体位置,如果治疗后瘤床难以识别且临床未能提供金属标志物定位,病理医师的首要任务是根据治疗前相关信息确定瘤床所在象限,以便后续对其进行相对集中的组织取材,而非根据常规思路剖开标本寻找可能的肿瘤质硬区。(2)根据不同间距均匀切分乳腺癌标本,全乳标本和保乳标本切开间距分别为5~10 mm、3~5 mm;取材前需要对剖开的标本切面进行照相或绘图。(3)若瘤床肉眼可见,则将瘤床的最大截面全部取材(含瘤床邻近组织),体积过大的肿瘤选取最大截面5块代表性组织镜检;若瘤床不能肉眼识别,则根据治疗前肿瘤所在部位,每1 cm间距将瘤床截面全部取材,体积过大者间距1~2 cm选取每个截面中5块代表性组织镜检(图1)。取材数量一般不超过25块组织[2],必要时可补充取材。(4)取材结束后需在大体标本的照相或绘图图片上标注每个蜡块位置,以便重建残余肿瘤范围(图2)。(5)为了便于识别相邻蜡块/组织块相互的空间位置,可对组织块的边缘涂墨标记(图3),其有助于精细评估镜下肿瘤范围。(6)RCB系统要求以2 mm间距平行切分淋巴结,并将组织全部送镜检[2],如肉眼发现可识别的淋巴结转移灶,可选取包含转移灶最大面的代表性组织送检[5]。此外,最大径<5 cm或<30 g的切除标本可考虑全部取材送镜检。新辅助治疗前即存在的多灶/多中心肿瘤均分别按上述方法处理,同时需取材评估病灶间组织。RCB的取材方法可以满足报告新辅助治疗后乳腺癌的ypTNM分期。

图1 乳腺癌标本1~5号切片组织中,第3号含瘤床的最大截面:将该截面的瘤床及其邻近组织全部取材评估;镜下残余癌细胞(红点)的分布范围超出肉眼可识别的瘤床范围(不规则星标)

图2 乳腺癌标本均匀切分,对标本切面照相并标注取材蜡块位置,方框内为蜡块编号
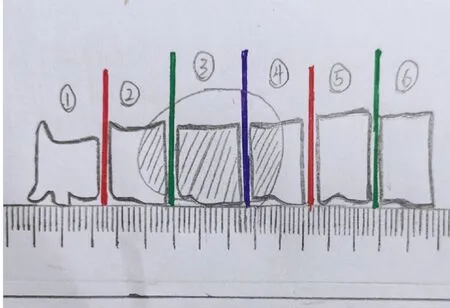
图3 对瘤床相邻的1~6号组织块进行边缘涂墨(多色或单色),标记组织的相互位置
2 残余肿瘤大小的测量
无论采用何种新辅助疗效评估体系,治疗后残余肿瘤大小的测量均需要以肿瘤/瘤床的大体测量为基础,通过镜下评估进行确认和校正[1],避免仅依靠大体测量而导致不同程度的误差。新辅助治疗后无论乳腺肿瘤组织是否出现退缩,RCB系统对原发肿瘤/瘤床的测量可以划分为以下三种类型:(1)肿瘤退缩后仅见于一张HE切片,残余肿瘤无论为单病灶还是多病灶,均测量肿瘤的最大范围(特指残余浸润癌灶整体的最大双径)。测量的一条径线为病灶整体的最大径,另一径线与之垂直(图4)。值得注意的是,残余癌灶之间的纤维化区域在测量范围内,而癌灶整体以外的纤维化瘤床区域不属于测量范围。(2)残余肿瘤见于多张HE切片但相对集中,将每张切片中的残余肿瘤范围打点标注,然后根据各切片空间位置拼接残余肿瘤并测量大小(图5)。(3)残余肿瘤范围广,见于多张HE切片。此时精确测量较为困难。可根据每张切片中残余病灶大小,结合组织块大小、大标本组织片切开厚度等对残余肿瘤的整体大小进行估算(图6)。同时,可参考常规乳腺癌前哨淋巴结(sentinel lymph node, SLN)活检,完成RCB系统对治疗后淋巴结残余癌最大径的测量。淋巴结转移灶中治疗相关纤维化区域是否纳入测量可参考乳腺原发灶。另一方面,残余肿瘤大小的测量可能受各种因素制约和影响,导致测量精准度降低。有学者指出对于等级变量的RCB分级,测量的准度在一定范围内对结果影响不大,过于追求细节并不能为临床提供更多信息,甚至导致诊断困难。
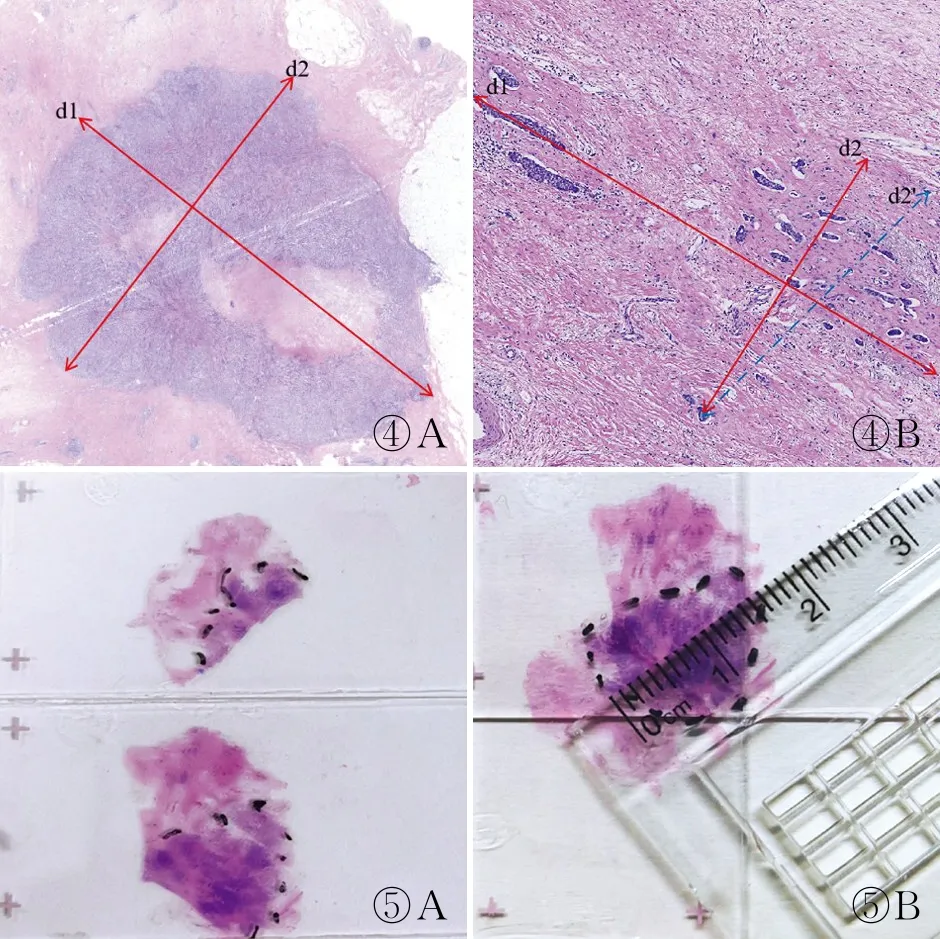
图4 测量单张HE切片中残余肿瘤的最大范围(双径):残余肿瘤可为向心性退缩(A)或散在病灶(B),当残余肿瘤分布不规则时,测量相互垂直的径线d1和d2 图5 A.打点标注两张HE切片的残余肿瘤;B.将两张切片拼接后测量残余肿瘤大小
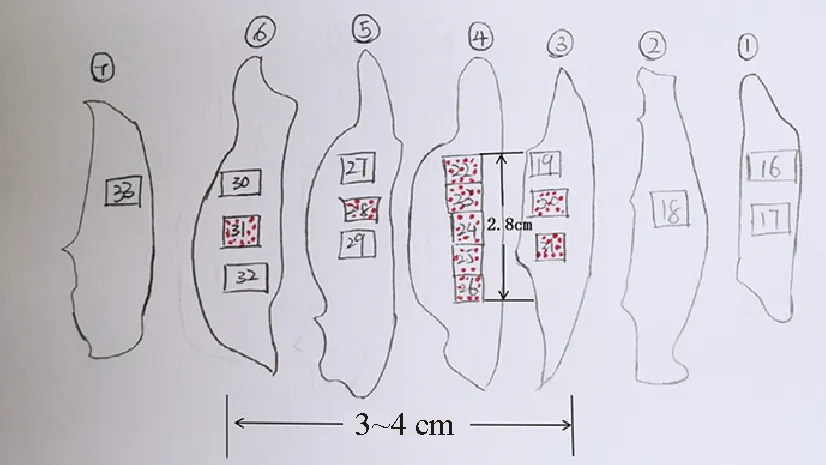
图6 残余肿瘤范围较广时的测量:残余肿瘤(红点)在4号组织中的上下径线为2.8 cm,左右径线跨越3~6号组织,为3~4 cm,组织切片厚度为1 cm,方框内为蜡块编号
RCB评估中可能遇到以下特殊情况。某些患者在完成新辅助治疗后仍未达到手术条件或出现疾病进展而不能手术,无法评估RCB分级。此时,患者可以归入RCB-III/广泛残余。在充分取材和多层面组织学评估的基础上,如果瘤床仅见黏液湖而缺乏残余癌细胞,有学者将其视作pCR[5],而不是将黏液湖作为残余癌进行测量。新辅助治疗后坏死灶中形态学尚可识别的肿瘤细胞是否彻底失活缺乏精细的界定,是否对其进行测量需慎重。
3 残余肿瘤的细胞密度
新辅助治疗后乳腺肿瘤的退缩存在不同程度的异质性,RCB评分通过系统取材和评估不同区域肿瘤残余密度的平均值来避免其影响[2,5]。残余肿瘤细胞密度评估需要注意的事项:(1)将残余肿瘤瘤床的最大截面送检评估是最有效的方法。(2)不同残留水平的肿瘤区域(包括无肿瘤细胞区)均需纳入平均值计算,避免仅评估残余细胞丰富区域。(3)根据RCB系统的设定,残余肿瘤包括浸润性癌和原位癌两种成分。(4)录入RCB系统的细胞密度逐级递增,包括:0、1%、5%、10%、20%、30%、40%、50%、60%、70%、80%、90%、95%、100%。如在7个区域残余肿瘤的细胞密度分别为40%、1%、10%、5%、10%、70%、30%,则整体平均的细胞密度约为25%。(5)M.D.Anderson癌症中心的RCB评估体系网页版提供残余细胞密度为1%~95%的示意图,有助于病理医师直观地仿照评估不同程度的细胞密度。(6)新辅助治疗后残余肿瘤密度极低时,残余肿瘤的大小和细胞密度值均可如实录入。如原发灶瘤床查见距离2 cm、直径均为0.1 mm的两个残余浸润灶,则瘤床大小为20 mm×0.1 mm,整体的癌细胞密度为0.01%。(7)对于多中心肿瘤,RCB分级取决于最大残余肿瘤的测量。某些情况下计算体积较小肿瘤的RCB评分可能有价值,如较小肿瘤的细胞密度更高,可能得出更高的RCB评分;或者较小肿瘤属于更具侵袭性的乳腺癌亚型。不同病理医师在判定残余肿瘤细胞密度时有主观性和差异性,但不会显著影响RCB评分和级别[4-5]。
4 残余肿瘤中原位癌的比例
RCB系统中的原位癌包括导管原位癌和小叶原位癌,临床中多为导管原位癌。与细胞密度类似,原位癌所占残余肿瘤的比例亦逐级递增:0、1%、5%、10%、20%、30%、40%、50%、60%、70%、80%、90%、100%。参考目前对新辅助治疗后pCR(ypT0/Tis ypN0)的基本共识,RCB系统将残余肿瘤中的原位癌成分校正去除较为合理。当乳腺癌患者新辅助治疗后的瘤床仅残余原位癌(原位癌占100%)且区域淋巴结阴性时,RCB评分为0,与AJCC分期中的pCR相同。部分病例中,先评估所有残余癌的细胞密度,再去除原位癌所占比例是更简便易行的算法。然而,在评估某些病例的残余癌细胞密度时,可仅仅纳入浸润性癌的成分,原位癌的比例直接赋值为0[5]。此外,不能将残余肿瘤中原位癌的比例误解为原位癌占肿瘤瘤床的比例。
5 区域淋巴结评估
AJCC(第8版)乳腺癌分期中,新辅助治疗后淋巴结内残余孤立肿瘤细胞(isolated tumor cell, ITC)记录为ypN0(i+)[14],其可能低估了治疗后淋巴结的残余癌负荷。与AJCC不同,RCB系统将新辅助治疗后残余ITC的淋巴结个数记录入阳性淋巴结数目[5]。当淋巴结残余癌灶的最大径小于1 mm时,可将其实际大小录入网络计算器进行计算(如输入0.1 mm或0.04 mm)。此外,尽管阳性内乳淋巴结在RCB系统中的预后价值并无报道,但Symmans等认为应将有癌残余的内乳淋巴结和乳内淋巴结记录入阳性淋巴结数目。新辅助治疗前,有患者行SLN活检,如果SLN均为阴性,则不会影响患者治疗后的RCB评估;如果新辅助治疗前将阳性SLN切除,治疗后则无法准确进行RCB评估[2],此时仅能对治疗后可能的RCB分级进行推算[5]。
6 残余脉管内肿瘤/淋巴血管侵犯
有文献报道[15-16]新辅助治疗后仅残余乳腺脉管内肿瘤或以脉管内肿瘤残余为主,与患者预后不良相关。Guilbert等[17]未能证实上述结果。导致不一致的原因:不同文献报道病例的时间跨度大且病例量均较小、残余肿瘤的生物学标志物表达有差异、区域淋巴结状态有异质性、不同程度纳入炎性乳腺癌病例等。如果新辅助治疗后乳腺仅残余脉管内肿瘤/淋巴血管侵犯(lymphovascular invasion, LVI),有学者建议将LVI累及的乳腺范围(双径)作为残余原发肿瘤的大小,将LVI的细胞密度作为残余浸润肿瘤的细胞密度,用以计算RCB分级[5,17]。然而,Baker等[4]认为在缺乏充分的研究证据时,将LVI的范围和细胞密度用于计算RCB评分并不合适。
7 RCB系统与AJCC的ypTNM分期比较
AJCC的ypTNM分期根据不同的ypT、N和M组合,将新辅助治疗后的乳腺癌归为0~Ⅳ期[14],亦可有效地评估新辅助治疗效果和患者预后[18]。作为分期体系,ypTNM的使用更为广泛。RCB系统与ypTNM分期在评估方法和细节上的差异,易导致病理医师在评估中产生混淆。RCB与ypTNM最主要的差异是残余癌灶大小的测量方法。RCB评分测量乳腺原发灶残余肿瘤的最大范围(双径)和淋巴结残余癌的最大范围(单径),其优势在于不需要区分残余肿瘤为单病灶或是多病灶。ypTNM分期则是测量乳腺残余浸润癌最大病灶的最大径以及淋巴结残余转移癌最大病灶的最大径,其可能低估残余肿瘤的整体负荷,且缺乏区分残余单病灶还是多病灶的具体方法。Baker等[4]提出建议:如果不连续的分离病灶之间的距离超过其中最大病灶的最大径,则将上述分离病灶作为多病灶处理,反之则作为单一病灶统一测量。以上方法具有主观性,但可以作为一般原则加以参考。此外,RCB评分比ypTNM分期更便捷的是不需要考虑肿瘤累及的范围(如胸壁、皮肤)、阳性淋巴结的解剖学部位、远处转移灶等。同一患者使用上述两种评估系统可能得出不同的预后级别,有研究建议以更高风险为准[18]。
8 RCB系统的优化
目前,RCB系统已经成为公认的乳腺癌新辅助治疗疗效评估体系。Sheri等[19]将RCB评分与Ki-67增殖指数结合形成“残余增殖肿瘤负荷”(residual proliferation cancer burden, RPCB)系统。相对于单一的RCB分级或Ki-67增殖指数,RPCB评分提供更为丰富的预后评价信息,预测效能更高。近期有研究将肿瘤浸润淋巴细胞(tumor infiltrating lymphocytes, TIL)与RCB评分联合用于评估乳腺癌新辅助治疗效果[20-21],特别是三阴型乳腺癌患者。
随着乳腺癌新辅助治疗患者的日益增多以及临床对新辅助病理评估提出更高的要求,RCB评估系统在国内将被更多地使用。影响新辅助治疗后RCB分级准确性的最主要因素是评估规范化,包括符合要求的大标本取材、标记蜡块位置、残余癌灶5项病理指标的获取以及病理医师的相关培训。2020年《乳腺癌新辅助治疗的病理诊断专家共识》将RCB评分作为常用的新辅助病理评估系统加以介绍[1],进一步推动了该系统在实际工作中的运用。
