胃贲门腺癌中长链非编码RNA FOXD3-AS1的表达及其对肿瘤生物学行为的影响
2021-06-17王欣晨牛云峰郭艳丽董稚明
杨 阳,王欣晨,牛云峰,郭 炜,梁 佳,郭艳丽,董稚明
胃贲门腺癌(gastric cardia adenocarcinoma, GCA)属于胃癌的特殊类型[1],大部分GCA患者发现时已为进展期或晚期,易转移和复发,5年生存率低[2]。长链非编码RNA(LncRNA)是近年肿瘤领域的研究热点,大量文献报道其能够在肿瘤发生、发展的各阶段发挥促癌或抑癌作用。研究发现,LncRNA FOXD3-AS1在结直肠癌、肝癌、甲状腺癌中高表达,发挥促癌作用,但尚未见其在GCA中的报道。本文着重探讨FOXD3-AS1在GCA中的表达及其对肿瘤生物学行为的影响,为GCA的诊断、预后评估和靶向治疗提供参考。
1 材料与方法
1.1 材料收集2014年6月~2016年12月河北医科大学第四医院收治的53例GCA患者的手术标本,男性47例,女性6例,中位年龄63岁(范围49~83岁)。一部分手术切除标本保存于-80 ℃液氮中便于提取RNA,另一部分标本HE染色后经病理医师诊断均为GCA。本实验经河北医科大学第四医院伦理委员会批准,患者均知情同意。
1.2 试剂反转录试剂盒、转染试剂Lipofectamine 2000和MTS试剂,均购自美国Promega公司;胰蛋白酶、TRIzol、RIPA裂解液、10×电转液、SDS-PAGE电泳液(10×)和5×蛋白上样缓冲液,均购自北京索莱宝公司。实验引物购自上海生工生物公司;实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction, qRT-PCR)仪购自美国ABI公司。胃癌细胞系BGC-823、SGC-7901、HGC-27、MGC-803,由河北医科大学第四医院肿瘤研究所病理研究室留存并传代。实验样本均来自河北医科大学第四医院生物标本库。
1.3 方法
1.3.1qRT-PCR 收集53例GCA组织,加入TRIzol裂解液后匀浆器充分研磨;胃癌细胞用PBS冲洗,加入TRIzol充分悬浮后移入EP管,根据试剂盒说明书提取组织及4株细胞(BGC-823、SGC-7901、HGC-27、MGC-803)中的总RNA。siRNA转染SGC-7901细胞72 h后,用PBS冲洗,加入TRIzol充分悬浮后移入EP管,根据试剂盒说明书提取空白对照组、si-FOXD3-AS1转染组及si-NC转染组细胞的总RNA。按反转录试剂盒操作流程,将总RNA反转录成cDNA后进行荧光定量PCR扩增,以β-actin作为表达的内参。引物序列详见表1。

表1 qRT-PCR引物序列、退火温度及产物长度
1.3.2siRNA转染细胞 根据上述实验选取FOXD3-AS1表达量最高的SGC-7901细胞进行后续实验,将SGC-7901细胞接种在6孔板(2×105个/孔)中,待细胞长至70%~80%融合时,参照Lipofectamine 2000试剂盒说明书进行转染,设置空白对照组、si-FOXD3-AS1转染组及si-NC转染组。收集SGC-7901细胞并提取总RNA,用于观察细胞转染siRNA后FOXD3-AS1的表达。
1.3.3MTS实验和克隆形成实验 MTS实验:转染后的SGC-7901细胞继续常规培养24 h,胰酶消化计数后接种于96孔板(1×103个/孔),每组6个复孔,待细胞贴壁后分别于0、24、48、72和96 h每孔加入MTS试剂(500 μg/mL),继续37 ℃ 5%CO2培养箱中孵育2 h,最后用酶标仪检测每孔的吸光度值。克隆形成实验:转染后的SGC-7901细胞继续常规培养24 h,胰酶消化计数后将5×103个细胞均匀接种于6孔板中,37 ℃恒温培养箱中孵育1周后取出,固定染色后计算克隆形成率。
1.3.4划痕愈合实验和Transwell侵袭实验 划痕愈合实验:转染后的SGC-7901细胞继续常规培养24 h,胰酶消化计数后将5×105个细胞均匀接种于6孔板中,孵育24 h后,用200 μL枪头垂直划痕形成每孔的人工刮擦,换成RPMI 1640培养液继续培养,在划痕后0、12和24 h测量划痕宽度并计算细胞迁移率。Transwell侵袭实验,转染后的SGC-7901细胞继续常规培养24 h,胰酶消化计数后用RPMI 1640培养液重悬细胞,在小室上室中加入50 μL Matrigel,37 ℃过夜,将1×105个细胞接种至小室上室,小室下室加入含牛血清培养基,37 ℃恒温孵育箱继续培养24 h,取出小室将细胞固定后染色20 min,最后进行细胞计数,比较组间差异。
1.3.5Western blot法 按照蛋白提取试剂盒操作流程,使用含有蛋白酶抑制剂以及磷酸酶抑制剂的RIPA裂解液对细胞进行裂解,提取细胞总蛋白。根据BCA蛋白定量试剂盒说明书进行操作,定量总蛋白的浓度,分别取50 μg蛋白样本,通过SDS-PAGE分离蛋白质,以80 V为起始电压进行电泳,30 min后以120 V电泳1 h,应用转膜技术将分离后的蛋白转移至PVDF膜,5%脱脂奶粉溶液封闭1 h,加一抗(兔单克隆抗体E-cadherin、N-cadherin、vimentin、β-catenin及β-actin)4 ℃摇床过夜,次日TBST缓冲液冲洗3次,每次10 min;加二抗后室温孵育1 h,TBST缓冲液漂洗3次,每次10 min。电化学发光液显色后拍照,凝胶成像分析仪采集图片。
2 结果
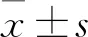
2.1 GCA中FOXD3-AS1表达与临床病理特征的关系qRT-PCR检测结果显示,FOXD3-AS1在GCA组织中的表达量为2.160(0.928,3.406),高于癌旁正常组织的0.734(0.320,1.836),差异有统计学意义(Z=-2.695,P=0.007,图1)。本组结果亦显示,Ⅲ+Ⅳ期GCA组织中FOXD3-AS1的表达明显高于Ⅰ+Ⅱ期(P<0.01);有淋巴结转移的GCA组中FOXD3-AS1表达水平明显高于无淋巴结转移组(P<0.01);FOXD3-AS1的表达与患者年龄、性别、分化程度均无相关性(P均>0.05,表2)。

表2 GCA中FOXD3-AS1表达与临床病理特征的关系

图1 qRT-PCR法检测FOXD3-AS1在GCA及正常组织中的表达
2.2 胃癌细胞系FOXD3-AS1的表达与si-FOXD3-AS1敲低的关系随机选取10例贲门正常黏膜组织的cDNA,按等比例混合后作为正常对照细胞。FOXD3-AS1在4株癌细胞系中的表达:SGC-7901(4.369±0.293)、MGC-803(1.281±0.048)、BGC-823(2.143±0.431)、HGC-27(2.908±0.505),高于正常对照细胞(1.074±0.160),差异有统计学意义(F=48.694,P<0.01,图2)。SGC-7901细胞中FOXD3-AS1表达量最高,选取其构建FOXD3-AS1敲低细胞株。qRT-PCR结果显示,SGC-7901细胞转染si-FOXD3-AS1后,FOXD3-AS1的表达量(0.667±0.020)低于si-NC转染组(0.967±0.073)、空白对照组(1.013±0.044),差异有统计学意义(F=17.425,P=0.003)。

图2 qRT-PCR法检测FOXD3-AS1在不同胃癌细胞中的表达
2.3 敲低FOXD3-AS1对SGC-7901细胞增殖能力的影响MTS结果显示,从72 h开始si-FOXD3-AS1转染组细胞增殖能力明显低于si-NC转染组及空白对照组,分别为0.702±0.036、1.162±0.074和1.324±0.049,差异有统计学意义(P<0.05,图3A)。空白对照组与si-NC转染组相比,差异无统计学意义(P>0.05)。克隆形成实验结果显示,si-FOXD3-AS1转染组细胞克隆形成率(5.053%±0.221%)低于si-NC转染组(8.453%±0.232%)和空白对照组(8.187%±0.280%),差异有统计学意义(P<0.05,图3B)。空白对照组与si-NC转染组相比,差异无统计学意义(P>0.05),提示敲低FOXD3-AS1可以抑制细胞的增殖能力。

图3 A.MTS法检测FOXD3-AS1对SGC-7901细胞增殖能力的影响;B.克隆形成实验检测FOXD3-AS1对SGC-7901细胞增殖能力的影响
2.4 敲低FOXD3-AS1对SGC-7901细胞迁移能力的影响划痕实验结果显示,si-FOXD3-AS1转染组细胞的12 h迁移率(4.761%±1.886%)低于si-NC转染组(9.659%±2.339%)和空白对照组(9.564%±3.297%),差异有统计学意义(P<0.05)。空白对照组与si-NC转染组相比,差异无统计学意义(P>0.05)。si-FOXD3-AS1转染组细胞的24 h迁移率(6.761%±1.886%)低于si-NC转染组(18.959%±2.339%)和空白对照组(21.264%±3.297%),差异有统计学意义(P<0.01,图4)。空白对照组与si-NC转染组相比,差异无统计学意义(P>0.05),提示敲低FOXD3-AS1后可以抑制SGC-7901细胞体外迁移。

图4 细胞划痕实验检测FOXD3-AS1对SGC-7901细胞迁移能力的影响
2.5 敲低FOXD3-AS1对SGC-7901细胞侵袭能力的影响Transwell小室实验结果显示,si-FOXD3-AS1转染组每个视野下穿膜细胞数(276.200±24.118)低于si-NC转染组(373.6±24.162)和空白对照组(371.8±26.329),差异有统计学意义(P<0.05,图5)。空白对照组与si-NC转染组相比,差异无统计学意义(P>0.05),提示敲低FOXD3-AS1后可以抑制SGC-7901细胞侵袭能力。

图5 Transwell小室实验检测FOXD3-AS1对SGC-7901细胞迁移能力的影响:A.空白对照组;B.si-NC转染组;C.si-FOXD3-AS1转染组
2.6 敲低FOXD3-AS1对SGC-7901细胞中上皮-间质转化(epithelial-mesenchymal transition, EMT)标志因子mRNA和蛋白表达的影响qRT-PCR实验结果显示,si-FOXD3-AS1转染组中E-cadherin mRNA表达量为5.20±0.36,明显高于空白对照组(1.02±0.08)和si-NC转染组(0.97±0.10),差异有统计学意义(P<0.05)。空白对照组与si-NC转染组中的E-cadherin mRNA的表达量,差异无统计学意义(P>0.05)。si-FOXD3-AS1转染组中N-cadherin、β-catenin和vimentin的mRNA表达量明显降低,差异有统计学意义(P<0.05)。空白对照组与si-NC转染组中的N-cadherin、β-catenin和vimentin的mRNA表达量,差异无统计学意义(P>0.05,图6A)。Western blot实验结果表明,与空白对照组和si-NC转染组相比,si-FOXD3-AS1转染组E-cadherin的蛋白表达水平升高,N-cadherin、vimentin和β-catenin的蛋白表达水平下降,与mRNA的表达趋势一致(图6B)。

图6 A.qRT-PCR法检测FOXD3-AS1对EMT相关分子mRNA表达的影响;B.Western blot法检测FOXD3-AS1对EMT相关分子蛋白表达的影响
3 讨论
胃癌位居消化道恶性肿瘤之首,每年有大量的新发和死亡病例。临床数据显示,早期胃癌患者5年生存率超过90%,中晚期胃癌患者即便经过综合治疗,5年生存率仍低于30%[3]。LncRNA本身不编码蛋白或只编码较小的多肽,因缺少完整的开放阅读框,这些非编码转录本曾被认为是“转录噪音”。最新研究表明,LncRNA在乳腺癌[4]、结直肠癌[5]、乳腺癌[6]、胃癌[7]及卵巢癌[8]等肿瘤中的表达均有异常,参与肿瘤细胞转录、增殖和血管侵袭等过程,提示其可以作为肿瘤的预测因子。
LncRNA FOXD3-AS1由4个外显子组成,位于FOXD3启动子上游染色体1p31.3处[9]。Chip-seq数据分析显示,FOXD3-AS1与FOXD3共享启动子区域,提示FOXD3-AS1属于LncRNA中的启动子上游转录本[10]。研究表明,FOXD3与黑色素瘤[11]、肺癌[12]及结直肠癌[13]抑制相关。最新文献报道表明,FOXD3-AS1直接作用于miR-127-3p/ MDM2轴促进非小细胞肺癌的化学耐药性[14]。FOXD3-AS1在黑色素瘤细胞中明显上调,通过调节miR-127-3p/ FJX1轴促进黑色素瘤的进展[15]。Liu等[16]报道FOXD3-AS1在肝癌中高表达,且FOXD3-AS1水平高的肝细胞癌患者预后较差。此外,FOXD3-AS1的敲除可以与miR-335竞争性结合抑制RICTOR表达,从而通过AKT信号通路的失活抑制肝癌细胞的生长。Chen等[17]发现抑制LncRNA FOXD3-AS1可使miR-296-5p表达水平升高,同时使TGF-β1/ Smads信号通路失活,抑制甲状腺癌的侵袭性生物学行为。Wu等[18]发现FOXD3-AS1在结直肠癌中表达增加,对结直肠癌的发展有促进作用。本实验发现,FOXD3-AS1在GCA组织和胃癌细胞系中呈高表达,并与淋巴结转移和TNM分期相关。进一步构建si-FOXD3-AS1转染SGC-7901细胞系,应用MTS法、克隆形成实验、Transwell小室侵袭实验及划痕实验,验证FOXD3-AS1与SGC-7901细胞生物学特征的相关性。实验结果表明,FOXD3-AS1敲低会抑制SGC-7901细胞系的增殖、迁移和侵袭能力。
EMT是指在特定条件下,极性上皮细胞向间充质细胞表型转变,获得侵袭和迁移能力的过程,该过程中E-cadherin表达量降低,而vimentin、β-catenin、N-cadherin表达增加。研究表明,某些LncRNA可以通过影响EMT进程,在胃癌的发生、发展中发挥作用。Fu等[19]发现LINC00978在胃癌中的表达增加,抑制其表达的同时也抑制了胃癌细胞的EMT进程,LINC00978可以通过加速EMT进程,在胃癌中扮演癌基因的角色。LncRNA DANCR在胃癌组织和细胞中表达上调,转染si-DANCR后,胃癌细胞系BGC823和SGC7901的生长明显受到抑制,而过表达DANCR可以促进胃癌细胞增殖;基因敲低后,LncRNA DANCR可以通过抑制EMT进而抑制胃癌细胞的迁移和侵袭能力,但过表达则有相反的效果[20]。Fan等[21]发现与正常胃上皮细胞和癌旁细胞相比,LINC00261在胃癌中的表达明显下调,其过表达可以通过上调E-cadherin表达,下调N-cadherin、vimentin表达抑制EMT进程,从而发挥在胃癌细胞中的肿瘤抑制作用。目前,尚未有FOXD3-AS1对胃癌细胞EMT进程作用的报道。本组实验检测敲低FOXD3-AS1后EMT相关分子表达水平的改变,结果显示上皮标志物E-cadherin表达明显升高,而间质标志物N-cadherin、β-catenin及vimentin表达明显降低,提示FOXD3-AS1可以通过EMT调节胃癌细胞的迁移能力。
综上所述,FOXD3-AS1在GCA中呈高表达,敲低FOXD3-AS1可以抑制细胞增殖、迁移和侵袭能力。FOXD3-AS1可能通过调节相应micRNA在癌症中起调控作用,本课题组将进行后续实验分析FOXD3-AS1在GCA中高表达的机制,为临床治疗GCA提供新思路。
