原发性涎腺黏液表皮样癌临床病理特征及MAML2基因重排的意义
2021-06-17王方平夏红珍
吴 铃,王方平,张 敏,夏红珍,吴 景,何 杰
黏液表皮样癌(mucoepidermoid carcinoma, MEC)是涎腺最常见的恶性肿瘤,以儿童和年轻人最常见。最近研究表明,MEC一半以上存在t(11;19)(q21;p13)易位,该易位导致11号染色体Mastermind-like基因家族(MAML2)成员的第2~5号外显子断裂重排,并与19号染色体上的CRTC1外显子1产生融合(CRTC1-MAML2)[1-2]。约5%的MEC存在t(11;15)(q21;q26)易位和该易位导致的CRTC3-MAML2基因融合[2],在低级别或中级别MEC中该基因融合发生率高,而高级别MEC一般未见CRTC1/3-MAML2基因融合,少数病例可见EWSR1-POU5F1基因融合,且高级别MEC中存在多个基因失衡,导致频繁复发或转移,预后不良[1-5]。有研究发现,MEC患者发生MAML2基因重排的生存率明显高于未融合者[6-7]。MAML2基因重排的检测还有助于MEC和Warthin瘤、腺鳞癌、透明细胞癌等进行诊断、鉴别诊断。本文收集28例原发于涎腺的MEC,采用MAML2基因重排、免疫组化、特殊染色、HE染色等检测方法,分析MEC分子遗传学和临床病理特征,为诊断和鉴别诊断及临床生物学行为的判断提供依据。
1 材料与方法
1.1 材料收集2015年12月~2020年10月中国科学技术大学附属第一医院(安徽省立医院)临床病理中心及中国科学技术大学附属第一医院(安徽省肿瘤医院)病理科手术切除的28例MEC的临床病理资料。28例MEC患者男性10例,女性18例;均行肿瘤完整切除手术,其中12例术后行放疗,2例伴淋巴结转移;患者年龄14~76岁,中位年龄50岁。发生于腮腺部位者13例,非腮腺部位者15例。按照AJCC第八版涎腺恶性肿瘤分期标准对原发性涎腺MEC患者进行临床分期:Ⅰ~Ⅱ期 24例(86%),Ⅲ~Ⅳ期4例(14%)。
1.2 方法标本均经10%中性福尔马林固定,常规脱水、石蜡包埋,4 μm厚连续切片,行免疫组化EnVision两步法染色。一抗CK7、p63、CK5/6、S-100、CD117和Ki-67,均为即用型抗体(北京中杉金桥公司)。在Ventana XT(罗氏公司)全自动免疫组化仪中进行操作,二抗及DAB显色系统为仪器自带封闭配套试剂。特殊染色AB/PAS试剂盒购自珠海贝索生物公司,具体操作步骤严格按试剂盒说明书进行。MAML2基因断裂探针试剂盒购自武汉康录生物公司;显微镜下确认肿瘤细胞,根据MAML2双色断裂探针试剂盒说明书进行荧光原位杂交(fluorescence in situ hybridization, FISH)检测。
1.3 病理分级根据WHO(2006)头颈部肿瘤推荐的病理评分[8]标准对病例进行组织学分级:囊性成分少于20%为2分;伴神经侵犯为2分;伴坏死为3分;核分裂象≥4个/10 HPF为3分;退行性发育为4分。总分:0~4分为低级别,5~6分为中级别,≥7分为高级别。
1.4 结果判断
1.4.1免疫组化判断标准 肿瘤细胞标记呈棕黄色为阳性,其中CK5/6、CK7、CD117、S-100阳性定位于细胞质,p63和Ki-67阳性定位于细胞核。高倍镜下随机选取10个视野,按阳性细胞着色程度及所占百分比进行结果判定。(1)按阳性细胞着色计分:不着色为0分,弱着色或淡黄色为1分,中等着色或棕黄色为2分,强着色或棕褐色为3分。(2)按阳性细胞百分比计分:阳性细胞<25%为1分,25%~50%为2分,51%~75%为3分,>75%为4分。两项得分相加:0~4分为阴性,>4分为阳性。特殊染色AB/PAS的判读标准:肿瘤细胞胞质染色呈蓝色及红色均为阳性。
1.4.2FISH判断标准 在1 000×油镜下计数肿瘤细胞核内荧光信号,正常细胞为绿色和红色融合呈黄色,MAML2断裂分离的细胞呈红色信号与绿色信号分离,或者单独出现红色信号。每例至少计数100个肿瘤细胞核中的信号,红、绿信号分离超过2个信号长度为异常信号,当异常信号的细胞数>20%则判读为阳性。
1.5 统计学分析实验数据采用SPSS 20.0软件进行统计学分析,计数资料比较采用Pearson χ2检验和Fisher精确概率法。以P<0.05为差异有统计学意义。
2 结果
2.1 眼观肿瘤多为实性不规则结节,直径0.5~8.0 cm,肿瘤切面呈灰白色、灰褐色,质地较软,常伴囊性变,囊内含黏稠的胶冻样物。
2.2 镜检MEC是由黏液细胞、中间型细胞和表皮样细胞构成,并以不同比例混合,可见3种肿瘤细胞之间相互移行过渡。本组结果显示:17例为低级别MEC,表皮样细胞分化较好,中间型细胞偏少,黏液细胞较常见(图1),核分裂象、坏死较少见。其中有1例为Warthin瘤样变异型,与Warthin瘤相似,镜下见肿瘤由多个腺样乳头状结构构成,内层为柱状嗜酸性细胞,部分区域可由多层上皮构成,周围环绕具有生发中心的淋巴样组织,可见散在分布的黏液细胞(图2);5例为中级别MEC,有1例为透明细胞变异型,肿瘤为胞质透明的多边形细胞,可见少量黏液细胞(图3);6例为高级别MEC表皮样细胞及中间型细胞较多见,黏液细胞少见,细胞中-重度异型,呈弥漫实性巢团状(图4),核分裂象、坏死易见,周围可见典型的低级别或中级别MEC区域。

图1 低级别MEC:表皮样细胞分化较好,中间型细胞偏少,黏液细胞较常见 图2 Warthin瘤样MEC:类似于Warthin瘤,内层为柱状嗜酸性细胞,周围环绕着具有生发中心的淋巴样组织,可见散在分布的黏液细胞 图3 透明细胞变异型MEC:胞质透明的多边形细胞,可见少量黏液细胞(箭头) 图4 高级别MEC可见少量黏液细胞(箭头),表皮样细胞及中间型细胞多见,呈弥漫实性巢、团状 图5 腔面内层上皮中CK7呈弥漫强阳性,EnVision两步法 图6 外围基底细胞p63呈阳性,EnVision两步法 图7 AB/PAS呈阳性,特殊染色 图8 MAML2基因重排阳性:出现红色与绿色信号的分离,FISH法 图9 MAML2基因重排阴性:红色与绿色信号融合呈黄色,FISH法
2.3 免疫组化及特殊染色上皮样细胞CK7(图5)、p63(图6)、CK5/6均阳性,S-100、CD117均阴性,Ki-67增殖指数低(27例为2%~10%,1例约60%)。28例MEC均可见AB/PAS阳性的黏液细胞(图7)。
2.4 FISH检测28例MEC中17例检测出MAML2基因重排(图8),11例检测阴性(图9),检出率为60.7%(17/28)。17例MAML2基因重排中有14例低级别、3例中级别MEC,其中包含Warthin瘤样变异型和透明细胞变异型。另外,3例低级别、2例中级别及6例高级别MEC中,均未检测出MAML2基因重排。
2.5 涎腺MEC中MAML2基因重排与临床病理特征的关系MAML2基因重排与肿瘤部位相关,以腮腺部位阳性率最高(46.4%,13/28),而非腮腺部位阳性率最低(21.4%,6/28),两者差异有显著性(P<0.05)。本组结果显示:MAML2基因重排与病理分级相关,级别越低MAML2基因重排阳性率越高,两者差异有显著性(P<0.05);MAML2基因重排与患者年龄、性别、肿瘤最大径、淋巴结转移及临床分期无相关性(P>0.05,表1)。
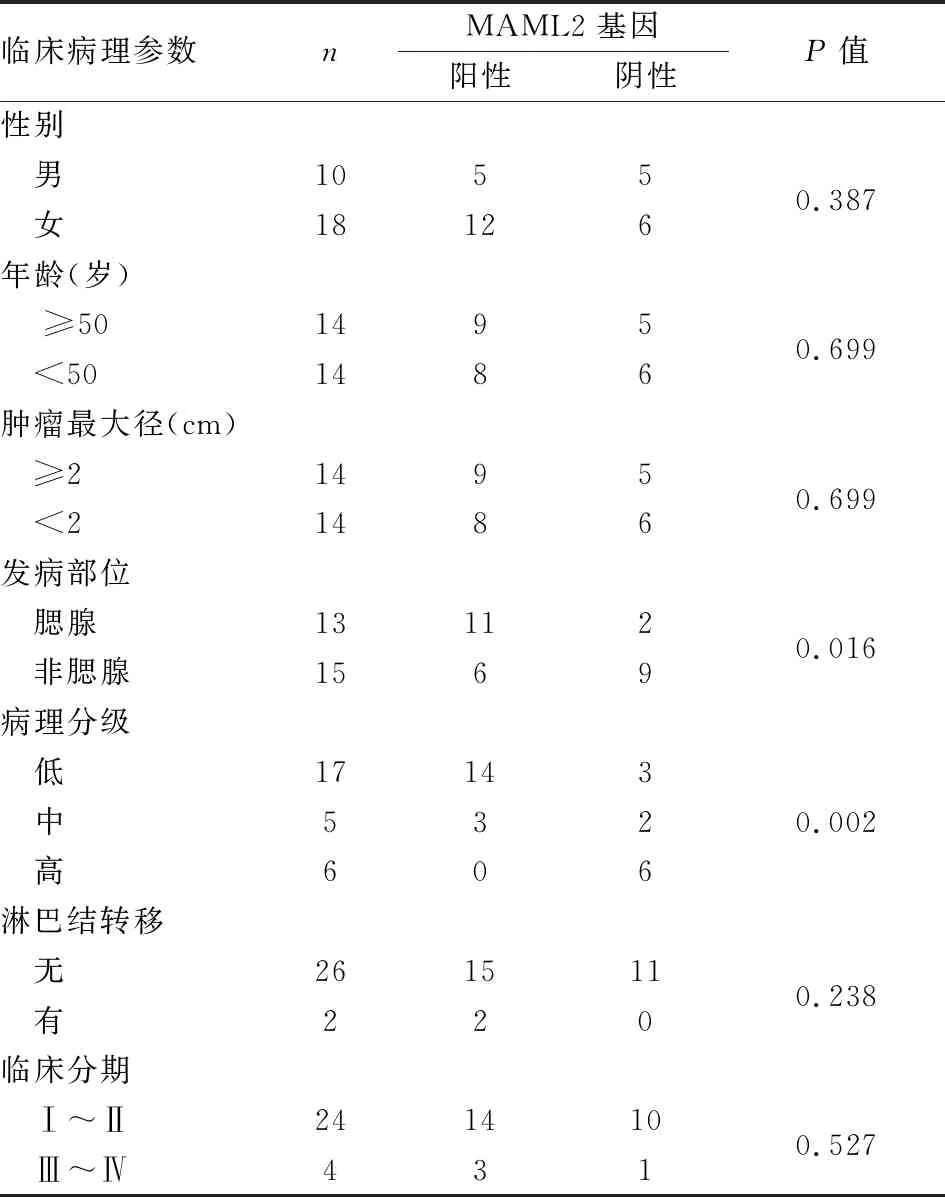
表1 涎腺MEC中MAML2基因重排与临床病理特征的关系
2.6 随访28例患者随访时间为2~60个月,有27例患者存活,包含1例术后复发,1例骨转移患者;1例患者因肿瘤转移死亡。存活的27例患者中16例检出MAML2基因重排,其中术后复发者也为阳性,11例阴性包括1例骨转移者。
3 讨论
3.1 临床病理特征MEC是儿童和年轻人最常见的原发性涎腺恶性肿瘤,患者平均发病年龄约45岁,肿瘤约一半发生在大涎腺(腮腺约占45%),少数肿瘤位于小涎腺或鼻腔等部位,口腔内最常见的发病部位是腭和颊黏膜。MEC常见的临床症状多表现为实性、固定的无痛性肿块,还可以出现面神经麻痹、感觉异常、吞咽困难等症状。
尽管大多数涎腺原发的MEC在组织学上可以直接做出诊断,但其罕见的变异易引起误、漏诊,Fujimaki等[9]首次检测CRTC1-MAML2融合基因,确诊了嗜酸细胞变异型MEC。新近研究发现[10-11],MEC还可出现纤毛变异型和Warthin瘤样变异型,FISH均检测出MAML2基因重排,而114例经典的Warthin瘤均未检测出MAML2基因重排。本组28例MEC中也发现1例Warthin瘤样组织学形态、MAML2基因重排,支持变异型MEC的诊断。本组还发现1例透明细胞变异型也检出MAML2基因重排,说明MAML2基因重排对MEC的诊断具有特异性。因此对于难以确诊的病例,行FISH检测MAML2基因重排有助于辅助诊断MEC的变异型。
目前大多数文献报道[1,4,7]MAML2基因重排在低级别MEC中发生率较高,概率为64.0%。本组MAML2基因重排在涎腺MEC的检出率为60.7%,MAML2基因重排与病理分级相关,级别越低MAML2基因重排阳性率越高。MAML2基因重排阳性与肿瘤部位相关,腮腺部位阳性率高,而非腮腺部位阳性率低。
3.2 分子遗传学特征染色体t(11;19)(q12;p13)易位重排是MEC特有的分子遗传学改变,该易位导致11号染色体上MAML2基因断裂重排,并与19号染色体上的CRTC1基因融合[1,12-13]。目前多数文献报道[1,4-7,9-12,14]通过FISH检测MAML2基因重排和实时荧光聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,qRT-PCR)法检测CRTC1/MAML2融合基因,两者的检测结果一致性较好[7,12]。MAML2基因重排阳性的MEC患者与阴性病例相比,表现出良好的临床病理特征:如患者年龄较轻、肿瘤较小,淋巴结转移频率、临床分期、组织学分级均较低,总生存期和无瘤生存期长[14]。
3.3 诊断及鉴别诊断大多数涎腺原发的MEC可以依据肿瘤的病理形态学特点和特征性的MAML2基因重排做出明确诊断,由于高级别MEC和一些罕见的变异型MEC与其他涎腺肿瘤在形态学上鉴别较困难,需与以下疾病进行鉴别。(1)腺鳞癌:分化程度较低,肿瘤细胞的异型性及多形性显著,核分裂象多见;MEC多数分化比较好,以表皮样细胞为主,其间可见少量黏液细胞,核分裂象一般少见。(2)非特异性透明细胞癌:特征是由单一的多边形细胞组成,且细胞质透明,一般无黏液细胞,肿瘤细胞PAS染色阳性,而AB染色阴性。文献报道透明细胞癌分子检测显示EWSR1-ATF1或EWSR1-CREM基因融合[15-16],而透明细胞变异型MEC可见少量黏液细胞,AB染色阳性,本组1例透明细胞变异型MEC中MAML2基因重排检测阳性。(3)Warthin瘤伴囊性变及黏液细胞化生:Warthin瘤内层的上皮常发生黏液化生,但无细胞学上的异型性或侵袭性生长模式。相反,Warthin瘤样MEC无典型Warthin瘤的双层上皮,肿瘤细胞与典型的Warthin瘤中高柱状嗜酸性细胞相比,其矮而少[10]。文献报道,典型的Warthin瘤双层结构中管腔面内层上皮表达CK7,外围基底细胞表达p63。Warthin瘤样MEC的中间型细胞及表皮样则显示全层弥漫表达p63、CK5/6和CK7。FISH检测MAML2基因重排阳性可有助于诊断Warthin瘤样MEC[17-18]。
3.4 治疗与预后目前,手术切除仍是涎腺MEC的首选治疗方法,而术后放疗则主要用于高级别、晚期、不可切除和复发的MEC患者。近年文献报道,MEC的5、10年总生存率分别为83.1%和73.6%[19]。本组28例MEC均行肿瘤完整切除,有1例术后复发,1例骨转移,1例死亡,整体预后较好。MAML2基因重排的相关机制还需积累更多病例进行分析,寻找潜在的治疗靶点,为MEC的治疗提供新方向。
