乙醛脱氢酶2(ALDH2)基因多态性与血尿酸相关性的临床观察
2021-06-07胡晨鸣余寿益莫巧璇赖锦兰
胡晨鸣,余寿益,莫巧璇,赖锦兰
(佛山市中医院,广东 佛山 528000)
0 引言
根据2019 年中国高尿酸血症与痛风诊疗指南[1],目前中国大陆高尿酸血症的总体患病率13.3%,患病人数已经超过1.8 亿,患病人数甚至已超过糖尿病。痛风的总体患病率约1.1%,患病人数超过1500 万。高尿酸血症患病率的高低受经济发展程度、环境、饮食习惯、种族、遗传等多种因素的影响,呈现一定的特征:年轻化、“重男轻女”、遗传倾向、地区与种族差异[2]。临床诊疗过程中发现,约90%入院治疗的急性痛风患者的诱因多是摄入高嘌呤含量的食物、气候变化、饮酒、果糖摄入过多、运动过度等生活因素,足以看出生活因素对痛风的重大影响。其中,酒精是比食物更重要的危险因素,血尿酸水平随着酒精摄入量的增加而增加,多因素分析发现,日常饮酒中,每增加10g 的酒精,痛风的发生风险增加17%。
乙醇代谢的整个过程中有两个关键酶:将乙醇氧化为乙醛的乙醇脱氢酶ADH、将乙醛进一步氧化为乙酸的乙醛脱氢酶ALDH。ALDH 基因编码多个同工酶,乙醛的氧化速度主要受活性最强的ALDH2 调控。研究发现,ALDH2 基因12 外显子第1510 位点的鸟嘌呤核苷酸G 被腺嘌呤核苷酸A 替换时,ALDH2 基因编码的蛋白质第487 位氨基酸发生Glu 到Lys的变化,进而导致其编码的酶活性丧失或降低,ALDH2 基因A 等位基因是显性遗传[3]。相较于野生基因型ALDH2*1/*1,杂合子ALDH2*2/*1 和纯合突变基因型ALDH2*2/*2 基因所编码的酶蛋白都没有活性,对乙醇代谢的影响几乎相同。
ALDH2*2/*1 和ALDH2*2/*2 基因型个体饮酒后的表现形式为面红反应,表面上看该位点的多态性使突变等位基因携带者的酒精代谢异常,但另一方面存在该基因多态性人群由于饮酒后马上出现的不舒适感受会减少酒精的摄入,从而使该位点的突变成为饮酒行为的保护因子,而野生基因型ALDH2*1/*1 个体饮酒后不会马上出现不舒适感,因此饮酒量及次数往往会多于ALDH2*2/*1 和ALDH2*2/*2 基因型个体[4,5]。酒精对血尿酸的影响不仅取决于饮酒量还与酒精代谢的酶相关,本研究旨在了解广东省无降尿酸治疗史、平均每天饮酒量约25mL(随访中自报告饮酒量)人群的不同ALDH基因型(第504 位Glu 突变为Lys)与血尿酸的相关性。
1 资料与方法
1.1 研究对象
选自2018 年1 月至2020 年12 月在佛山市中医院进行ALDH2 基因多态性检测的人群,平均每天饮酒量为白酒25mL,共153 人。
1.2 试剂与仪器
PCR 仪:AB7500 荧光定量PCR 仪(美国Life Technologies公司);人类ALDH2 基因检测试剂盒(PCR-荧光探针法)购自武汉友芝友医疗科技股份有限公司;核酸提取仪Smart32购自广州达安医疗有限公司;贝克曼库尔特AU5831 全自动生化仪。
1.3 外周血DNA 提取
取志愿者的EDTA-K 抗凝静脉血2mL,提取方法参考广州和实生物技术有限公司生产的核酸提取试剂盒说明书进行操作:抗凝全血静置后会出现分层现象,提取前应反复混匀后加200uL 全血在96 孔预装板的第1 列和第7 列,再加入蛋白酶50uL,在Smart32 核提取酸仪上按照仪器要求的提取程序进行自动化核酸提取,运行结束后第6 列和第12 列对应槽位为相应标本提取的DNA。
1.4 荧光定量PCR 扩增ALDH2 基因
先将ALDH2*2 反应液23μL,加入到200μL PCR 8 联管内,再依次分别加入基因组DNA、弱阳性对照、空白对照各2μL 到已装有PCR 反应液的反应管中,待测标本基因组DNA推荐的浓度为5-15ng/ul。盖好反应管按如下程序扩增:37℃ 10min,95 ℃预变性5min;扩增阶 段95 ℃变 性15s,60 ℃延伸60s,共40 个循环。荧光信号的收集定为FAM(ALDH2*2 1502G),VIC(ALDH2*2 1502A)和ROX(内标),数据的采集定在60℃。
1.5 ALDH2 基因型判定
阳性对照组的FAM、VIC、ROX 通道Ct值≤32,扩增曲线有明显指数增长期;空白对照组的FAM、VIC、ROX 通道无扩增曲线,或者扩增曲线为直线或轻微斜线,无明显指数增长期,无Ct值或Ct值≥38。样本组有效性的判定标准为:内标基因所有样本中ROX 通道Ct<38,扩增曲线有明显指数增长期。
1.6 血尿酸检测方法
本研究利用贝克曼库尔特AU 生化分析系统中配备的尿酸酶-过氧化物酶法检测血尿酸含量。
1.7 统计学处理
采用SigmaPlot 12 与Excel 统计软件对数据进行处理。
2 结果
2.1 ALDH2 基因型的检测
检测结果判定标准如下:野生基因型ALDH2*1/*1 的FAM 通道Ct值≤36、VIC 通道Ct值>36 或无Ct值,杂合基因型ALDH2*2/*1 的FAM 通道Ct值≤36、VIC 通 道Ct值≤36,纯合突变基因型ALDH2*2/*2 的FAM 通道Ct值>36 或无Ct值、VIC 通道Ct值≤36,不同基因 型ALDH2的荧光定量PCR 检测结果如图1 所示,上图为野生基因型ALDH2*1/*1、中图为杂合基因型ALDH2*2/*1、下图为纯合突变基因型ALDH2*2/*2。
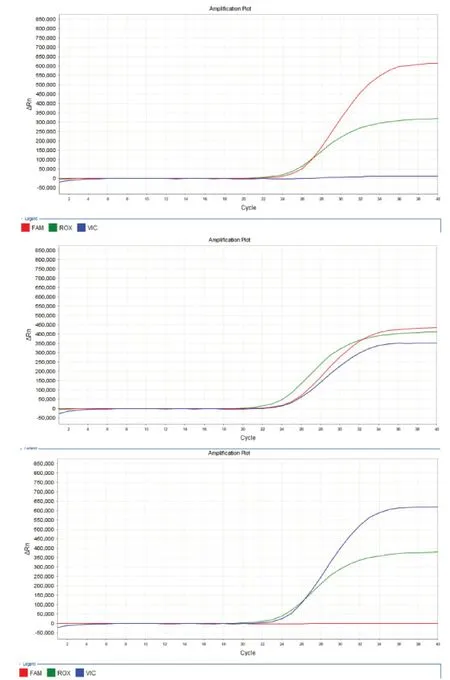
图1 不同基因型ALDH2 的荧光定量PCR 检测结果
2.2 不同ALDH2 基因型的人数及血尿酸
在检测人群中,野生基因型ALDH2*1/*1 个体共62 人,其中女性2 人、男性60 人;杂合基因型ALDH2*2/*1 个体共61 人,女性7 人、男性54 人;纯合突变基因型ALDH2*2/*2个体共30 人,女性8 人、男性22 人。不同基因型人群的血尿酸如表1 所示。

表1 不同基因型人群的血尿酸(平均值±标准差)
2.3 野生基因型ALDH2*1/*1 人群的血尿酸分布
根据本医院血尿酸的检测方法,血尿酸的参考范围:男性为208-428 μmol/L,女性为155-357 μmol/L。在此基础上,野生基因型ALDH2*1/*1 人群的血尿酸分布如图2 所示,血尿酸在正产范围内的共0 人;血尿酸超出上限0~50 μmol/L 的共24 人,比例约为38.71%,血尿酸平均值为443.63±23.23 μmol/L;血尿酸超出上限50~100 μmol/L 的共15 人,比例约为24.19%,平均值为498.69±14.52 μmol/L;血尿酸超出上限100~150 μmol/L 的共10 人,比例约为16.13%,平均值为550.76±12.93 μmol/L;血尿酸超出上限150~200 μmol/L 的共7 人,比例约为11.29%,平均值为598.54±4.76 μmol/L;血尿酸超出上限200 μmol/L 的共6 人,比例约为9.7%,平均值为714.78±75.01 μmol/L。
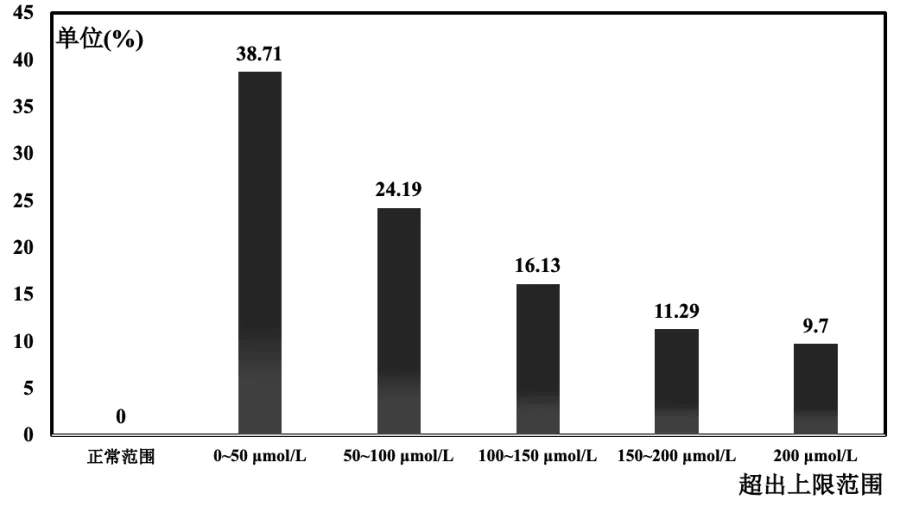
图2 野生基因型ALDH2*1/*1 人群的血尿酸分布
2.4 杂合基因型ALDH2*2/*1 人群的血尿酸分布
ALDH2*2/*1 人群的血尿酸分布如图3 所示,血尿酸在正产范围内的共0 人;血尿酸超出上限0~50 μmol/L 的共19 人,比例约为31.15%,血尿酸平均值为437.29±33.99 μmol/L;血尿酸超出上限50~100 μmol/L 的共22 人,比例约为36.07%,平均值为496.82±21.91 μmol/L;血尿酸超出上限100~150 μmol/L 的共13 人,比例约为21.31%,平均值为552.08±16.32 μmol/L;血尿酸超出上限150~200 μmol/L 的共4 人,比例约为6.56%,平均值为604.15±7.83 μmol/L;血尿酸超出上限200 μmol/L 的共3人,比例约为4.92%,平均值为636.97±4.34 μmol/L。
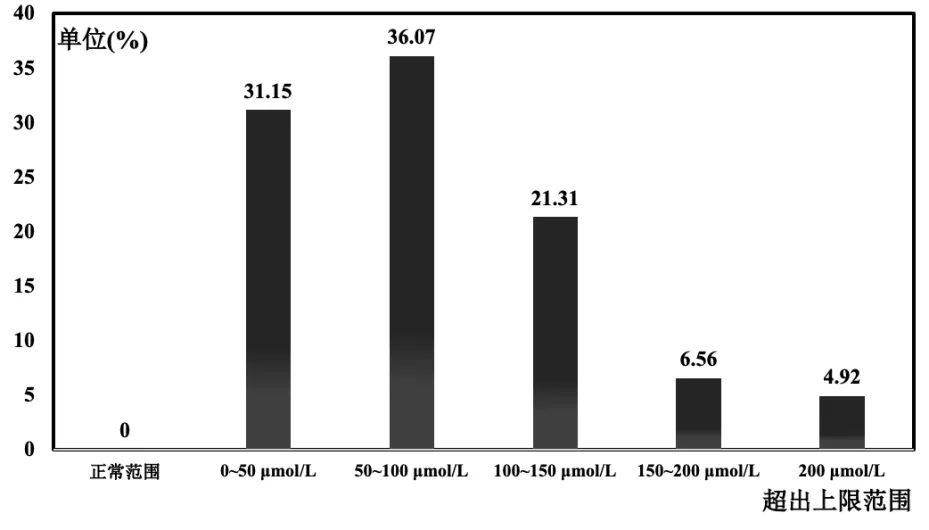
图3 杂合基因型ALDH2*2/*1 人群的血尿酸分布
2.5 纯合突变基因型ALDH2*2/*2 人群的血尿酸分布
ALDH2*2/*2 人群的血尿酸分布如图4 所示,血尿酸在正产范围内的共13 人,比例约为43.33%,血尿酸平均值为347.19±37.48 μmol/L;血尿酸超出上限0~50 μmol/L 的共7 人,比例约为23.33%,血尿酸平均值为427.46±28.44 μmol/L;血尿酸超出上限50~100 μmol/L 的共3 人,比例约为10.00%,平均值为459.63±24.25 μmol/L;血尿酸超出上限100~150 μmol/L 的共7 人,比例约为23.33%,平均值为508.51±24.18 μmol/L;血尿酸超出上限150 μmol/L 的共0 人。
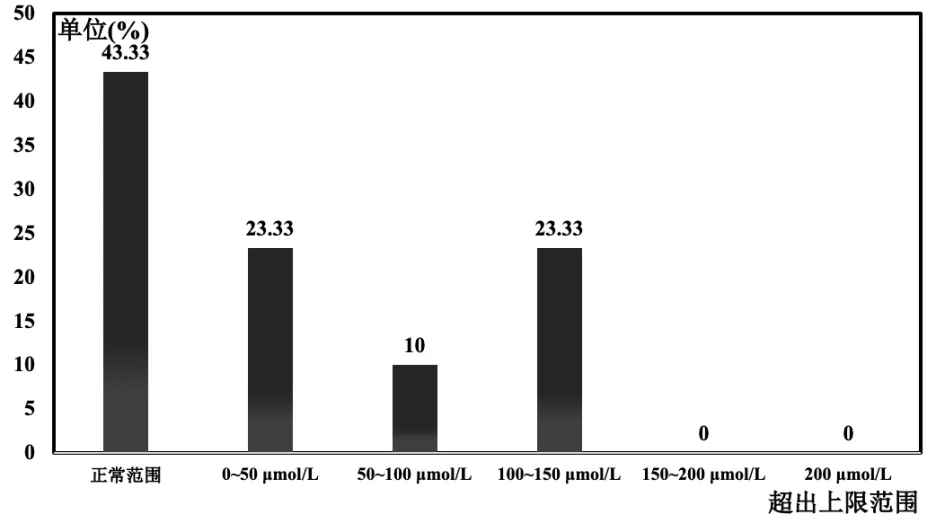
图4 纯合突变基因型ALDH2*2/*2 人群的血尿酸分布
3 讨论
在我们调查的153 名广东人中,野生基因型ALDH2*1/*1共62 人,约占40.52%,杂合基因型ALDH2*2/*1 共61 人,约占39.87%,纯合突变基因型ALDH2*2/*2 共30 人,约占19.61%。本研究纳入的患者人数偏少,虽然不能表明当地人的ALDH2 基因多态性比例,但对于分析血尿酸与ALDH2 基因多态性的相关性的分析结果具有统计学意义。本研究显示,野生基因型ALDH2*1/*1 与杂合基因型ALDH2*2/*1 的血尿酸差异并不显著,尤其是在正常范围内的血尿酸分布和血尿酸超出上限0~150 μmol/L 范围内。仅在血尿酸超出参考值上限150~200 μmol/L 和200 μmol/L 以上范围内,二者的血尿酸分布存在着较大的差异,两种基因型在上述范围内的占比分别为11.29%和9.7%、6.56%和4.92%。然而,纯合突变型ALDH2*2/*2 的血尿酸分布与基因型ALDH2*1/*1 和ALDH2*2/*1 存在着显著差异,其血尿酸平均值显著较低。
除了上述ALDH2 基因变异造成的潜在饮酒量的差异外,基因型ALDH2*2/*1 与ALDH2*2/*2 的血尿酸分布的显著差异,也充分体现了ALDH2 基因多态性与血尿酸关系的复杂性。在这方面已有多项研究被报道,Yamanaka 等[6]发现当摄入60mL 威士忌后杂合子ALDH2*1/*2 基因个体的血液和尿液的次黄嘌呤浓度明显低于野生型ALDH2*1/*1 个体,而ALDH2*2/*2 个体的血液和尿液次黄嘌呤浓度并不升高;同时发现在痛风患者野生型ALDH2*1/*1 分布率要高于正常对照,而携带突变型ALDH2*2/*2 个体的痛风患者却少于正常对照者,因此得出结论日本大部分痛风患者饮酒后无不适反应,可能更易形成饮酒的习惯,加剧痛风病情。Hashimoto[7]等的研究未发现ALDH2*2/*1、ALDH2*2/*2 基因型个体与ALDH2*1/*1 基因型个体血液尿酸浓度存在差异性。Sakiyama 等的研究发现野生型 ALDH2*1/*1 痛风发作风险显著高于ALDH2*2/*1、ALDH2*2/*2 基因型人群[8]。Suwa研究团队与Yamamoto 研究团队均发现发现乙醇通过肝脏的氧化代谢过程,通过增加NADH/NAD 比值,加速丙酮酸向乳酸的转化,从而使血液乳酸浓度升高竞争性抑制尿酸的排泄。同时,通过酒精代谢消耗ATP,加速腺嘌呤核苷酸的降解,从而导致AMP 的形成,从而增加尿酸的产生[9,10]。Yokoyama 等的研究发现,在日本人中ALDH2*1/*1 基因型对乙醇和乙醛的快速代谢和较高的酮症水平与酗酒者较高的血尿酸水平有关[11]。
本研究表明,在一定的饮酒量的情况下,血尿酸与ALDH2 基因多态性存在着显著的相关性,而基因型ALDH2*2/*2 和ALDH2*2/*1 人群的血尿酸分布的显著差异,也说明二者的血尿酸与ALDH2 基因的相关性不仅与其活性相关,可能也与ALDH2 的其他功能相关,这一结果值得我们后续进一步深入研究。
