不同固定方法制作细胞蜡块的效果比较
2021-05-13吴杉杉王俏洋江佳星
吴杉杉 王俏洋 江佳星
脱落细胞学检查凭借着取材方法快速、简单、创伤小等优势已经成为病理检查的常规方法之一,但传统的细胞学涂片常常因为细胞量不足、细胞易出现退变及结构不清等原因,导致细胞学诊断的困难[1-3]。目前薄层液基细胞学检查虽然改善了传统细胞学的制片质量,但此检查方法处理的细胞样本不易获得细胞排列方式和背景对照细胞,导致难以鉴别可疑和高分化癌细胞以及反应性间皮细胞和间皮瘤[4-6]。随着分子病理检测技术、免疫组化抗体检测技术的广泛应用,体腔积液样本可以提供更多的有效信息[3,7],但不管是常规涂片还是液基制片,均不能进行后续的免疫组化及分子检测,而细胞蜡块可以明确积液中细胞成分的分化来源以及性质,也可以为后续相关检测提供源源不断的样本数量,为靶向治疗提供可靠的依据。本研究采用3种不同的固定方法,对同一浆膜腔积液提供的细胞蜡块进行制作,以寻求最佳固定方法,现将结果报道如下。
1 材料和方法
1.1 材料 收集2020年1至4月浙江省台州医院病理科送检的胸腹水标本60例,其中胸水标本32例,腹水标本28例;男37例,女23例;年龄 32~89(62.60±11.84)岁。
1.2 试剂 10%中性缓冲甲醛购自宁波同盛生物科技有限公司;薄层液基细胞学检查指定保存液购自美国BD公司;细胞蜡块制作试剂盒购自广州安必平医药科技股份有限公司。按需要选择细胞角蛋白(CK,克隆号:AE1/AE3)、CK7(克隆号:OV-TL12/30)、CK20(克隆号:Ks20.8)、微管素(Villin,克隆号:CWWB1)、癌胚抗原(CEA,克隆号:CoL-1)、尾型同源盒转录因子 2(Cdx-2,克隆号:EPR2764Y)、甲状腺转录因子(TTF-1,克隆号:SPT24)、钙结合蛋白(CR,克隆号:MX027)等抗体,一抗试剂购自福州迈新公司,二抗以及DAB显色系统购自北京中杉金桥生物技术有限公司。
1.3 方法
1.3.1 细胞蜡块制作法 (1)临床送检的新鲜体液标本,量为200~500 ml。将其于阴凉处或4℃冰箱内静置10 min,然后将上1/3的上清液倒入废液桶,将剩余体液倒入标记好1、2、3的3个50ml尖底离心管,各约50 ml,2 500 r/min离心10 min,然后将上清液倒入废液桶。若标本细胞量过少,无需静置后倒去上清液,直接采用多次离心(2 500 r/min)轻轻吸弃上清液的方法,富集细胞后保留沉淀。若标本为血性标本,将标本倒入离心管内首次离心,2 500 r/min离心10 min,缓慢倾倒上清液,再加适量冰醋酸乙醇溶液(95%乙醇95 ml+冰醋酸5 ml)于离心管内,充分振荡混匀,以混合液为浅红色为佳,再次离心(2 500 r/min)10 min,缓慢倾倒上清液。继而对每管进行相应的制作处理。(2)1号离心管中加入10%中性缓冲甲醛10 ml,振荡,于阴凉处或4℃冰箱内静置2 h后2 500 r/min离心10 min,缓慢倾倒上清液,再加入95%乙醇5 ml后振荡,于阴凉处或4℃冰箱内静置1 h后2 500 r/min离心10 min。2号离心管中加入薄层液基细胞学检查指定保存液10 ml,充分振荡,于阴凉处或4℃冰箱内静置2 h后2 500 r/min离心10 min,缓慢倾倒上清液。3号离心管中滴加细胞蜡块制作试剂盒的试剂A 1~3滴,充分振荡混匀,2 500 r/min离心10 min,若上清液较多,吸弃多余的上清液,然后滴加试剂B 2~3滴,轻轻晃动离心管,静置30 s。(3)用软吸管将离心管底部的沉淀物吸出,置于包埋纸上,包好,放入包埋盒中,放入自动脱水机中与常规组织一起进行脱水。待处理结束后,取出组织块,打开包埋纸,用镊子将细胞块轻轻夹到包埋模具中间,行常规石蜡包埋,尽量使细胞都平铺在模具底部,制成细胞蜡块。
1.3.2 切片与烤片 将细胞富集蜡块放入-28℃冰箱冷冻室中,持续冷藏放置10 min后进行常规切片,注意常规粗修时不要过度修片,切片厚度为3 μm,均切数张备用,置入80℃烤箱烤片15 min。
1.3.3 常规HE和免疫组化染色 二甲苯脱蜡,梯度乙醇至水化后,一张切片进行常规HE染色,其余切片根据需要不同而选择不同的抗体进行免疫组化染色。按照一抗及二抗试剂要求,进行PowerVision二步染色法。经过抗原热修复、阻断内源性过氧化物酶、一抗37℃孵育、二抗孵育、DAB显色等步骤后行苏木素复染,梯度乙醇脱水,二甲苯透明,樱花薄膜胶带封片,显微镜下观察。
2 结果
2.1 HE染色结果 采用10%中性缓冲甲醛与95%乙醇固定的富集细胞块,HE染色鲜艳,细胞轮廓清晰,细胞排列清楚可见,肿瘤细胞的核仁比较明显,并且肿瘤细胞与周围正常的间皮细胞对比明显,背景干净(图1a);薄层液基细胞学检查指定保存液固定的细胞块HE染色偏红,细胞排列方式基本可见,细胞核保存欠佳,部分核有固缩现象(图1b);细胞蜡块制作试剂盒固定的细胞块细胞量偏少,HE染色细胞轮廓较模糊,细胞核有重叠现象(图1c)。
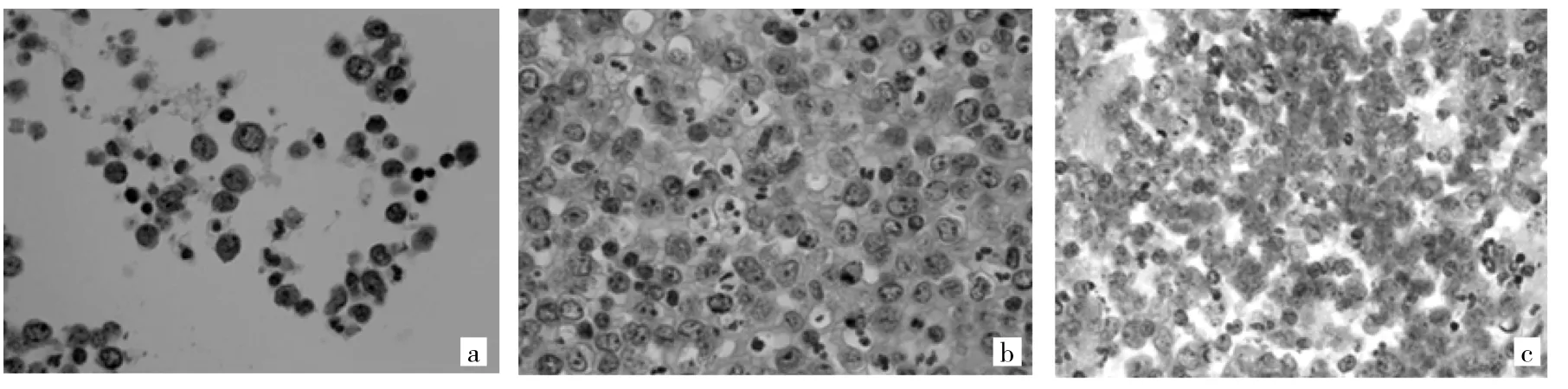
图1 HE染色所见(a:10%中性缓冲甲醛和95%乙醇联合固定;b:薄层液基细胞学检查指定保存液固定;c:细胞蜡块制作试剂盒固定;×400)
2.2 免疫组化标记结果 实验得出10%中性缓冲甲醛和95%乙醇联合固定的细胞富集蜡块的免疫抗体标志物表达效果最好,抗体标记清晰易判,背景干净(图2ab);薄层液基细胞学检查指定保存液固定、细胞蜡块制作试剂盒固定的细胞蜡块免疫标记染色效果均欠佳,抗体标记稍减弱(图2c-f)。

图2 免疫组化染色所见[a:10%中性缓冲甲醛和95%乙醇联合固定细胞角蛋白(CK)表达定位准确,结果(+++);b:10%中性缓冲甲醛和95%乙醇联合固定钙结合蛋白(CR)表达定位准确,结果(+++);c:薄层液基细胞学检查指定保存液固定CK表达定位准确,结果(+);d:薄层液基细胞学检查指定保存液固定CR表达定位准确,结果(+);e:细胞蜡块制作试剂盒固定CK表达定位准确,结果(+);f:细胞蜡块制作试剂盒固定CR表达定位准确,结果(+);×400]
3 讨论
发生在全身或胸腹腔内的恶性肿瘤和(或)恶性病变引起胸腔、腹腔的脏层和(或)壁层胸腹膜发生弥漫性病变,继而导致体腔内液体异常增多的现象,被称为恶性胸腹水,在临床上较为常见[8-9]。目前对临床送检的体腔积液的检测方式通常有以下几种:第一,普通细胞涂片,操作简单,报告时间短,是几乎所有病理科都常规开展的项目,但与制片人员的技术水平密切相关,细胞取样层选择不当、涂片厚薄不均等均会影响病理诊断;第二,薄层液基细胞学制片术,尤其在样本细胞量比较少的时候,可以通过此方法得到相对理想的高质量涂片,但试剂与仪器成本较高,在小型医院开展的难度相对较大[10];第三,细胞蜡块技术,具有保存细胞新鲜、抗原保留完整等优点,且可进行多次切片,用于原位杂交、免疫组化染色、分子检测、药物分析、临床实验等,可提高细胞学诊断的阳性率,也可帮助判断细胞的来源、分型,有利于评估患者预后[11-12]。
近年来,已有多种细胞蜡块的制作方法[5,13-15],同时很多厂家也生产出了细胞蜡块制作试剂盒,但关于分析不同固定方法对细胞蜡块制作效果影响的文章较少。本研究对同一浆膜腔积液应用3种不同的固定方法进行细胞蜡块的制作。首先,10%中性缓冲甲醛和95%乙醇联合固定法,10%中性缓冲甲醛液为交联剂,可以与蛋白质相互交联而发生沉淀,从而较好地保持细胞的完整性,穿透性较好,使细胞收缩小,对大多数抗原物质保存较好,但存在细胞不易凝结成块的缺点,而联合使用95%乙醇刚好弥补了这一点,95%乙醇为脂溶性有机溶剂,可帮助细胞沉淀凝固成块,便于细胞块的制作。实验得出此联合固定法得到的细胞蜡块HE染色鲜艳,能清楚地展现完整的细胞形态与结构,免疫组化标记较为容易判别。其次,薄层液基细胞学检查指定保存液,是一种以乙醇为基础的红色固定剂,其主要成分可以溶解红细胞并沉淀蛋白,并含有脂肪酸,实验过程中发现此方法固定后细胞不易取样包埋,而且所得的蜡块HE染色中伊红深染偏红,部分细胞空泡化,部分核有固缩现象,免疫组化标记效果欠佳。分析原因是固定液中的脂肪酸被醇类变性,会影响蛋白质形成超聚集体,不利于包埋等操作,并且可能影响后续的染色。最后,细胞蜡块制作试剂盒,试剂A的作用是迅速杀死细胞,使其固定,试剂B与样本混合后成半流体状,脱水后呈沙粒状。实验结果显示此方法得到的细胞块细胞量偏少,HE染色细胞轮廓不清,部分细胞核重叠比较严重,免疫组化标记效果欠佳。并且从成本角度考虑,薄层液基细胞学检查指定保存液和细胞蜡块制作试剂盒成本较高,而10%中性甲醛与95%乙醇是普通及价廉的试剂,相对而言,前两者检查费用昂贵,患者经济压力较重,在许多小型医院无法开展,后者更容易开展。
综上所述,本文应用3种不同固定方法对同一体腔积液制作细胞富集块时进行固定处理,通过观察3者细胞蜡块HE染色和免疫标记定位效果的差异,得出10%中性缓冲甲醛和95%乙醇联合固定效果比较满意,且对抗原的影响较小,因此该法值得广为推荐。
