CO2点阵激光联合糖皮质激素治疗兔耳增生性瘢痕的疗效评价
2021-05-13洪旭东沈盛县金剑张炳臣范浩张旭东吴思捷罗鹏飞
洪旭东 沈盛县 金剑 张炳臣 范浩 张旭东 吴思捷 罗鹏飞
增生性瘢痕(hypertrophic scar,HS)是一种皮肤纤维增生性疾病,常发生于严重创伤、深度烧伤和外科手术切口等创面愈合过程中[1]。创伤后组织细胞过度增生、细胞外基质过度表达并沉积在局部造成局部结构紊乱是HS具有破坏性的特征[2-3]。长期反复的炎性刺激是导致瘢痕呈增生性生长的最重要致病因素[4]。除此之外,HS的发病机制与感染、伤口内异物、过度的伤口张力或伤口边缘的持续牵拉活动等也密切相关[5]。糖皮质激素是治疗HS的一线药物之一,给药途径为瘢痕内注射,给药频次通常为每月注射1次,属于有创操作,存在注射时不适和疼痛明显、注射阻力极大、医患双方体验感均差以及瘢痕内药物分布不均匀等问题,因此部分学者将其作为HS的二线治疗药物[6]。尽管早期干预性治疗是防治HS的第一步,但糖皮质激素的使用会降低患者免疫力,增加创面感染及延迟愈合的风险,因此,临床中应尽量减少糖皮质激素的用量。研究发现糖皮质激素与其他治疗方法联合应用可提高HS的治疗效果,包括联合使用5-氟尿嘧啶(5-FU)、维拉帕米等[7]。近年来激光在HS防治中的作用越来越受到重视和认可[8],其中点阵激光自2003年首次报道以来被越来越多地用于HS防治(能量和范围根据HS实际情况确定,频次为每月1次)[9]。相较于常规有创治疗,点阵激光具有精准和微创两大优势,理论上将点阵激光和药物注射联合应用,不仅可以降低损伤程度和疼痛不适感,还可以解决药物分布不均匀等问题,有可能使治疗效果倍增。因此,本研究通过建立兔耳HS模型,采用CO2点阵激光联合糖皮质激素(曲安奈德)防治HS,以期为临床两者联合应用提供理论依据。
1 材料和方法
1.1 实验动物 成年雄性新西兰大白兔15只,体重2.5~3.0 kg,由海军军医大学动物实验中心购得并饲养。将大白兔置于特定的SPF级别环境中,控制室温23~27℃、相对湿度45%~65%、12 h光照/暗循环。所有动物实验程序均符合美国国立卫生研究院出版的《护理和使用实验动物指南》(出版号:96-01)。
1.2 主要仪器及试剂 CO2点阵激光治疗仪(型号:UltraPulse Encore,以色列Lumenis科医人医疗激光公司);皮肤活检器(中国精工仪表仪器厂,直径:8 mm);显微镜及其配套拍照测量软件(型号:DMI3000B LAS AF系统,德国Leica公司);凝胶成像系统及其配套拍照测量软件(型号:ImageQuant LAS 4000系统,美国GE Healthcare公司);曲安奈德注射液(昆明积大制药股份有限公司,8 mg/ml);平滑肌肌动蛋白(smooth muscle actin,SMA)抗体(英国 Abcam 公司,批号:ab240654);Ⅰ型胶原蛋白(Collagen Ⅰ)抗体(美国 Thermo Fisher Scientific公司,批号:MA1-26771);β-actin抗体(英国Abcam 公司,批号:ab8227)。
1.3 兔耳HS模型建立和治疗方法 兔耳HS模型建立方法:兔耳缘静脉注射1%戊巴比妥钠(3 ml/kg),手术部位局部注射2%利多卡因和1∶20万稀释的肾上腺素。用皮肤活检器在每只耳的腹侧表面各打6个直径8 mm、间隔10 mm以上的圆形创面,再用手术刀片切除表皮、真皮和软骨膜,在软骨上用手术刀反复刮擦,彻底去除软骨膜(图1),用棉球加压止血;造模第14天左右,创面痂皮自然脱落,形成HS。采用随机数字表法将大白兔分为对照组、激素组和激光激素组3组,每组5只共10只耳朵,每只耳朵制备6个瘢痕创面,每组共60个瘢痕创面。造模第14天,对照组用0.9%氯化钠溶液涂抹创面;激素组用胰岛素注射器(29G针头:0.33 mm×12.7 mm)在HS内注射8 mg曲安奈德注射液(每点2 mg,共4个点位);激光激素组给予激光治疗(参数设置如下:body模式,能量 80 mJ,范围 1 cm×1 cm,密度 11.1%),继而在创面涂抹8 mg曲安奈德注射液。造模后第14、21、28、35天,分别行HS大体形态观察,扩大切取HS组织(每只大白兔每个时间点取3处,每组共计取15处,切取范围扩大至HS组织周边1~2 mm宽度的正常组织)行病理检查并测定瘢痕增生指数(hypertrophic index,HI);造模后第35天检测HS组织中Collagen Ⅰ和SMA蛋白表达水平。

图1 兔耳增生性瘢痕(HS)模型建立(a:皮肤活检器,直径为8 mm;b:在兔耳腹侧用直径为8 mm的皮肤活检器建立兔耳HS模型,各创面之间距离>10 mm)
1.4 病理检查 HS组织固定于4%多聚甲醛24 h,经脱水、浸蜡、石蜡包埋后,自HS组织中间部位(瘢痕增生最显著部位)开始向两端作连续切片(5 μm)并置于载玻片上,脱蜡后行HE染色,观察HS形成状况。
1.5 HI测定 将造模后第14、21、28、35天的HS组织切片置于DMI3000B显微镜低倍镜下进行拍照,并通过LAS AF软件分别测量HS厚度A和正常皮肤厚度B(具体测量方法见图2)。计算不同时间点各组HI,HI计算公式[10]如下:HI=(HS厚度A-正常皮肤厚度B)/正常皮肤厚度B。
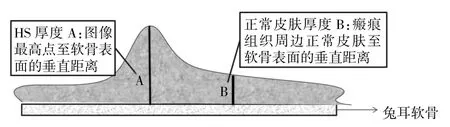
图2 HE染色后在显微镜下观察利用LAS AF软件测量瘢痕增生指数(HI)(HS为增生性瘢痕)
1.5 Collagen Ⅰ和SMA表达水平检测 采用Western blot法。HS组织研磨后加入组织裂解液冰上裂解10 min,4℃12 000 r/min离心10 min,取上清液作为HS组织蛋白提取液,SDS-PAGE凝胶电泳(分离胶8%,浓缩胶5%)分离蛋白并转至PVDF膜上,5%脱脂奶粉室温封闭1 h;分别加入一抗(SMA抗体1∶1 000稀释,Collagen Ⅰ抗体 1∶2 000稀释,β-actin抗体 1∶2 000稀释)4 ℃孵育过夜;加入对应二抗,室温孵育1 h。凝胶成像分析系统对结果拍照并用自带软件进行灰度值分析,目的蛋白灰度值与内参蛋白(β-actin)灰度值的比值即为目的蛋白相对表达量。
1.6 统计学处理 采用SPSS 21.0统计软件。计量资料以表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 造模后不同时间点各组兔耳HS大体形态比较 对照组兔耳创面在造模后第14天脱痂时开始出现瘢痕增生,造模后第21、28和35天时瘢痕继续增生,而激素组和激光激素组兔耳瘢痕增生速度明显慢于对照组。造模后第35天,对照组兔耳创面肉眼可见明显高于周围正常皮肤的HS组织,与周围正常皮肤比较,颜色明显更深、色泽更暗、质地更硬;激素组和激光激素组兔耳创面均未见明显高于周围正常皮肤的HS组织,但激素组兔耳HS组织颜色更深、质地偏硬,而激光激素组兔耳HS组织颜色和质地均与周围正常皮肤无明显差别,显示出对HS最佳的抑制效果(图3,见插页)。
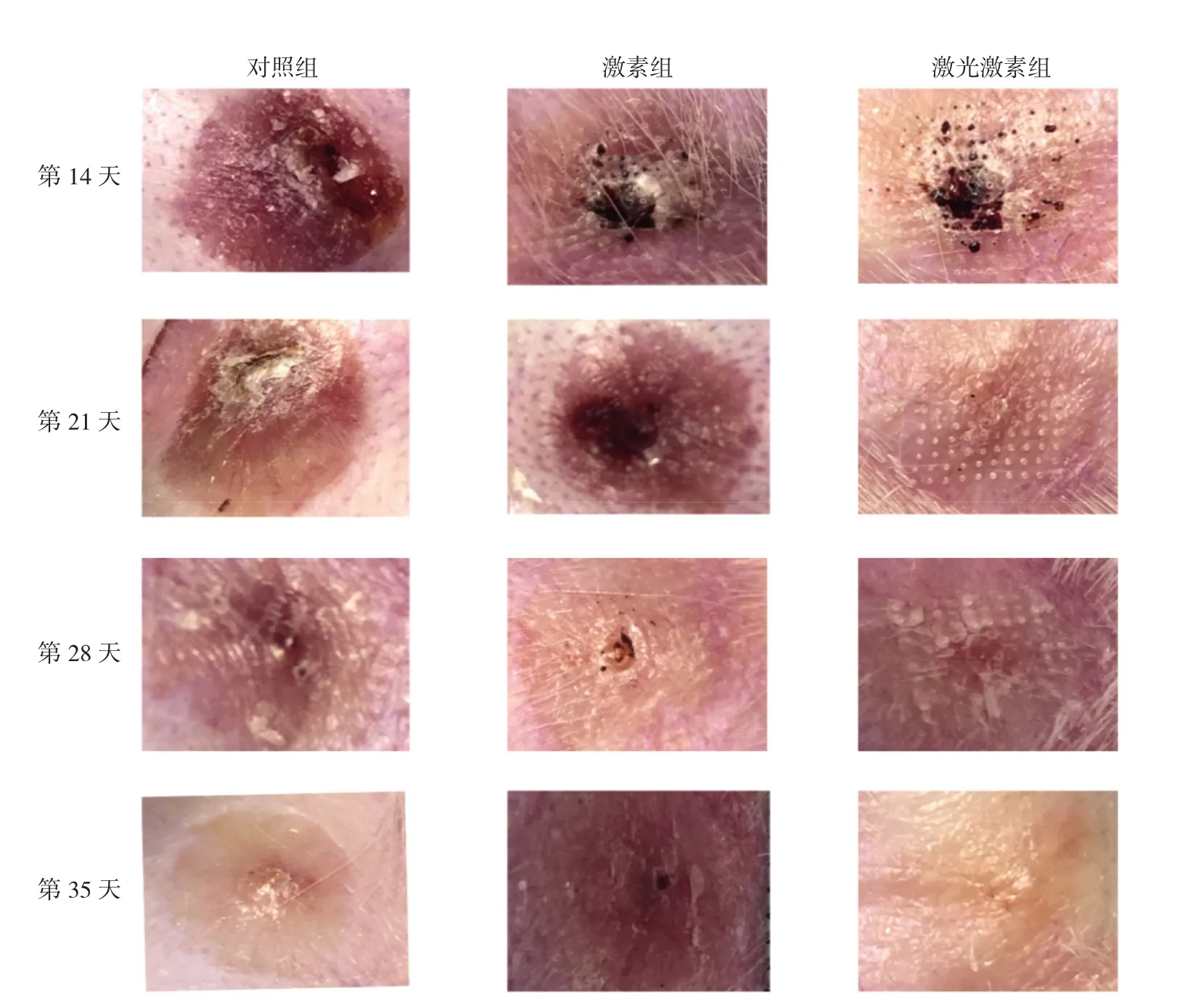
图3 造模后不同时间点各组兔耳创面增生性瘢痕(HS)大体形态比较
2.2 各组兔耳HS组织病理检查结果比较 造模后第35天,对照组兔耳HS组织中成纤维细胞数目增多明显,微血管密集,炎性细胞浸润明显,纤维组织排列紊乱,无规律;而激素组和激光激素组兔耳HS组织中成纤维细胞数目明显减少,微血管密度也较对照组减少,炎性细胞浸润较轻,纤维组织相对规律,成线条状排列;较激素组而言,激光激素组兔耳HS组织中成纤维细胞数目和微血管密度更少,炎性细胞浸润更轻(图4,见插页)。

图4 造模后第35天各组兔耳增生性瘢痕(HS)组织病理检查结果比较(a:对照组;b:激素组;c:激光激素组;HE染色,×20)
2.3 造模后不同时间点各组兔耳HS组织HI比较 造模后第14天各组兔耳HS组织HI比较差异无统计学意义(P>0.05);造模后第 21、28、35 天,激光激素组和激素组HS组织HI均低于对照组(均P<0.05);造模后第28天,激光激素组HS组织HI低于激素组(P<0.05),见表 1。
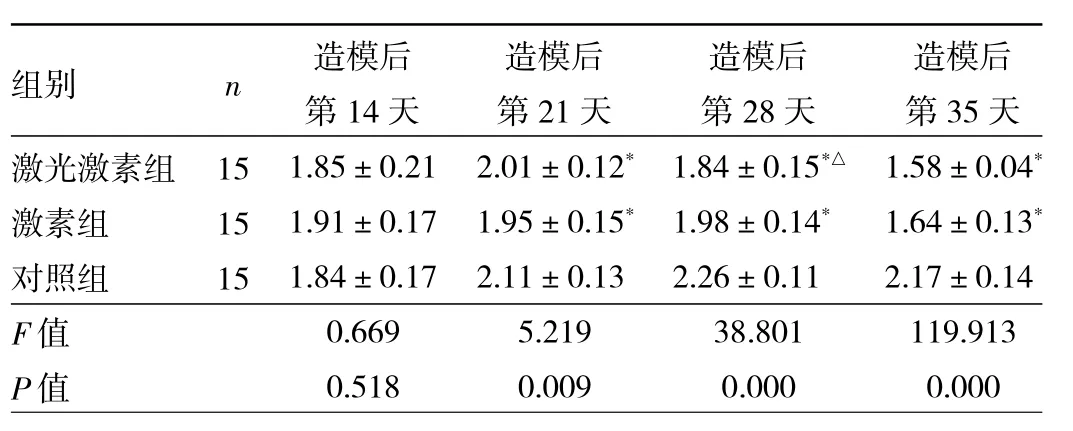
表1 造模后不同时间点各组兔耳HS组织HI比较
2.4 各组兔耳HS组织中Collagen Ⅰ和SMA表达水平比较 激光激素组和激素组兔耳HS组织中Collagen Ⅰ和SMA表达水平均低于对照组(均P<0.05);激光激素组兔耳HS组织中SMA表达水平低于激素组(P<0.05),而两组兔耳HS组织中Collagen Ⅰ表达水平比较差异无统计学意义(P>0.05),见图5。
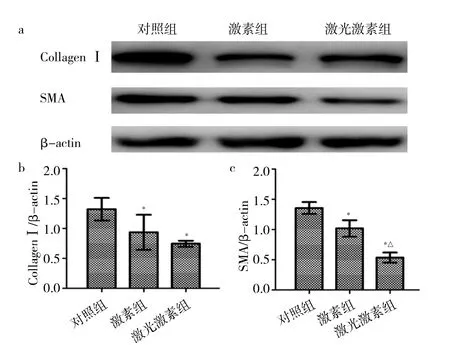
图5 各组兔耳增生性瘢痕(HS)组织中Ⅰ型胶原蛋白(Collagen Ⅰ)和平滑肌肌动蛋白(SMA)表达水平比较(a:各组兔耳HS组织中Collagen Ⅰ和SMA蛋白表达的电泳图;b:各组兔耳HS组织中Collagen Ⅰ表达水平比较,与对照组比较,*P<0.05;c:各组兔耳HS组织中SMA表达水平比较,与对照组比较,*P<0.05;与激素组比较,△P<0.05)
3 讨论
近年来,越来越多的研究发现,在创面愈合后、HS尚未明显成形的早期便开始激光干预,可以有效预防HS的形成,减缓其发生、发展进程,具体表现为瘢痕体积缩小、瘙痒感改善、增生期时间窗缩短等[11]。研究还证实,在多种激光技术中,早期应用非剥脱性点阵铒激光[12]、脉冲染料激光[13]和磷酸钾钛激光[14]均可以有效地预防手术和创伤后HS的形成。除了预防作用外,CO2点阵激光还可有效治疗创伤和手术后已经形成的HS[15-16]。
糖皮质激素常作为治疗HS和瘢痕疙瘩的瘢痕内注射的首选药物[17-18],其作用机制包括:抑制成纤维细胞增生和胶原合成、促进成纤维细胞凋亡和局部组织重塑等,从而达到软化硬度、降低高度、缩小体积、促进成熟的治疗效果。本实验研究结果也证实,单独糖皮质激素处理创伤后早期兔耳HS,可以有效抑制HS形成(造模局部仅有颜色更深、质地更硬的的HS,未见明显高于周围正常皮肤),减少Collagen Ⅰ和SMA的表达,具有一定防治瘢痕过度增生的作用。
研究发现,CO2点阵激光可以和防治HS的多种措施联用,两者发挥协同效应,使治疗效果倍增。具体包括:CO2点阵激光与5-FU联合使用,其热分解作用有助于穿透HS组织的形成微细孔道,从而提高5-FU的通透性和弥散率[19];CO2点阵激光与富血小板血浆组织联合治疗还能显著改善痤疮瘢痕组织的外观和皮肤纹理[20]。本研究利用CO2点阵激光作用于组织后能够穿透HS组织的形成微细孔道的机制,联合外用糖皮质激素达到类似注射糖皮质激素治疗的目的,能有效解决药物分布不均、注射阻力大、疼痛不适感强等传统瘢痕内注射遇到的难题。
本实验研究结果显示:经过CO2点阵激光与糖皮质激素的联合处理后,激光激素组创面未见明显高于周围正常皮肤的HS,颜色和质地与周围正常皮肤也均无明显差别;而激素组创面尽管未见明显高出正常皮肤的HS,但局部颜色偏深、质地偏硬,说明CO2点阵激光与糖皮质激素联合应用抑制HS的总体效果最佳。此外,造模后第28天激光激素组HI明显低于激素组,进一步说明两者联合应用的疗效优于单用糖皮质激素,可以在更短的时间内形成对HS的抑制效应。本实验中,激素组部分愈合创面因注射药物不均匀、局部压力过大造成局部组织缺血甚至尖端组织坏死脱落形成局部缺损,而激光激素组并未发现该现象,这提示CO2点阵激光治疗可以在一定程度上避免HS内注射遇到的上述难题。
综上所述,本动物实验提示,CO2点阵激光联合糖皮质激素治疗可以有效防治HS,为临床应用提供了依据。
