R-EPOCD与R-CDOP方案对初治双表达淋巴瘤效果
2021-05-08牛文验肖淑欣荆凡静宋伟王亚文薛宏伟
牛文验 肖淑欣 荆凡静 宋伟 王亚文 薛宏伟
[摘要]目的比较R-EPOCD(利妥昔单抗、依托泊苷、泼尼松、长春新碱、环磷酰胺、多柔比星脂质体)与R-CDOP方案(利妥昔单抗、环磷酰胺、多柔比星脂质体、长春新碱、泼尼松)治疗双表达淋巴瘤(DEL)效果及不良反应。方法收集我院收治的33例DEL病人的临床资料,17例接受R-EPOCD方案化疗,16例接受R-CDOP方案化疗,比较两种方案治疗效果及不良反应。结果可评估最终疗效病人28例,R-EPOCD组(n=13)的完全缓解率(CR)较R-CDOP组(n=15)高(84.6% vs 60.0%),但差异无显著性(χ2=2.068,P>0.05)。中位随访时间13个月,两组病人的总生存率(OS)和无进展生存率(PFS)比较差异无统计学意义(P>0.05)。两组Ⅲ/Ⅳ度中性粒细胞计数降低发生率比较差异无统计学意义(P>0.05)。结论R-EPOCD治疗DEL病人CR率不低于R-CDOP,不良反应可以耐受。
[关键词]淋巴瘤,大B细胞,弥漫性;药物疗法;治疗结果;药物相关性副作用和不良反应
[中图分类号]R733.4[文献标志码]A[文章编号]2096-5532(2021)01-0064-05
[ABSTRACT]ObjectiveTo compare the effects and adverse reactions of R-EPOCD (rituximab, etoposide, prednisone, vincristine, cyclophosphamide, and liposomal doxorubicin) and R-CDOP (rituximab, cyclophosphamide, liposomal doxorubicin, vincristine, and prednisone) regimens in the treatment of double-expressor lymphoma (DEL). MethodsClinical data were collected from 33 patients with DEL who were admitted to our hospital, among whom 17 received chemotherapy with R-EPOCD regimen and 16 with R-CDOP regimen. The therapeutic effects and adverse reactions of the two regimens were compared. ResultsThe final therapeutic effects were evaluable in 28 patients. The complete remission (CR) rate of the R-EPOCD group (n=13) was higher than that of the R-CDOP group (n=15), but the difference was not significant (84.6% vs 60.0%,χ2=2.068,P>0.05). There were no significant differences in overall survival and progression-free survival at a median follow-up of 13 months as well as in the incidence of grade 3/4 neutropenia between the two groups (P>0.05). ConclusionCompared with R-CDOP, the R-EPOCD regimen yields a higher CR rate with tolerable adverse reactions.
[KEY WORDS]lymphoma, large B-cell, diffuse; drug therapy; treatment outcome; drug-related side effects and adverse reactions
彌漫大B细胞淋巴瘤(DLBCL)是最常见的非霍奇金淋巴瘤,占全部非霍奇金淋巴瘤的35%~40%,其临床表现和预后等具有高度的异质性。双表达淋巴瘤(DEL)是指Myc蛋白和B细胞淋巴瘤因子(Bcl)-2蛋白或Bcl-6蛋白同时高表达的淋巴瘤[1]。 DEL与DLBCL非特殊型相比预后不佳,但2016年WHO分类并未将DEL作为独立的亚型分出,而是仍将其归于DLBCL[2]。目前,临床上治疗DLBCL主要采用R-CHOP方案(利妥昔单抗、环磷酰胺、多柔比星、长春新碱和泼尼松联合用药),治愈率60%~70%,有30%~40%的DLBCL病人会出现复发和(或)转变为难治性[1]。目前国内外对于DEL治疗相关研究较少,且尚无标准治疗方案。本文对我院收治33例初治DEL病人临床资料进行回顾性分析,比较R-EPOCD(利妥昔单抗、依托泊苷、泼尼松、长春新碱、环磷酰胺、多柔比星脂质体)与R-CDOP(利妥昔单抗、环磷酰胺、多柔比星脂质体、长春新碱、泼尼松)方案治疗的效果和安全性。
1资料与方法
1.1一般资料
收集2016年5月30日—2019年8月31日于我院淋巴瘤科住院治疗、经病理检查确诊的初治DEL病人33例的临床资料。33例病人中,男20例(60.6%),女13例(39.4%);年龄为21~76岁,平均59岁。33例病人中共有21例(63.6%)接受荧光原位杂交(FISH)检测,17例检测结果为阴性,4例存在Bcl-6或Bcl-2基因易位,未发现双重打击淋巴瘤(DHL)病人。17例病人应用R-EPOCD方案化疗(A组),16例应用R-CDOP方案化疗(B组)。
1.2纳入及排除标准
纳入标准:①病人年龄18~75岁;②初次诊断、符合WHO淋巴瘤分类标准(2016版)[2],组织病理学证实为DLBCL;③免疫组织化学染色(ZHC)显示Myc≥40%,Bcl-2≥50%或Bcl-6≥50%;④至少有一处可测量病灶,病灶最长径≥1.5 cm或短径≥1.0 cm;⑤主要脏器(肝脏、肾脏、心脏、肺脏等)基本功能正常;⑥美国东部肿瘤协作组(ECOG)评分≤2分;⑦取得病人及家属知情同意。排除标准:①初次诊断前1年内曾确诊或治疗过非霍奇金淋巴瘤之外的恶性肿瘤;②初次诊断前2个月内接受过其他抗肿瘤治疗;③妊娠期及哺乳期妇女;④原发中枢神经系统淋巴瘤、原发睾丸淋巴瘤;⑤合并未控制的活动性感染(如感染活动性结核或人类免疫缺陷病毒等);⑥合并严重的未控制的疾病(如未控制的高血压、不稳定型心绞痛等)。
1.3治疗方法
1.3.1R-EPOCD方案①利妥昔单抗375 mg/m2第0天静脉泵入;②依托泊苷50 mg/m2第1~4天,长春新碱0.4 mg/m2第1~4天,多柔比星脂质体25 mg/m2第1天,以上3种药物混合后持续静脉滴注;③环磷酰胺750 mg/m2第5天静脉滴注;④泼尼松100 mg第1~5天口服。年龄>70岁的病人采用R-EPOCD减量方案,即依托泊苷、长春新碱两种药物均减量25%,余药物剂量及治疗时间不变。共有4例(23.5%)病人采用减量方案。
1.3.2R-CDOP方案①利妥昔单抗375 mg/m2第0天静脉泵入;②环磷酰胺750 mg/m2第1天,多柔比星脂质体25 mg/m2第1天,长春新碱1.4 mg/m2第1天,静脉滴注;③泼尼松100 mg第1~5天口服。
两种方案治疗均是每21 d为1个周期,化疗结束以后48 h病人均应用聚乙二醇化重组人粒细胞刺激因子(PEG-rhG-CSF,新瑞白)6 mg预防性升白细胞。
1.4疗效评估
所有病人在每周期化疗开始前均接受浅表淋巴结、消化系统、腹膜后淋巴结及泌尿系统彩色多普勒超声检查,行超声心动图和心电图及乳酸脱氢酶(LDH)、β2微球蛋白(β2-MG)、血常规、CD4计数、免疫球蛋白等指标检测。治疗3周期后和治疗结束行PET-CT或增强CT检查评估疗效。初次治疗存在骨髓累及的病人在治疗中期复查骨髓细胞学、流式细胞及骨髓病理。根据Cheson疗效评估标准,疗效分为完全缓解(CR)、部分缓解(PR)、稳定(SD)和进展(PD)等 [3]。
1.5不良反應
应用美国卫生及公共服务部常见不良反应事件评价标准(CTCAE,4.03版本),对所有病人治疗过程中出现的血液学和非血液学不良反应进行分级。
1.6随访
通过病案系统或电话进行随访。随访截止时间为2019年9月1日,中位随访时间为13(4~33)个月。总生存期(OS)定义为从初次化疗开始至死亡或随访截止时间。无进展生存期(PFS)定义为从初次化疗开始至复发、进展、死亡或随访截止时间。观察指标为CR率、PR率、总体反应率(ORR)、不良反应、OS和PFS。
1.7统计学方法
应用SPSS 23.0软件进行统计学分析,两组率的比较采用卡方检验或Fisher确切概率法;应用K-M法绘制生存分析曲线;应用Log-rank 进行单因素分析,用Cox回归模型对有意义的因素进行多因素分析。以P<0.05为差异有统计学意义。
2结果
2.1基线资料特征
本文33例DEL病人中60岁以下者占60.6%,大多为非生发中心(non-GCB)型(78.8%),分期较晚(Ⅲ期/Ⅳ期者占69.7%)。Myc和Bcl-2或Bcl-6共表达占60.6%,三者同时高表达占39.4%。根据国际预后指数(IPI)进行危险度分层,高中危及高危组病人与低危及低中危组比例的差异无统计学意义(51.5% vs 48.5%,P>0.05)。R-EPOCD组和R-CDOP组病人年龄、性别、分期、细胞起源、IPI评分等基线资料比较差异无显著性(P>0.05)。见表1。
2.2近期疗效
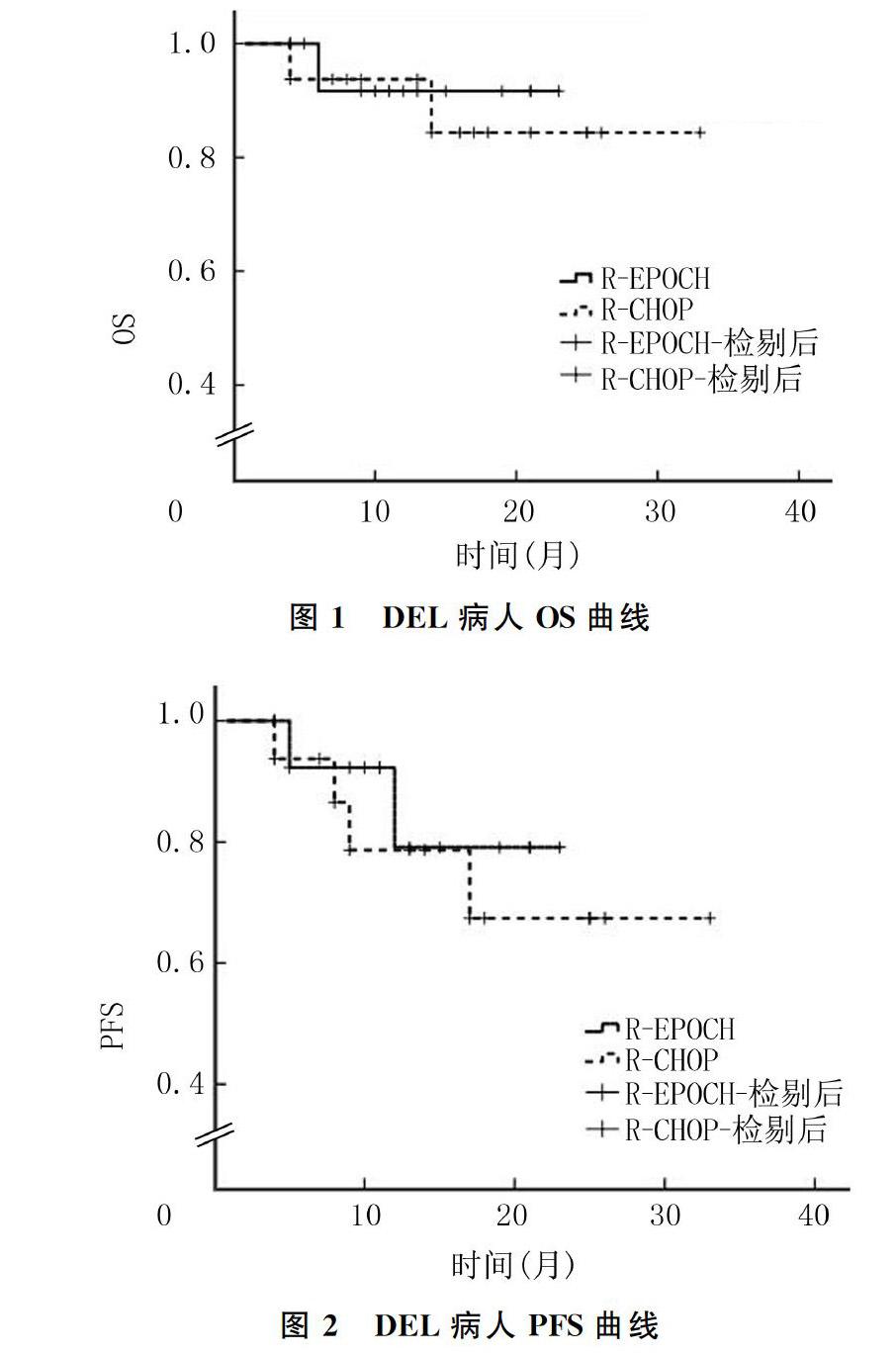
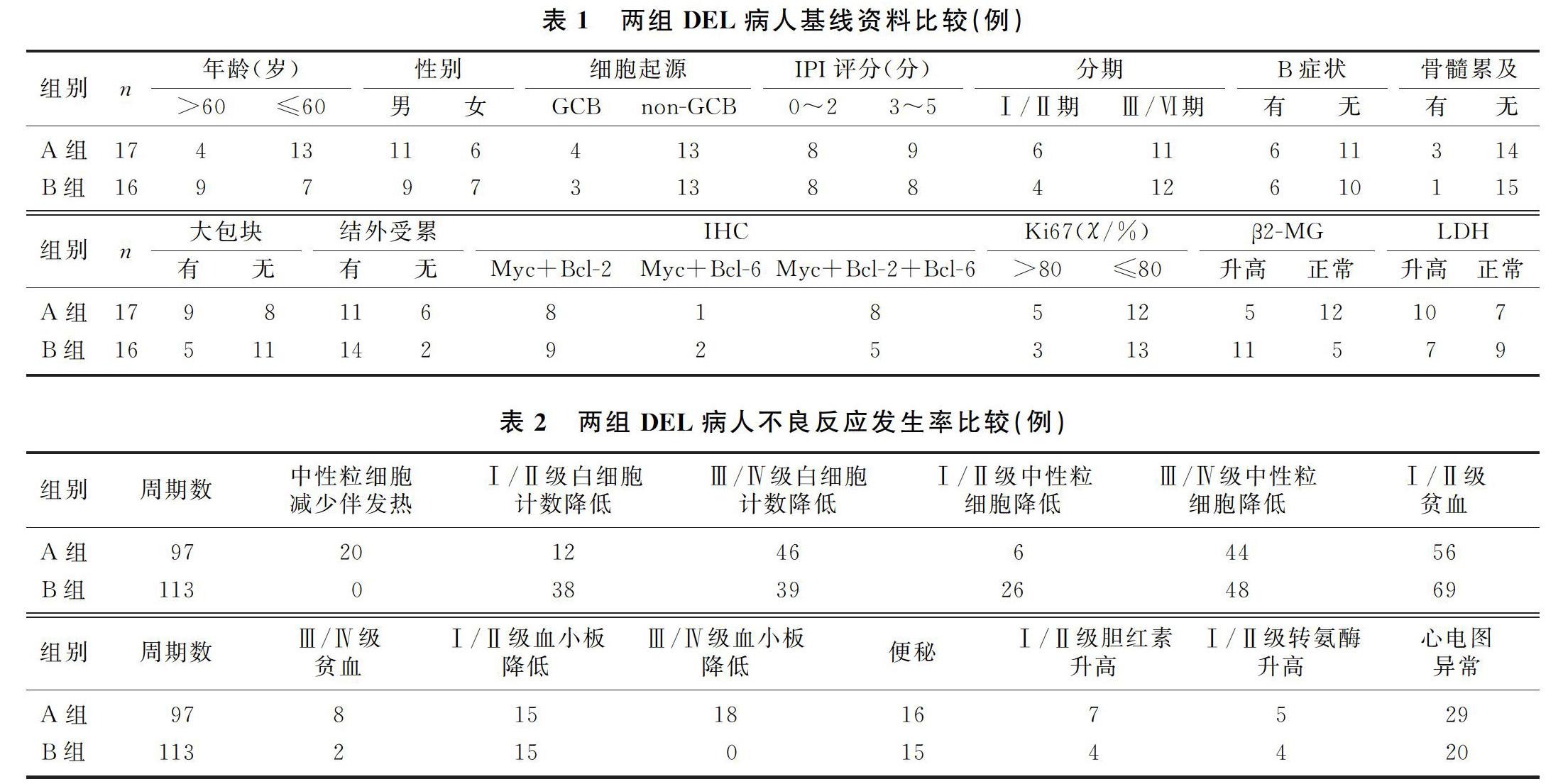
R-EPOCD组和R-CDOP组分别有13例(其余4例尚未进行影像学检查)和15例(其余1例尚未进行影像学检查)可评估疗效。两组的ORR均为100%。R-EPOCD组CR率为84.6%(11/13),PR率为15.4%(2/13);R-CDOP组CR率为60.0%(9/15),PR率为40.0%(6/15),R-EPOCH组CR率高于R-CDOP组,但差异无显著性(χ2=2.068,P=0.221)。中位随访时间13个月,R-EPOCD组病人平均生存时间为21.583(95%CI=18.925~24.242)个月,明显短于R-CDOP组的平均生存时间29.406(95%CI=24.791~34.022)个月。Log-rank检验显示,两组OS差异无显著性(χ2=0.133,P>0.05)(图1)。R-EPOCD组6个月OS率为91.7%,R-CDOP组为91.9%(P>0.05)。两种疗法6、12、24个月OS率差异无显著性(P>0.05)。R-EPOCD组病人平均PFS为20.165(95%CI=16.616~23.713)个月,而R-CDOP组平均PFS为25.698(95%CI=19.673~31.724)个月,两组PFS比较差异无统计学意义(χ2=0.388,P>0.05)(图2)。R-EPOCD组12个月PFS率为79.1%,R-CDOP组为74.5%,两组比较差异无显著性(P>0.05)。Log-rank分析显示,R-CDOP组年龄≤60岁病人的PFS高于年龄>60岁病人(P=0.030),IPI评分0~2分病人的PFS高于3~5分病人(P=0.030)。
将全部DEL病人纳入分析,结果显示,LDH升高、有B症状、骨髓受累是影响DEL病人OS的危险因素(P=0.007~0.041);分期、IPI评分、骨髓受累是影响PFS的危险因素(P=0.026~0.045)。
2.4不良反应
本文33例病人共完成210个周期化疗,其中R-EPOCD组病人完成97个周期化疗,R-CDOP 组病人完成113个周期化疗。R-EPOCD组主要不良反应为Ⅰ/Ⅱ度贫血(57.7%)和Ⅲ/Ⅳ度白细胞减少(47.4%),与R-CDOP组比较差异均无统计学意义(P>0.05)。余不良反应均较为轻微。R-EPOCD组发热伴中性粒细胞减少发生率为20.6%,显著高于R-CDOP组(P=0.000)。两组均未出现严重肝、肾功能不全。两组治疗完成率比较差异无统计学意义(94% vs 100%,P>0.05)。见表2。
3讨论
DLBCL是一种临床特征、分子遗传等方面异质性较强的淋巴瘤,其中DEL占DLBCL的30%[4]。DEL具有诸多预后不良因素,如年龄大于60岁、分期多为Ⅲ/Ⅳ期、ECOG评分差、多个结外器官受累等[5]。本研究中Ⅲ/Ⅳ期病人占69.7%,结外受累占75.8%,LDH升高占51.5%,与HU等[6]报道一致,但本研究DEL病人以60岁以下病人为主。国外研究显示,应用R-CHOP方案治疗DEL病人5年OS和PFS仅为30%[6]。目前无统一的、标准的DEL治疗方案。
1991年,LAI等[7]体外研究发现持续的低浓度药物暴露可以逆转肿瘤细胞抗药性。美国国家研究所(NCI)根据此发现设计了持续静脉滴注96 h的EPOCH(依托泊苷、泼尼松、长春新碱、环磷酰胺、多柔比星)方案,应用于初治高危的B细胞淋巴瘤以及复发/难治的B细胞淋巴瘤均取得了良好的疗效及安全性[8-11]。相关研究应用R-EPOCH方案治疗DHL取得了一定效果[1,12-13],因此国内外学者尝试应用R-EPOCH方案治疗DEL。刘薇等[14]应用R-EPOCH方案治疗27例DEL病人取得良好近期疗效,总体有效率为96.3%,CR率74.1%,PR率22.2%,预计病人2年PFS和OS均在80%以上。ZHANG等[15]的回顾性研究结果显示,R-EPOCH相对于R-CHOP方案并未使DEL病人增加获益。BARTLETT等[16]研究认为,R-EPOCH方案不能改善DEL病人(n=42)的PFS和OS。本研究显示,R-EPOCD和R-CDOP方案治疗病人的OS和PFS差异均无显著性,与相关研究结果一致。由于目前研究纳入病例数量有限且大多为回顾性研究,关于R-EPOCH方案治疗DEL的效果需要大样本、前瞻性临床试验进一步探讨。
本研究对210个化疗周期不良反应进行评估,结果显示,R-EPOCD组发热伴中性粒细胞减少发生率为20.6%,两组Ⅲ/Ⅳ度白细胞计数降低和Ⅲ/Ⅳ度中性粒细胞计数降低发生率差异无显著性,与相关研究结果不一致[16]。其原因可能与本研究中R-EPOCD组预防性应用PEG-rhG-CSF有关[17-18]。本文结果显示,R-EPOCD组Ⅲ/Ⅳ度贫血及Ⅲ/Ⅳ度血小板降低发生率显著高于R-CDOP组,说明R-EPOCD组骨髓抑制程度相对较重;R-EPOCD组心电图异常发生率高于R-CDOP组,但均为轻度异常且未发生致命性心律失常、心力衰竭,考虑与多柔比星脂质体的应用有关。
近年来人们对DHL、DEL预后不良的因素及机制进行了研究。HU等[6]研究发现Myc/Bcl-2型DEL常见于non-GCB亚型,而DHL从细胞起源上来说常见于GCB亚型。STAIGER等[19]研究显示,non-DEL病人non-GCB亚型预后差于GCB亚型,而DEL病人中GCB亚型预后差于non-GCB亚型。提示DEL可能存在与DHL不同的发病机制,仅根据细胞起源分类不能识别预后较差的亚型。Myc/Bcl-2蛋白型DEL可以通过Myc/Bcl-2基因重排之外的机制,如NF-κB途径,导致Myc/Bcl-2蛋白过表达[20]。JOHNSON等[21]认为Myc/Bcl-2双表达的DLBCL预后优于Myc/Bcl-2单表达者,Myc/Bcl-2同时表达导致DEL的不良预后。YE等[22]研究发现,Myc/Bcl-6型DEL比Myc/Bcl-2型DEL预后好,Myc/Bcl-2/Bcl-6三表达与Myc/Bcl-2双表达相比并未增加不良预后。
综上所述,DEL预后不良。R-EPOCD方案较R-CDOP方案提高了DEL病人的CR率,由于样本量较少PFS和OS无明显延长,未来需扩大样本量进一步研究。R-EPOCD方案中多柔比星脂質体以及新瑞白的应用有利于病人耐受化疗,心脏、肝脏、肾脏等化疗毒性无明显增加,感染机会亦未明显增加,几乎所有病人均可完成既定治疗计划。由于本文为回顾性临床研究且样本量较小,日后仍需要大样本、前瞻性、多中心临床试验进一步探讨更为有效的治疗方案。
[参考文献]
[1]OKI Y, NOORANI M, LIN P, et al. Double hit lymphoma: the MD Anderson Cancer Center clinical experience[J]. British Journal of Haematology, 2014,166(6):891-901.
[2]SWERDLOW S H, CAMPO E, PILERI S A, et al. The 2016 revision of the World Health Organization classification of lymphoid neoplasms[J]. Blood, 2016,127(20):2375-2390.
[3]CHESON B D. Staging and response assessment in lymphomas: the new Lugano classification[J]. Chinese Clinical Onco-logy, 2015,4(1):5.
68青島大学学报(医学版)57卷
[4]AUKEMA S M, SIEBERT R, SCHUURING E, et al. Double-hit B-cell lymphomas[J]. Blood, 2011,117(8):2319-2331.
[5]MOHAMMED A A, RASHED H E, ABDELRAHMAN A E, et al. C-MYC and BCL2: correlation between protein over-expression and gene translocation and impact on outcome in diffuse large B cell lymphoma[J]. Asian Pacific Journal of Cancer Prevention: APJCP, 2019,20(5):1463-1470.
[6]HU S M, XU-MONETTE Z Y, TZANKOV A, et al. MYC/BCL2 protein coexpression contributes to the inferior survival of activated B-cell subtype of diffuse large B-cell lymphoma and demonstrates high-risk gene expression signatures: a report from The International DLBCL Rituximab-CHOP Consortium Program[J]. Blood, 2013,121(20):4021-4031.
[7]LAI G M, CHEN Y N, MICKLEY L A, et al. P-glycoprotein expression and schedule dependence of adriamycin cytotoxicity in human colon carcinoma cell lines[J]. International Journal of Cancer, 1991,49(5):696-703.
[8]WILSON W H, JUNG S H, PORCU P, et al. A Cancer and Leukemia Group B multi-center study of DA-EPOCH-rituximab in untreated diffuse large B-cell lymphoma with analysis of outcome by molecular subtype[J]. Haematologica, 2012,97(5):758-765.
[9]WILSON W H, GROSSBARD M L, PITTALUGA S, et al. Dose-adjusted EPOCH chemotherapy for untreated large B-cell lymphomas: a pharmacodynamic approach with high efficacy[J]. Blood, 2002,99(8):2685-2693.
[10]WILSON W H, DUNLEAVY K, PITTALUGA S, et al. Phase Ⅱ study of dose-adjusted EPOCH and rituximab in untreated diffuse large B-cell lymphoma with analysis of germinal center and post-germinal center biomarkers[J]. Journal of Clinical Oncology: Official Journal of the American Society of Clinical Oncology, 2008,26(16):2717-2724.
[11]WILSON W H, BRYANT G, BATES S, et al. EPOCH chemotherapy: toxicity and efficacy in relapsed and refractory non-Hodgkins lymphoma[J]. Journal of Clinical Oncology: Official Journal of the American Society of Clinical Oncology, 1993,11(8):1573-1582.
[12]PETRICH A M, GANDHI M, JOVANOVIC B, et al. Impact of induction regimen and stem cell transplantation on outcomes in double-hit lymphoma: a multicenter retrospective analysis[J]. Blood, 2014,124(15):2354-2361.
[13]HOWLETT C, SNEDECOR S J, LANDSBURG D J, et al. Front-line, dose-escalated immunochemotherapy is associated with a significant progression-free survival advantage in patients with double-hit lymphomas: a systematic review and meta-analysis[J]. British Journal of Haematology, 2015,170(4):504-514.
[14]刘薇,李健,黄文阳,等. 剂量调整的EP(D)OCH方案联合利妥昔单抗治疗新诊断双表达淋巴瘤的疗效分析[J]. 中华血液学杂志, 2017,38(6):548-551.
[15]ZHANG X Y, LIANG J H, WANG L, et al. DA-EPOCH-R improves the outcome over that of R-CHOP regimen for DLBCL patients below 60 years, GCB phenotype, and those with high-risk IPI, but not for double expressor lymphoma[J]. Journal of Cancer Research and Clinical Oncology, 2019,145(1):117-127.
[16]BARTLETT N L, WILSON W H, JUNG S H, et al. Dose-adjusted EPOCH-R compared with R-CHOP as frontline the-rapy for diffuse large B-cell lymphoma: clinical outcomes of the phase Ⅲ intergroup trial alliance/CALGB 50303[J]. Journal of Clinical Oncology: Official Journal of the American Society of Clinical Oncology, 2019,37(21):1790-1799.
[17]李洋,赵倩,马倩文,等. R-EPOCH在初治MYC/Bcl-2双表达弥漫大B细胞淋巴瘤患者的疗效分析[J]. 临床血液学杂志, 2019,32(4):517-520.
[18]黄慧强,白冰,高玉环,等. 应用聚乙二醇化重组人G-CSF预防淋巴瘤患者化疗后中性粒细胞减少: 一项前瞻、多中心、开放性临床研究[J]. 中华血液学杂志, 2017,38(10):825-830.
[19]STAIGER A M, ZIEPERT M, HORN H, et al. Clinical impact of the cell-of-origin classification and the MYC/ BCL2 dual expresser status in diffuse large B-cell lymphoma treated within prospective clinical trials of the German high-grade non-Hodgkins lymphoma study group[J]. Journal of Clinical Oncology: Official Journal of the American Society of Clinical Oncology, 2017,35(22):2515-2526.
[20]DUNLEAVY K. Aggressive B cell lymphoma: optimal therapy for MYC-positive, double-hit, and triple-hit DLBCL[J]. Current Treatment Options in Oncology, 2015,16(12):1-11.
[21]JOHNSON N A, SLACK G W, SAVAGE K J, et al. Concurrent expression of MYC and BCL2 in diffuse large B-cell lymphoma treated with rituximab plus cyclophosphamide, doxorubicin, vincristine, and prednisone[J]. Journal of Clinical Oncology: Official Journal of the American Society of Clinical Oncology, 2012,30(28):3452-3459.
[22]YE Q, XU-MONETTE Z Y, TZANKOV A, et al. Prognostic impact of concurrent MYC and BCL6 rearrangements and expression in de novo diffuse large B-cell lymphoma[J]. Oncotarget, 2016,7(3):2401-2416.
(本文編辑 黄建乡)
