黄瓜白粉病菌在不同抗性黄瓜材料上的侵染过程
2021-04-30高启帆孙敬贤王刚何欢乐蔡润潘俊松
高启帆 孙敬贤 王刚 何欢乐 蔡润 潘俊松


关键词黄瓜;黄瓜白粉病菌;抗病基因;侵染过程
黄瓜.为葫芦科Cucurbitace-ae蔬菜,自20世纪70年代以来,我国黄瓜的栽培面积与总产量始终位居世界第一。由于气候和种植环境等原因,黄瓜在生产过程中会受到许多病害的危害,其中白粉病是最为严重的真菌病害之一。白粉病的潜育期较短,可以频繁侵染,具有很强的流行性,在一定条件下可以周年发生,给黄瓜生产带来巨大经济损失。引起黄瓜等葫芦科作物白粉病的病原真菌共有6种,其中主要病原菌是单囊壳白粉菌Sphaerotheca fuliginea和二孢白粉菌Erysiphe ci-choracerum。这两种白粉病菌寄主范围广泛,可引起多种葫芦科作物如黄瓜和甜瓜发病,我国黄瓜白粉病致病菌以S.fuliginea为主。
白粉菌是活体寄生菌。在我国南方,病菌以分生孢子或菌丝的形式在寄主上越冬,成为次年侵染源。分生孢子随气流、雨水等传播到寄主叶片上,孢端产生芽管从叶片表皮侵入,产生吸器从寄主吸收营养。分生孢子从萌发到侵染寄主需24h,3~5d后可于侵染处形成白色病斑,7d后可以形成分生孢子,作为新的侵染源再次传播。国内外学者对小麦、葡萄白粉病的组织病理学研究较多。张军科等对葡萄不同抗性品种的白粉菌侵染过程进行了研究,发现在接种3d后出现了差异:感病植株的叶片表面菌丝数量急速增加,并在叶片上表现出白粉症状;而在抗病植株的叶片表面,菌丝数量增加缓慢,不表现出白粉症状。并且研究发现,白粉病菌可以在感病材料上完成整个侵染过程。初庆刚通过超薄切片法以及透射电镜技术观察超微结构时发现白粉菌在抗病和感病小麦品种的表皮细胞内均能形成完整的吸器结构,其中在高感品种中均能成功侵染,只要病原菌成功侵入,均能形成吸器以及其他结构;而在中抗品种中可以观察到不成功的侵染案例,即病原菌在侵入后却未能形成完整的吸器结构。莫熙礼等通过分析白粉菌侵染后不同抗性辣椒品种上防御酶活性的变化以及白粉菌与辣椒互作机制的研究,发现白粉菌接种辣椒12h后分生孢子萌发,进而产生芽管以及附着胞,在24h后形成菌丝,并且分布在菌丝周边的一些蜡质组织逐渐被溶解,120h后菌丝上出现分生孢子梗。
黄瓜白粉病抗性受多个抗性位点控制,但是大部分研究仅限于QTL定位,目前只有隐性抗病基因pm5.1(CsML01)被成功克隆并进行了功能验证。近期本研究组成功克隆了另一个白粉病抗性基因PM5.2,为显性抗病基因,并通过转基因黄瓜对其功能进行了验证(未发表)。因此,為了研究不同抗性遗传背景下黄瓜对白粉病的抗性,本研究选取4种遗传背景共7份黄瓜自交系,进行白粉病抗性鉴定,分析其对白粉病抗性的差异。同时,为了研究白粉菌对黄瓜叶片的侵染过程及不同时间点的生长状态,我们将白粉菌分生孢子接种到这7份黄瓜自交系叶片上,观察病原菌在不同抗性的黄瓜材料上的侵染差异,进一步推测pm5.1和PM5.2的遗传关系,为揭示黄瓜抗白粉病分子机制奠定基础。
1材料与方法
1.1材料
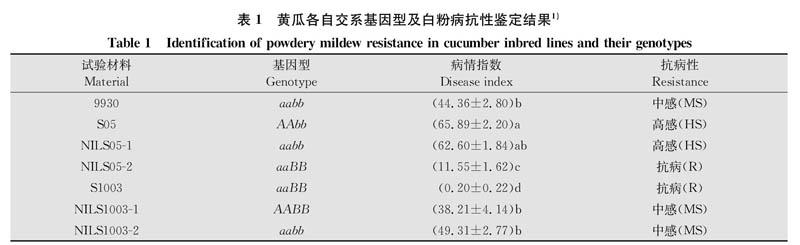
本研究的黄瓜材料均为自交纯系,由上海交通大学农业与生物学院黄瓜课题组提供。‘S05‘NILS05-1和‘NILS05-2为欧洲温室型黄瓜。‘9930‘S1003‘NILSl003-1和‘NILSl003-2为华北类型黄瓜。这7份材料的PM5.1/Pm5.1(简称A/a)和PM5.2/pm5.2(简称B/b)基因型见表1。‘NILS05-1和‘NILS05-2是‘S05的近等基因系,‘NILS05-1中原‘S05的PM5.1(显性)位点被‘S1003的pm5.1(隐性)位点代换;‘NILS05-2中原‘S05的PM5.1和pm5.2位点分别被‘s1003的pm5.1和PM5.2代换。‘NILS1003-1和‘NILSl003-2是‘S1003的近等基因系,‘NILS1003-1中原‘S1003的pm5.1位点代换成‘S05的PM5.1;‘NILSl003-2中原‘S1003的PM5.2位点代换成‘S05的pm5.2。
黄瓜白粉病菌采集自田间发病黄瓜植株,接种到感病自交系‘S05植株上,并在5 000 lx,光周期L//D=16h//8h培养箱中通过连续单斑分离3次的方式进行纯化和繁殖。
1.2黄瓜对白粉病抗病性鉴定
将黄瓜种子播种于营养钵中,浇足营养液并置于光照培养箱中培养,培养环境为白天25℃/夜晚20℃,光周期L//D=16h//8h。待幼苗长至3片真叶时进行接种。采用孢子悬浮液喷雾接种法。选取自然条件下严重感病的黄瓜植株,从叶片上收集白粉菌,用毛笔将新鲜的白粉菌孢子收集到盛有无菌水的锥形瓶中,加入1滴吐温-20。用血球计数板计数孢子悬浮液的浓度,将分生孢子悬浮液浓度调整为1×10。个/mL。用手持喷雾装置将孢子悬浮液均匀喷洒到黄瓜叶片。病情指数统计参考Morishita的研究方法。接种后保持较高湿度48h,15d后调查发病情况。白粉病的发病情况划分为5个等级:0级,没有可见的白粉病菌感染症状;1级,少于6%的叶面积感染;2级,6%~25%的叶面积感染;3级,26%~50%的叶面积感染;4级,50%以上的叶面积感染。每个材料调查6株,共3次重复。病情指数(DD计算公式为:
1.3分生孢子在不同抗性黄瓜自交系上的萌发过程观察
1.3.1黄瓜白粉病菌孢子接种
接种方法同1.2。在接种后0、6、12、24、48、72、96、120h,用打孔器在叶片上分别取样,将叶盘放于10mL离心管中。每个处理的材料各取3株,每株选取一个叶片,一个叶片上取3个叶盘,共9次重复。
1.3.2叶盘染色及显微观察
利用台盼蓝染色法对叶盘进行染色。用镊子将染色后的叶盘夹到载玻片上,正面朝上,然后盖上盖玻片。在10×40倍或10×20倍显微镜下观察黄瓜白粉病菌孢子在不同时间点的萌发状态。每个处理各观察3株,每株观察3个叶盘,共9次重复。每个叶盘至少观察20个孢子。
1.4分生孢子在不同抗性黄瓜自交系上的萌发率及正常生长的比例
根据孢子的萌发进程观察发现,在接种后12h,黄瓜白粉病菌孢子的萌发形态最易于观察;接种后48h,菌丝正常生长的形态最为明显;接种后96h,菌丝形成明显的菌落。因此,本研究在接种12h后统计孢子萌发率,萌发率=视野内萌发孢子数/视野内孢子总数×100%;接种48h后统计菌丝形成率,菌丝形成率=视野内形成菌丝的孢子数/视野内孢子总数×100%;接种96h后统计菌落形成率,菌落形成率=视野内形成的菌落数/视野内孢子总数×100%。侵染方法及观察方式同1.3.2。每个处理各观察3株,每株观察3个叶盘,每个叶盘观察3个视野,共9次重复。
2结果与分析
2.1黄瓜自交系抗病性鉴定
7份黄瓜自交系的白粉病抗性鉴定结果(表1)显示,基因型为AAbb的‘S05病情指数最高,达到65.89,表现为高感白粉病;‘NILS05-1的病情指数略低于‘S05,也表现为高感白粉病,可能存在其他微效基因影响其对白粉病的抗性;基因型为aabb的黄瓜自交系‘NILS1003-2与‘9930均表现为中感白粉病,病情指数比较接近,且均低于‘S05;基因型为AABB的‘NILS1003-1的病情指数略低于基因型为aabb的黄瓜材料,但仍高达38.21。肉眼观察无法区分‘NILS1003-1与‘9930之间的抗性差异。基因型为aaBB的黄瓜材料病情指数最低,表现为抗白粉病。
2.2分生孢子在不同黄瓜自交系上的侵染过程
2.2.1黄瓜白粉病菌在‘9930(aabb)自交系上的侵染过程
黄瓜‘9930自交系植株接种黄瓜白粉病菌孢子后,6h可以观察到孢子萌发形成初生芽管(primarygerm tube,PGT);12h可观察到附着胞(appresso-rium,App);24h在附着胞的顶端形成侵染钉(pen-etration peg,Pp);48h形成菌丝,菌丝在叶片表面扩展;96h可以观察到菌落(fungal colony,FC)的形成;120h菌丝上形成分生孢子梗(conidiophore,Cdp),产生新的分生孢子,表明黄瓜白粉病菌孢子完成其无性生长周期(图1)。
2.2.2黄瓜白粉病菌在‘S05(AAbb)及其近等基因系‘NILS05cc1(aabb)与‘NILS05-2(aaBB)上的侵染过程
如图2所示,在‘S05自交系接种黄瓜白粉病菌孢子后6h可以观察到孢子萌发形成初生芽管(PGT);12h可观察到附着胞(App);24h在附着胞的顶端形成侵染钉(Pp);48h形成菌丝,菌丝在叶片表面扩展;72h可以观察到菌落(FC)的形成;96h菌丝上开始形成分生孢子梗产孢;120h分生孢子梗(Cdp)的数量明显增多,孢子可以完成其无性生长周期。黄瓜白粉病菌在‘S05的感病近等基因系‘NILS05-1(aabb)上的生长过程与‘S05相似,但稍慢于‘S05,接种6h可以观察到少量孢子萌发形成初生芽管(PGT);12h可观察到附着胞(App);24h在附着胞的顶端形成侵染钉(Pp);48h形成菌丝,菌丝依旧开始在叶片表面扩展,但是相对‘S05速度较慢;96h可以观察到菌落(FC)的形成;120h可以观察到分生孢子梗(Cdp)的形成,孢子可以完成其无性生长周期。‘S05的抗病近等基因系‘NILS05-2(aaBB)在接种后12h可观察到少量孢子萌发形成初生芽管(PGT);24h有极少数孢子形成附着胞(App)以及侵染钉(Pp),大部分孢子还停留在初生芽管形成阶段;在接种后48、72、96h一直停留在附着胞阶段;大部分孢子停止生长,极少数孢子形成侵染钉,但是长势较弱;120h才可以观察到极少数孢子形成菌丝,视野内未见真菌菌落(FC)及分生孢子梗(Cdp),表明黄瓜白粉病菌孢子在抗病自交系上无法完成其无性生长周期。
2.2.3黄瓜白粉病菌在‘S1003(aaBB)及其近等基因系‘NILSl003-1(AABB)与‘NILSl003-2(aabb)上的侵染过程
在黄瓜白粉病菌接种于‘S1003(aaBB)后12h,孢子才开始萌发,可观察到少量孢子萌发形成初生芽管(PGT);24h有极少数孢子形成附着胞(APP)以及侵染钉(Pp),大部分孢子还停留在初生芽管形成阶段;在接种后48、72、96h白粉菌一直停留在附着胞阶段;大部分孢子停止萌发,极少数孢子形成侵染钉;在白粉菌侵染120h后才可以观察到极少数孢子形成菌丝,视野内未见真菌菌落(FC)及分生孢子梗(Cdp),表明白粉菌孢子在抗病自交系‘S1003上无法完成其无性生长周期。黄瓜白粉病菌在‘S1003的感病近等基因系‘NILSl003-1与‘NILSl003-2上的生长过程相似,接种后6h可以观察到少量白粉菌孢子萌发形成初生芽管(PGT);12h可觀察到附着胞(App);24h在附着胞的顶端形成侵染钉(Pp);48hN成菌丝,菌丝在叶片表面扩展;96h可以观察到菌落(FC)的形成;120h可以观察到分生孢子梗(cdp)的形成,产生新的分生孢子,表明黄瓜白粉病菌孢子完成了其无性生长周期(图3)。
2.3不同抗性黄瓜材料上白粉病菌的侵染分析
2.3.1不同基因型黄瓜材料上孢子萌发率的比较
孢子萌发率的统计结果(图4)显示,在接种黄瓜白粉病菌孢子后12h,感病自交系‘S05(AAbb)叶片上孢子萌发率最高,为(35.67±6.35)%,显著高于‘NILS05-1(aabb)与‘NILS05-2(aaBB)上的萌发率,且‘S05感病近等基因系‘NILS05-1上的萌发率显著高于其抗病近等基因系‘NILS05-2上的萌发率;‘S1003(aaBB)上的萌发率为(6.61±0.98)%,显著低于其感病自交系‘NILSl003-1(AABB)与‘NILS1003-2(aabb),且‘NILSl003-1与‘NILS1003-2上的萌发率之间没有显著差异;‘9930(aabb)上的孢子萌发率为(28.14±7.1)%,显著低于‘S05上的孢子萌发率,显著高于‘S1003与‘NILS05-2上的萌发率,与‘NILS05-1‘NILSl003-2‘NILSl003-1之间没有显著差异。
2.3.2不同基因型黄瓜材料上白粉菌菌丝形成率的比较
孢子菌丝形成率统计(图5)显示,在接种黄瓜白粉病菌后24h,感病自交系‘S05(AAbb)叶片上菌丝形成率最高,为(33.9±5.62)%,显著高于‘NILS05-1(aabb)与‘NILS05-2(aaBB)上的菌丝形成率,且‘S05感病近等基因系‘NILS05-1上的菌丝形成率显著高于其抗病近等基因系‘NILS05-2上的菌丝形成率;‘S1003(aaBB)上的菌丝形成率为(6.14±1.94)9/6,显著低于其感病自交系‘NILSl003-1(AABB)与‘NILS1003-2(aabb),且‘NILS1003-1与‘NILS1003-2上的菌丝形成率之间没有显著差异;‘9930(aabb)上的菌丝形成率为(27.9±9.71)%,显著低于‘S05上的菌丝形成率,显著高于‘S1003与‘NILS05-2上的菌丝形成率,与‘NILS05-1‘NILS1003-2‘NILS1003-1之间没有显著差异,这与孢子萌发率观察结果一致。
2.3.3不同基因型黄瓜材料上白粉菌菌落形成率的比较
菌落形成率显示(图6),在接种黄瓜白粉病菌后72h,感病自交系‘S05(AAbb)叶片上菌落形成率最高,为(68.26±17.74)%;其余感病自交系(包括aabb和AABB)上的菌落形成率次之,其中,‘9930为(46.73±10.45)9/6,‘NILS05-1为(45.5±9.72)%,‘NILS1003-2为(33.8±7.21)%,‘NILSl003-1为(32.19±9.13)%;抗病自交系(aaBB)‘NILS05-2和‘S1003叶片上的菌落形成率分别为(2.89±0.38)%和(2.64±0.98)%,低于感病自交系的菌落形成率。差异显著性分析表明,在接种白粉菌后72h,感病自交系‘S05(AAbb)菌落形成率最高,并且显著高于其他自交系,表明‘S05的感病程度就菌落形成率而言在所测自交系中是最高的;基因型为aabb以及AABB的感病自交系叶片上孢子的菌落形成率也显著高于抗病自交系,但是基因型为AABB以及aabb的感病自交系之问的菌落形成率差异不显著,与孢子萌发率观察结果以及菌丝形成率结果一致。
3讨论
本文通过幼苗人工接种黄瓜白粉病菌,鉴定了不同基因型黄瓜材料对白粉病的抗性水平,并观察了白粉病菌在不同抗感黄瓜材料上的侵染过程。由于白粉病的发病情况易受环境影响,因此试验材料均在人工培养箱中培养,在人工接种之前保证供试材料不受外界白粉病菌的影响。
目前已有白粉菌在小麦和番茄上生长过程的研究,但是白粉菌在黄瓜上的侵染和生长过程的研究还未见报道。本试验观察的时间与Jankovics相似,共8个时间点。结果显示,当感病品系接种白粉菌后12h,孢子可以产生芽管,24h形成菌丝,48h菌丝开始扩展,72h形成菌落,96h出现分生孢子梗,120h分生孢子梗的数量明显变多。这与郭卫丽等对白粉菌侵染南瓜的结论一致,也与王吉霞所报道的白粉菌可在5d内完成其生长周期的结论一致。比较‘S05与其近等基因系‘NILS05-1(aabb)和‘NILS05-2(aaBB),‘S1003与其近等基因系‘NILSl003-1(AABB)和‘NILSl003-2(aabb)的白粉菌生长过程,发现当pm5.1和PM5.2位点均为纯合感病(AAbb)时,白粉菌孢子萌发率以及菌丝、菌落形成率最高;当其中一个基因纯合感病,另一个基因纯合抗病(aabb或AABB)时,虽表现为感病,但病情指数稍低,白粉菌孢子萌发率以及菌丝、菌落形成率降低;当pm5.1与PM5.2位点均为纯合抗病(aaBB)时,植株表现出抗病,病情指数较低,并且白粉菌在接种后24h停止生长,只有极少数形成菌丝,但也无法形成分生孢子梗,说明这2个抗性基因在诱导白粉病抗性方面都是不可或缺的。
周威在研究白粉菌的侵入对不同抗性南瓜品种的病理以及生理影响时发现:白粉菌的生长变化和品种的抗病性密切相关,这与本试验的研究结果一致。白粉菌孢子在感病黄瓜材料上有较高的萌发率,并且大部分都能正常生长,形成菌落,最終导致感病材料发病严重;在抗病材料上,白粉菌孢子萌发率较低,大部分孢子不能形成明显的菌落,表现为抗白粉病。Nie等对‘S1003以及‘S05中C5ML01基因的启动子顺式元件分析发现,启动子含有真菌的激发子与防御反应的响应元件,并且提出在黄瓜的pm5.1抗性过程中,胼胝质沉积等过程造成细胞壁加厚可能发挥了很重要的作用,一些基因的表达可能为寄主抵御白粉菌的侵染提供了物理或化学屏障,从而在细胞壁处阻止了病菌侵入寄主表皮细胞。因此推测,抗感材料在萌发率以及菌丝形成率上存在的差异可能与抗病基因诱导的信号传导以及细胞壁加厚有关。此外抗感材料上白粉菌菌落以及分生孢子梗形成的差异可能与白粉菌是否能成功侵入植株从而吸收营养有关,白粉菌成功侵入感病材料可以吸收寄主营养,从而完成生长周期,而在抗性材料中侵入失败导致营养供应不足,从而无法实现正常生长。本研究在抗性材料中也观察到极少数菌丝的扩展,可能与植株长势较弱有关,导致白粉菌能够成功侵染极少数部位,进而实现菌丝的生长。生产中,抗病植株生长后期的叶片上能够观察到白粉病斑也可以解释上述现象。此外,后期可进一步分析抗病表型与抗病基因表达量以及相关生理生化指标的关系,进一步分析抗病原因,以期更好的解释黄瓜对白粉病的抗性机制。
