NPR1结构与功能的研究进展
2021-04-29闫晓寒王向尧刘培源
闫晓寒 王向尧 刘培源


摘要:病程相关基因非表达子(non-expressor of pathogenesis-related genes 1,简称NPR1)作为植物激素水杨酸(SA)信号的主要调节因子,参与系统获得性抗性(systemic acquired resistance,简称SAR)的建立,在植物抵抗病原菌的侵染中起着重要作用。核内单体化的NPR1作为辅因子通过与转录因子的相互作用正向调控病程相关(pathogenesis-related,简称PR)基因的表达;NPR1的翻译后修饰与降解也增加了其调节机制研究的复杂性。此外,该蛋白的作用已扩展到对植物生长发育、昼夜节律稳态、内质网分泌相关蛋白以及抗冻等的调控。以NPR1调控建立SAR过程中的机制为重点,综述其结构特征以及各方面的重要功能,为NPR1蛋白在植物生命活动中潜在作用机制的研究提供参考。
关键词:NPR1;水杨酸;系统获得性抗性;结构与功能;PR基因
植物暴露在生物与非生物胁迫中,为维持自身的生长发育,进化形成了有效的防御机制用来感知和抵抗各种潜在的威胁。其中,为抵抗病毒、细菌和真菌等的侵染,植物形成了类似于动物的免疫系统。植物免疫系统主要包括2层防御机制,第1层是通过细胞膜上的受体识别病原相关分子模式(PAMPs)激发的免疫反应(PAMP triggered immunity,简称PTI)对抗病原菌入侵[1]。然而有些病原菌可产生效应因子抑制PTI,作为应对,植物进化出抗病蛋白(R蛋白),通过直接或间接的方式识别效应因子,进而引发第2层防御,即效应因子激发的免疫反应(effector triggered immunity,简称ETI)[2]。ETI通常会引发感染部位细胞的程序性死亡(programmed cell death,简称PCD)以阻止病原菌向周围组织扩散。植物不但会在感染部位通过PTI和ETI抵抗入侵,同时也会系统性激活并建立广谱的抵抗继发性感染的防御机制,即系统获得性抗性(systemic acquired resistance,简称SAR)[3]。
NPR1(non-expressor of pathogenesis-related genes 1,简称NPR1)是SAR途径中的关键调控因子[4],同时参与植物的生长发育[5-7]、昼夜节律稳态[8]、抗冻[9]以及内质网分泌相关蛋白[10-11]等的调控,在植物生命周期中发挥着重要作用,然而目前对于NPR1介导信号通路的具体机制还存在许多未知;同时,其同源蛋白NPR3、NPR4在SAR途径中的作用也存在争议。本文总结了多年来NPR1调控SAR建立机制的研究结果以及NPR1在其他方面的功能,试图对NPR1的功能提供一个全面的初步认识。
1 NPR1结构组成及各部分功能
NPR1蛋白包含BTB/POZ(broad-complex,tramtrack,and bric-a-brac/poxvirus and zinc-finger)结构域、锚蛋白重复序列(ankyrin repeats,简称ANK)结构域以及NPR1-like结构。序列比对显示,NPR1蛋白序列在多个物种间呈现出高度的一致性,结构的保守也预示着功能的相似(图1)。BTB/POZ结构域介导NPR1与其他蛋白的相互作用,以拟南芥为例,NPR1通过BTB/POZ结构域介导与乙烯受体蛋白(ethylene insensitive3,简称EIN3)相互作用,阻碍顶端弯钩的形成[7]。并且NPR1的BTB/POZ结构域可与自身C末端反式激活结构相互作用抑制其功能;当C末端C521和C529通过Cu2+与水杨酸(SA)结合后,引发NPR1构象改变,暴露出BTB/POZ结构域,激活NPR1与TGA转录复合体活性, 调控PR基因表达[4]。 但此
结构并不保守,微小的差異也为NPR1针对性参与不同生长环境下的物种独特的信号通路调控提供了可能。ANK结构域介导NPR1与TGA的相互作用,在ANK突变体中不能形成NPR1-TGA复合体,且无法诱导PR基因[12]。
除此之外,NPR1含有保守的半胱氨酸位点、SA结合位点以及核定位序列(NLS)。拟南芥NPR1包含10个高度保守的半胱氨酸,如C82、C156、C216等。NPR1主要通过半胱氨酸形成分子间二硫键以低聚体的形式存在于细胞质中[13];胁迫造成SA浓度升高,导致细胞处于氧化应激状态,进而产生大量抗氧化剂,硫氧还蛋白(TRX),尤其是TRX-h3与TRX-h5可还原NPR1位于156位的半胱氨酸(C156)促进NPR1低聚体的解聚[14-15]。单体化的NPR1通过NLS介导进入细胞核调控转录;同时SA诱导NPR1的C156亚硝基化,稳定了NPR1在细胞质的低聚形式,防止蛋白被过度消耗[15]。C82A/C216A双突变的NPR1二硫键形成受损,一定程度上提升了PR1基因的本底表达[14]。R432被认为是SA的直接相互作用位点,NPR1R432Q突变蛋白表现出极低的SA亲和力,在不影响其与TGA和NIMIN1(NIM互作蛋白)相互作用的情况下,NPR1R432Q突变植株SAR相关基因表达受损[4],进一步说明胞内SA诱导对于NPR1发挥作用的重要意义。
2 NPR1介导的SAR的作用与机制
2.1 NPR1参与调控有效SAR的建立
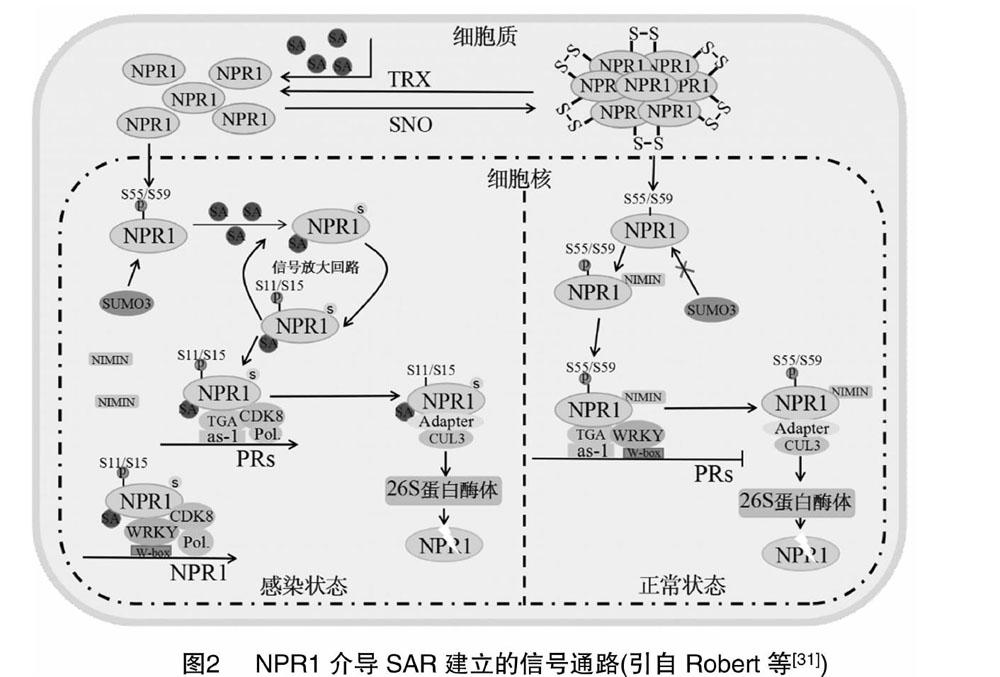
NPR1是SAR途径中的关键调控因子,NPR1功能缺陷植物的PR基因表达受损,并且几乎不能建立起有效的SAR。针对拟南芥的研究显示,为了建立有效的SAR以应对病原菌的感染,NPR1需要在细胞质和细胞核中被精细调控(图2)。由于NPR1不能直接与DNA相互作用,因此NPR1通常被作为转录辅因子参与调控。核定位的NPR1单体与bZIP家族的TGA转录因子直接相互作用形成转录复合体[16],增强了TGA转录因子结合DNA的能力[17]。PR1启动子含有正、负2种as-1-like顺式作用元件LS7和LS5[18],不同TGA转录因子与不同的顺式作用元件相互作用调控PR基因的表达,这表明NPR1也许不仅仅通过上调PR基因的表达来建立SAR。拟南芥基因组编码的10种TGA转录因子中7种在SA信号转导中起着正向或负向调控作用。TGA2、TGA5和TGA6在调节NPR1依赖基因的表达过程中功能冗余。tga6-1tga2-1tga5-1三敲除突变体在SA诱导的情况下PR基因表达量与野生型相比减少,但其本底表达相较野生型却升高了近50倍,这表明一些TGA在正常状态下可抑制PR基因的表达;在SA诱导下,通过与NPR1的相互作用,这种抑制作用被解除。除TGA外,TCP转录因子(TCP transcription factors,简称TFs)、WRKY与CDK8周期依赖激酶子转录因子也参与调控NPR1与PR基因的表达[19-20]。在拟南芥中,SA促进了NPR1与CDK8和WRKY6/18的相互作用。NPR1向自身启动子招募CDK8和WRKY6/18;此外,CDK8也可与TGA相互作用,NPR1向PR1启动子招募CDK8和TGA,并将RNA聚合酶Ⅱ带入启动子及编码区域,正调控NPR1和PR1的表达。但NPR1-TF蛋白复合物如何促进PR基因的表达需要进一步的研究来阐明。
另一组与NPR1相互作用的蛋白为NIMIN(nim interacting)蛋白[21],酵母三杂交结果证明NIMIN1通过直接与NPR1相互作用并与TGA形成三元复合物[22]。NIMIN蛋白序列分析表明其含有预测的EAR(基序)抑制结构域,因此可抑制NPR1转录活性[23]。NIMIN1、NIMIN2和NIMIN3与NPR1竞争性结合,在正常状态下,NIMIN3与NPR1相互作用抑制PR基因的表达;NIMIN2可迅速响应早期SA浓度的改变,尽管其不参与PR基因表达的抑制;NIMIN1可与NPR1相互作用推迟PR基因的表达,防止SAR被过早激活[24]。
2.2 NPR1的翻译后修饰对SAR的影响
NPR1的翻译后修饰在SAR过程中同样扮演着重要角色。拟南芥NPR1除C156的亚硝基化外,还存在泛素化(SUMO)修饰。Saleh等研究表明,SUMO3通过与NPR1的SIM基序(SUMO互作基序)直接相互作用对NPR1进行SUMO化修饰[25]。NPR1的SUMO化不但会促进NPR1的降解,同时也会改变NPR1对WRKY和TGA的亲和力。此外,NPR1不同部位的磷酸化也会对SUMO化修饰产生影响。
在正常状态下,NPR1的S55/S59被磷酸化,这抑制了NPR1的SUMO化,此时NPR1与WRKY70有较强的相互作用,抑制了PR1基因的表达,但依然有少量的NPR1被SUMO化以维持基础抗性[25]。SA积累后,NPR1的S55/S59去磷酸化,随后被SUMO化修饰,SUMO化后NPR1的S11/S15位点被磷酸化,在降低了NPR1与WRKY70亲和力的同时提升了其与TGA3的亲和力,随后PR1基因的表达量升高,经修饰的NPR1在行使完转录调控作用后被送往蛋白酶体降解[25]。NPR1的S55/S59去磷酸化和NPR1的SUMO化是S11/S15发生磷酸化所必需的,S11/S15的磷酸化反过来会促进NPR1与SUMO3的相互作用使更多的NPR1发生SUMO化,这形成了一个信号放大的回路[25]。
一些激酶参与了NPR1的磷酸化修饰。SnRK2.8(SNF-1相關蛋白激酶2.8)通过磷酸化NPR1的S589和T373促进其入核,感染部位周围的细胞通过感受SA浓度变化建立SAR,而对于远端组织,由于SA浓度变化较小,SAR主要通过SnRK2.8对NPR1的磷酸化来建立[26]。
2.3 NPR1的降解对SAR的影响
NPR1的精确激活和终止对于维持植物免疫系统功能、机体适应性和繁殖能力之间的平衡至关重要。正常状态下,少量单体化的NPR1在核内被降解以防止免疫系统被过度激活;在SA积累后,大量单体化的NPR1入核调控下游基因表达的同时这种降解现象依然存在,并且是建立完整有效的SAR所必需的,NPR1S11A/S15A突变的拟南芥中高水平NPR1S11A/S15A的积累可抑制SAR的建立[27-28],这表明NPR1的降解在植物免疫应答调控中的双重作用。NPR1的降解需要泛素连接酶Cullin3(CUL3)和信号复合体COP9的参与,与哺乳动物免疫辅助因子IκB一样,NPR1在降解之前也需要被磷酸化修饰[29]。介导NPR1被26S蛋白酶体降解的2个磷酸化修饰位点为DS11XXXS15(IκB-like phosphodegron motif,S11/S15)。部分研究显示,NPR1与CUL3并没有直接相互作用,因此NPR1的降解可能需要中间蛋白 (Adapter)的介导[27,30]。
Fu等研究表明,NPR1的同源蛋白NPR3和NPR4为SA的受体,并且NPR3和NPR4作为中间蛋白介导了NPR1的蛋白酶降解,在无SA的条件下,NPR4介导NPR1与CUL3相互作用,导致NPR1被持续降解,表现为植物对病原菌的易感性增强[30]。在正常状态下,少量SA的存在降低了NPR4与NPR1的相互作用,这使得NPR1可适当激活免疫基因的表达,以维持植物的基础抗性。在植物细胞遭受病原菌侵染后,处于感染部位的细胞中SA浓度升高,这时NPR3被SA激活从而介导NPR1与CUL3相互作用,这导致NPR1被大量降解,造成感染部位细胞死亡,同时在感染部位周围细胞中的SA浓度并不足以激活大量的NPR3,而NPR4又被相对高浓度的SA抑制了活性,核内大量NPR1单体通过与转录因子相互作用激活SAR。
3 NPR1参与调控植物生长发育
3.1 NPR1促进叶片的衰老
叶片衰老是一种程序性死亡过程,可将营养物质从衰老的叶片大量转移到快速发育的器官,从而促进植物生长发育。NPR1介导的SA信号通路正向调控叶片的衰老(图3),基因组研究表明,随着叶片衰老的进程,许多转录因子显著上调,如WRKYs[32]。WRKY75在叶片衰老中起正调控作用,其诱导SID2(SA合成基因)表达促进SA的生物合成;同时SA反向促进WRKY75的表达,形成信号放大回路,加速叶片衰老[33]。Chai等提出,在拟南芥叶片衰老中,MPK6介导SA诱导的WRKY6与Trx-h5的表达;WRKY6可与NPR1启动子W-box结合提高NPR1mRNA的表达水平,同时Trx-h5的表达能促进NPR1的单体化与入核[5]。烯丙苯噻唑(PBZ)可通过SID2依赖的生物合成途径提高内源性SA水平,外源施加PBZ的sid2和npr1突变株与野生型相比,没有明显的衰老症状;而过表达NPR1则能加剧叶片的衰老。因此,SA的积累和NPR1的存在是PBZ诱导叶片衰老所必需的。与Xing等观点不同的是,Zhou等认为,SA诱导的叶片衰老依赖于丝裂原活化蛋白激酶(MKK4/5-MPK1/2)级联反应,MPK1通过磷酸化NPR1并改变Trx-h3/5的表达能促进NPR1的单体化与入核,调控PR1基因转录[8]。NPR1调控SA诱导的叶片衰老的具体机制有待进一步验证。
3.2 NPR1抑制顶端弯钩形成
转录组学分析显示,部分SA诱导的基因表达水平在胚轴突出后升高,在子叶完全开放时达到高峰,说明SA参与幼苗早期形态发生[34]。Huang等研究显示,SA诱导的顶端弯钩形成抑制部分依赖于NPR1,对拟南芥施加外源SA会造成顶端弯钩弯曲度的降低,且随着SA施加浓度的升高,npr1突变体与野生型均表现出抑制作用的加强,但npr1突变体相比野生型抑制较弱[7]。EIN3和EIL1(EIN3-LIKE1)在乙烯通路正向调控顶端弯钩形成相关基因HLS1(HOOKLESS1,简称HLS1)等的表达[35]。NPR1介导的SA对顶端弯钩形成的抑制依赖于EIN3/EIL1,在乙烯不敏感的2个突变株ein2-5和ein3eil1中,SA浓度的增加对于顶端弯钩弯曲度没有明显改变;且npr1-1ein3eil1与ein3eil1中顶端弯钩的弯曲度没有明显差异[7]。NPR1通过BTB/POZ结构域可以与EIN3含有DNA结合域的N末端相互作用,从而破坏EIN3与自身靶基因启动子的结合,在不改变EIN3表达量的情况下抑制EIN3的转录活性,负向调控顶端弯钩形成(图3),也证实了NPR1介导SA-ET(水杨酸-乙烯)信号通路的交互作用[7]。
4 NPR1的其他功能
4.1 NPR1调节植物抗冻性
植物进化出了不同温度环境下的适应性,鉴定拟南芥冷胁迫下表达上调的基因发现,其中含有植物抵抗病原菌相关的PR基因[36]。作为调控PR基因的关键蛋白,NPR1在植物抗冻中的作用同样得到验证(图3)。有研究表明,冷胁迫可以诱导NPR1基因的表达和SA水平的升高,但sid2和 NahG这2种突变植株中NPR1的表达量与野生型植株相比没有变化,说明NPR1的表达不依赖于SA[9]。与SAR过程类似的是,升高的SA作用于NPR1的单体化,单体化和入核在抗冻相关基因诱导过程中是必需的,抑制单体化或入核的trx-h3trx-h5和snrk2.8-1突变株显示出抗冻性的降低;与NPR1调控SAR建立不同的是,抗冻调控过程中不需要NPR1的SUMO修饰以及S11/S15磷酸化。核内部分NPR1可与热休克转录因子(HSFA1)结合,调控热应激反应基因表达;同时,部分NPR1通过与未知转录因子结合调控冷胁迫诱导基因的表达,从而提高植物的抗冻能力。此外,冷处理可以在短时间内引起植物對病原菌Pst DC3000抗性的增加,进一步说明了NPR1介导的SA信号通路在SAR与抗冻调节过程中的协同关系[37]。
4.2 NPR1调控植物昼夜节律稳态
氧化还原状态的改变对于植物昼夜节律和与之相协调的免疫反应有重要的影响[38]。值得注意的是,由免疫信号SA触发的氧化还原状态的扰动不仅不损害昼夜节律,反而导致其强化[8]。此外,最近发现植物中SA的含量也存在节律性波动且NPR1单体水平在夜间达到峰值,因此,可能是内源SA波动控制NPR1节律性入核,进而调节相关基因来维持昼夜节律稳态[39]。Zhou等研究表明,SA积累会改变胞内氧化还原环境,并在不改变夜间基因TOC1(timing of CAB2 expression 1)周期表达规律的情况下提高其表达幅度,而npr1和trxh3trx-h5这2种突变体中TOC1表达幅度降低且对SA不敏感,证实了NPR1及其核定位在调控TOC1表达过程中的作用[8]。核内NPR1可以通过TGA与TOC1启动子结合,诱导其表达。与此同时,NPR1可以以相同的方式诱导日间基因LHY(late elongated hypocotyl)的表达,在昼夜节律调控中LHY与TOC1拮抗,这也解释了不同时段SA诱导下昼夜节律的稳定性。昼夜节律稳态在维持植物对病原菌在不同时段敏感性方面起着重要作用,与氧化还原、植物免疫一起协同调控使植物可以在夜间优先生长,而在病原菌威胁最大的清晨增强免疫。
4.3 NPR1参与调控内质网相关蛋白的表达
通过分析拟南芥NPR1缺失突变体与过表达体基因表达差异发现,NPR1上调了几个蛋白质分泌途径中涉及的基因,包括BiP2、Sec61a、DAD1和CRT3等,这些基因启动子中大多包含TL1顺式元件,该元件与转录因子TBF1结合,调控分泌途径相关蛋白的表达。在sec61a bip2和dad1 bip2这2个双突变体中均表现为BHT(一种SA类似物)诱导下的PR1蛋白分泌减少和病原菌生长增多;在bip2突变体中,几个未折叠蛋白反应(unfolded protein response,简称UPR)标记基因在BTH处理后被过度激活,且对npr1敏感[10]。因此,NPR1上调分泌相关基因与SAR诱导期间PR蛋白表达量的增加相适应,以保证PR蛋白被充分折叠[10]。除此之外,植物内质网应激反应造成胞内氧化还原状态的改变,引起NPR1的单体化与入核,通过与转录因子bzip28/60结合,在UPR反应后期抑制相关基因的表达,防止UPR的过度激活[11]。
5 展望
NPR1是SAR信号通路调控的关键蛋白,在过去多年的研究中,NPR1参与植物免疫相关机制得到初步验证,并且相关的信号通路在生长发育、抗冻、节律等多个方面的作用以及部分调控机制也逐渐被发现。然而,依然还有很多问题尚未得到解决,在拟南芥NPR1中R432被认为与SA的直接相互作用有关[4],此外C521/C529可通过Cu2+与SA结合[12],这就存在2种可能性,其一为R432与C521/529可能在NPR1的三级结构上组成SA的结合位点,其二为NPR1可能包含有多个SA结合位点,SA与不同的结合位点相互作用会调控不同免疫相关基因的表达,对NPR1结构的解析是回答以上问题的关键。
NPR1的翻译后修饰和降解在植物调控应答信号中扮演着重要角色。NPR1在抗冻调控过程中不需要SUMO修饰以及S11/S15磷酸化,并且衰老过程区别于SAR过程中的磷酸化修饰,说明其翻译后修饰与NPR1不同功能的发挥相关,这可能与各通路SA诱发浓度以及低聚体NPR1的亚细胞定位有关。此外,尽管Fu等提出NPR3/NPR4可根据改变SA的浓度来介导NPR1的降解[30],但Ding等的研究表明NPR3/NPR4与NPR1并没有直接相互作用[4]。NPR3/NPR4作为SA受体,与NPR1的功能相反,可直接与TGA相互作用抑制下游免疫相关基因的表达。鉴于翻译后修饰对NPR1活性以及降解有着重要影响,不同的修饰是否会导致NPR1和NPR3/NPR4功能和相互作用能力的改变是下一步亟需解决的问题。
此外,同源NPR1在多種农作物中已被鉴定出来(图1),尤其在环保意识强烈的今天,利用基因工程技术培育持久抗病的农作物新品种,以此减少农药的使用和对环境的污染意义深远。因此,对NPR1调控机制的深入了解或许会为提升农作物的抗病性和育种提供新的解决方案。
参考文献:
[1]Zipfel C. Early molecular events in PAMP-triggered immunity[J]. Current Opinion in Plant Biology,2009,12(4):414-420.
[2]Dangl J L,Jones J D. Plant pathogens and integrated defence responses to infection[J]. Nature,2001,411(6839):826-833.
[3]Spoel S H,Dong X. How do plants achieve immunity? defence without specialized immune cells[J]. Nature Reviews Immunology,2012,12(2):89-100.
[4]Ding Y,Sun T J,Ao K,et al. Opposite roles of salicylic acid receptors NPR1 and NPR3/NPR4 in transcriptional regulation of plant immunity[J]. Cell,2018,173(6):1454-1467.
[5]Chai J,Liu J,Zhou J,et al. Mitogen-activated protein kinase 6 regulates NPR1 gene expression and activation during leaf senescence induced by salicylic acid[J]. Journal of Experimental Botany,2014,65(22):6513-6528.
[6]Zhang J J,Gao J,Zhu Z,et al. MKK4/MKK5-MPK1/MPK2 cascade mediates SA-activated leaf senescence via phosphorylation of NPR1 in Arabidopsis[J]. Plant Molecular Biology,2020,102(4/5):463-475.
[7]Huang P X,Dong Z,Guo P R,et al. Salicylic acid suppresses apical hook formation via NPR1-mediated repression of EIN3 and EIL1 in Arabidopsis[J]. The Plant Cell,2020,32(3):612-629.
[8]Zhou M,Wang W,Karapetyan S,et al. Redox rhythm reinforces the circadian clock to gate immune response[J]. Nature,2015,523(7561):472-476.
[9]Olate E,Jiménez-Gómez J M,Holuigue L,et al. NPR1 mediates a novel regulatory pathway in cold acclimation by interacting with HSFA1 factors[J]. Nature Plants,2018,4(10):811-823.
[10]Wang D,Weaver N D,Kesarwani M,et al. Induction of protein secretory pathway is required for systemic acquired resistance[J]. Science,2005,308(5724):1036-1040.
[11]Lai Y S,Renna L,Yarema J,et al. Salicylic acid-independent role of NPR1 is required for protection from proteotoxic stress in the plant endoplasmic reticulum[J]. Proceedings of the National Academy of Sciences,2018,115(22):5203-5212.
[12]Rochon A,Boyle P,Wignes T,et al. The coactivator function of Arabidopsis NPR1 requires the core of its BTB/POZ domain and the oxidation of C-terminal cysteines[J]. Plant Cell,2006,18(12):3670-3685.
[13]Le H G,Heitz T,Mestre P,et al. Characterization of Vitis vinifera NPR1 homologs involved in the regulation of Pathogenesis-Related gene expression[J]. BMC Plant Biology,2009,9:54.
[14]Mou Z L,Fan W H,Dong X N. Inducers of plant systemic acquired resistance regulate NPR1 function through redox changes[J]. Cell,2003,113(7):935-944.
[15]Tada Y,Spoel S H,Pajerowska-Mukhtar K,et al. Plant immunity requires conformational changes of NPR1 via S-nitrosylation and thioredoxins[J]. Science,2008,321(5891):952-956.
[16]Gatz C. From pioneers to team players:TGA transcription factors provide a molecular link between different stress pathways[J]. Molecular Plant-microbe Interactions,2013,26(2):151-159.
[17]Fan W H,Dong X N. In vivo interaction between NPR1 and transcription factor TGA2 leads to salicylic acid-mediated gene activation in Arabidopsis[J]. Plant Cell,2002,14(6):1377-1389.
[18]Lebel E,Heifetz P,Thorne L,et al. Functional analysis of regulatory sequences controlling PR-1 gene expression in Arabidopsis[J]. The Plant Journal,1998,16(2):223-233.
[19]Li M,Chen H,Chen J,et al. TCP transcription factors interact with NPR1 and contribute redundantly to systemic acquired resistance[J]. Frontiers in Plant Science,2018,9:1153.
[20]Chen J,Mohan R,Zhang Y Q,et al. NPR1 promotes its own and target gene expression in plant defense by recruiting CDK8[J]. Plant Physiology,2019,181(1):289-304.
[21]Maier F,Zwicker S,Hückelhoven A,et al. Nonexpressor of pathogenesis-related proteins1 (NPR1) and some NPR1-related proteins are sensitive to salicylic acid[J]. Molecular Plant Pathology,2011,12(1):73-91.
[22]Weigel R R,Pfitzner U M,Gatz C. Interaction of NIMIN1 with NPR1 modulates PR gene expression in Arabidopsis[J]. The Plant Cell,2005,17(4):1279-1291.
[23]Weigel R R,Buscher C,Pfitzner A J,et al. NIMIN-1,NIMIN-2 and NIMIN-3,members of a novel family of proteins from Arabidopsis that interact with NPR1/NIM1,a key regulator of systemic acquired resistance in plants[J]. Plant Molecular Biology,2001,46(2):143-160.
[24]Hermann M,Maier F,Masroor A,et al. The Arabidopsis NIMIN proteins affect NPR1 differentially[J]. Frontiers in Plant Science,2013,4:88.
[25]Saleh A,Withers J,Mohan R,et al. Posttranslational modifications of the master transcriptional regulator NPR1 enable dynamic but tight control of plant immune responses[J]. Cell Host & Microbe,2015,18(2):169-182.
[26]Lee H J,Park Y J,Seo P J,et al. Systemic immunity requires SnRK2.8-mediated nuclear import of NPR1 in Arabidopsis[J]. The Plant Cell,2015,27(12):3425-3438.
[27]Spoel S H,Mou Z,Tada Y,et al. Proteasome-mediated turnover of the transcription coactivator NPR1 plays dual roles in regulating plant immunity[J]. Cell,2009,137(5):860-872.
[28]Mukhtar M S,Nishimura M T,Dangl J. NPR1 in plant defense:its not overtil its turned over[J]. Cell,2009,137(5):804-806.
[29]Oeckinghaus A,Ghosh S. The NF-kappa B family of transcription factors and its regulation[J]. Cold Spring Harbor Perspectives in Biology,2009(4):34-47.
[30]Fu Z Q,Yan S P,Saleh A,et al. NPR3 and NPR4 are receptors for the immune signal salicylic acid in plants[J]. Nature,2012,486(742):228-232.
[31]Backer R,Naidoo S,Van Den Berg N. The NONEXPRESSOR OF PATHOGENESIS-RELATED GENES 1 (NPR1) and related family:mechanistic insights in plant disease resistance[J]. Frontiers in Plant Science,2019,10:102.
[32]Gepstein S. Leaf senescence-not just a ‘wear and tear phenomenon[J]. Genome Biology,2004,5(3):212.
[33]Guo P,Li Z,Huang P X,et al. A tripartite amplification loop involving the transcription factor WRKY75,salicylic acid,and reactive oxygen species accelerates leaf senescence[J]. The Plant Cell,2017,29(11):2854-2870.
[34]Silva A T,Ribone P A,Chan R L,et al. A predictive coexpression network identifies novel genes controlling the seed-to-seedling phase transition in Arabidopsis thaliana[J]. Plant Physiology,2016,170(4):2218-2231.
[35]Chang K N,Zhong S,Weirauch M T,et al. Temporal transcriptional response to ethylene gas drives growth hormone cross-regulation in Arabidopsis[J]. eLife,2013,2:e00675.
[36]Pihakaski-Maunsbach K,Moffatt B,Testillano P,et al. Genes encoding chitinase-antifreeze proteins are regulated by cold and expressed by all cell types in winter rye shoots[J]. Physiologia Plantarum,2001,112(3):359-371.
[37]Wu Z,Han S,Zhou H D,et al. Cold stress activates disease resistance in Arabidopsis thaliana through a salicylic acid dependent pathway[J]. Plant,Cell & Environment,2019,42(9):2645-2663.
[38]Karapetyan S,Dong X N. Redox and the circadian clock in plant immunity:a balancing act[J]. Free Radical Biology & Medicine,2018,119:56-61.
[39]Goodspeed D,Chehab E W,Min-Venditti A,et al. Arabidopsis synchronizes jasmonate-mediated defense with insect circadian behavior[J]. Proceedings of the National Academy of Sciences of the United States of America,2012,109(12):4674-4677.馬 南,陈
