结直肠癌组织中lncRNA FOXC2-AS1与EZH2的表达及临床意义
2021-04-15赵钢艳熊将军刘灵芝王明明易小明
赵钢艳,熊将军,刘灵芝,王明明,王 璨,易小明
湖南中医药高等专科学校附属第一医院/湖南省直中医院检验科,湖南株洲 412000
结直肠癌(CRC)是常见的消化系统恶性肿瘤,全球每年新发患者约110万例,死亡患者达88万例[1]。近年来,随着我国人民生活水平的提高,CRC的发病率有逐渐升高的趋势,严重威胁人民的身体健康[2]。深入研究CRC的病因及发生发展的机制,对临床诊断及治疗具有重要意义。长链非编码RNA(lncRNA)是长度约为200~300 bp的非编码RNA分子,发挥基因调控、分子支架的功能,广泛参与炎症、免疫及肿瘤等多种生理病理过程[3-4]。研究表明lncRNA在肿瘤中发挥重要作用[4]。FOXC2-AS1基因位于16q24.1,是一种能调控基因表达的lncRNA,参与细胞发育、分化及衰老等过程的调控[5]。研究表明,lncRNA FOXC2-AS1在非小细胞肺癌、骨肉瘤等肿瘤中存在表达异常的现象[6-7],能够抑制抑癌基因P16的表达,促进恶性肿瘤的进展。Zeste基因增强子同源物2(EZH2)基因位于7q36.1,该基因编码的蛋白属于多梳蛋白复合物家族成员,参与细胞增殖、传代等,具有维持促增殖基因的持续转录状态的功能。RINKE等[8]报道,EZH2在肿瘤中发挥致癌基因的作用,如在白血病、乳腺癌等肿瘤中均能够促进肿瘤细胞增殖、浸润及转移等。此外,肿瘤中EZH2的表达升高还参与肿瘤化疗耐药性的形成,可能是新的肿瘤诊断及治疗靶点[9]。目前CRC中lncRNA FOXC2-AS1与EZH2相关的研究报道较少。本研究通过研究CRC组织中lncRNA FOXC2-AS1与EZH2的表达,探讨二者的临床意义。
1 资料与方法
1.1一般资料 收集2014年2月至2015年2月于本院诊治的86例CRC患者的临床病理资料。纳入标准:(1)CRC诊断均经病理学检查明确诊断;(2)初次诊治,患者以往无放化疗、靶向治疗病史;(3)临床病理及随访资料完整,患者无精神障碍性疾病。排除标准:(1)合并有溃疡性结肠炎、急慢性胃肠道炎症及自身免疫性疾病等。(2)有其他器官恶性肿瘤病史。(3)伴严重的心肺等脏器功能衰竭。86例CRC患者中男51例,女35例;年龄29~78岁,平均(51.5±7.2)岁;直肠癌31例,结肠癌55例;伴有淋巴结转移者24例,无淋巴结转移者62例;肿瘤最大径≤3 cm者60例,>3 cm者26例;肿瘤分期:Ⅰ期32例,Ⅱ期26例,Ⅲ期22例,Ⅳ期6例;病理分级:高中分化61例,低分化25例。本研究经患者及家属知情同意并已签署知情同意书,且经本院伦理委员会审核通过。
1.2方法
1.2.1实时荧光定量PCR检测lncRNA FOXC2-AS1及EZH2中mRNA表达 取术中黄豆粒大小的癌组织,以及距癌组织边缘3 cm以上的正常组织(经病理学检查明确诊断)作为癌旁组织,标本置于液氮中保存。取50 mg组织,应用Trizol法提取组织中总RNA,分光光度法鉴定RNA的浓度及纯度,吸光度(A)260/A280为1.8~2.1,无菌无酶水溶解后在-80 ℃条件下保存。以总RNA为模板,用TaqMan反转录试剂盒反转录合成cDNA。FOXC2-AS1正向引物序列为5′-CCT TCC TGG CTG TTC ATC GG-3′,反向引物序列为5′-TGG AAA TAA GTG GCA CGC CC-3′;EZH2正向引物序列为5′-ATC AGA GTA CAT GCG ACT GAG A-3′,反向引物序列为5′-GCT GTA TCC TTC GCT GTT TCC-3′;内参基因β-actin正向引物序列为5′-TTC CTT CCT GGG CAT GGA GTC-3′,反向引物序列为5′-TCT TCA TTG TGC TGG GTG CC-3′。反应体系20 μL,Master Mix 10 μL,正向及负向引物各1 μL,模板cDNA 2 μL,ddH2O 6 μL。反应条件为:94 ℃ 15 min,94 ℃ 15 s,60 ℃ 30 s,72 ℃延伸30 s,共38个循环。所有反应均在ABI7500实时荧光定量PCR仪上完成。采用相对循环阈值(Ct值)对数据进行分析,检测lncRNA FOXC2-AS1及EZH2 mRNA的相对表达水平,ΔCt = Ct待测基因-Ctβ-actin。
1.2.2免疫组化法检测EZH2蛋白表达 将癌组织及癌旁组织用中性甲醛固定24 h后,石蜡包埋切片,60 ℃烤箱中烤片3 h;二甲苯脱蜡2遍;梯度水化;微波炉法抗原热修复;3%过氧化氢去除内源性过氧化物酶0.5 h;5%羊血清封闭0.5 h;一抗4 ℃孵育过夜,EZH2一抗稀释比1∶500,抗体购自美国Abcam公司,货号ab227648;二抗孵育2 h;二氨基联苯胺显色2 min;苏木精复染30 s;梯度脱水,封片镜检。制备羊抗人Notch、Dll4多克隆抗体(工作浓度为1∶500)和即用型二抗(工作浓度为1∶2 000);二氨基联苯胺显色,苏木精复染,光镜观察。采用二级计分法,结果以染色面积评分×染色强度评分表示,染色面积评分:<5%为0分,5%~25%为1分,>25%~50%为2分,>50%~75%为3分,>75%为4分;染色强度评分:淡黄色为1分,黄或深黄色为2分,褐色为3分。结果<2分判定为阴性,≥2分判定为阳性。
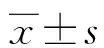
2 结 果
2.1癌组织与癌旁组织中lncRNA FOXC2-AS1、EZH2 mRNA表达水平比较 癌组织中lncRNA FOXC2-AS1、EZH2 mRNA相对表达水平均高于癌旁组织(t=29.837、19.736,均P<0.05),见图1。

图1 癌组织与癌旁组织中lncRNA FOXC2-AS1、EZH2 mRNA表达水平比较
2.2癌组织与癌旁组织中EZH2蛋白表达水平比较 癌组织EZH2蛋白主要表达于肿瘤细胞的细胞核,癌组织中EZH2蛋白表达阳性率为88.4%(76/86),癌旁组织中EZH2蛋白表达阳性率为10.5%(9/86),癌组织中EZH2蛋白表达阳性率高于癌旁组织(χ2=104.410,P<0.05)。见图2。

注:A为癌组织EZH2蛋白阳性表达;B为癌旁组织EZH2蛋白阳性表达。
2.3癌组织中lncRNA FOXC2-AS1与EZH2 mRNA表达的相关性 癌组织中lncRNA FOXC2-AS1与EZH2 mRNA表达水平呈正相关(r=0.611,P<0.05)。
2.4癌组织中lncRNA FOXC2-AS1、EZH2蛋白表达与临床病理参数的关系 癌组织中lncRNA FOXC2-AS1蛋白表达水平及EZH2蛋白阳性表达与患者肿瘤TNM分期有关(P<0.05),与患者的性别、年龄、肿瘤大小、肿瘤位置、肿瘤分化程度及是否伴淋巴结转移无关(P>0.05)。Ⅲ~Ⅳ期癌组织中lncRNA FOXC2-AS1蛋白表达水平、EZH2蛋白阳性表达明显高于Ⅰ~Ⅱ期癌组织(P<0.05)。

表1 癌组织中lncRNA FOXC2-AS1、EZH2蛋白阳性表达与临床病理特征关系

续表1 癌组织中lncRNA FOXC2-AS1、EZH2蛋白阳性表达与临床病理特征关系
2.5癌组织中不同lncRNA FOXC2-AS1、EZH2表达水平患者生存率比较 86例CRC患者中,死亡41例,存活45例,5年总体生存率为52.3%。lncRNA FOXC2-AS1高表达组44例,死亡30例,存活14例;lncRNA FOXC2-AS1低表达组42例,死亡11例,存活31例。Kaplan-Meier生存曲线分析结果表明lncRNA FOXC2-AS1高表达组患者5年总体生存率明显低于lncRNA FOXC2-AS1低表达组患者(P<0.05)。EZH2蛋白高表达组42例,死亡29例,存活13例;EZH2蛋白低表达组44例,死亡12例,存活32例。Kaplan-Meier生存曲线分析结果表明EZH2蛋白高表达组患者5年总体生存率低于EZH2蛋白低表达组患者(P<0.05)。见图3。

注:A为不同lncRNA FOXC2-AS1表达患者生存率比较;B为不同EZH2表达患者生存率比较。
3 讨 论
近年来随着我国人民饮食方式的改变及人口老龄化的加剧,CRC的发病率及病死率有逐渐升高的趋势。目前CRC的治疗主要包括手术治疗、放化疗、靶向药物治疗及免疫治疗等,部分早期患者获得良好的治疗效果,5年总体生存率达60%[10]。但晚期转移患者疗效不佳,即使经积极综合治疗后,患者的5年总体生存率低于10%。因此,有必要深入研究CRC发生发展的机制,寻找有效的早期诊断及药物治疗靶点。非编码RNA是近年来发现的细胞内不具有蛋白编码功能,但参与调控基因表达的小分子RNA,可分为lncRNA、微小RNA及环状RNA等。研究发现,lncRNA参与细胞发育、分化及凋亡等生物学调控过程,与感染、免疫及肿瘤等密切相关,有可能成为新的疾病诊断治疗的分子靶点[11]。
lncRNA lncRNA FOXC2-AS1是叉头盒蛋白C2(FOXC2)的反义RNA转录物,调控哺乳动物的发育及分化等过程[12]。近年来研究表明,lncRNA FOXC2-AS1在骨肉瘤[13]及肺癌[6]等肿瘤中表达上调,并能够作为一种致癌基因,抑制下游抑癌基因P15的表达,进而促进肿瘤细胞的恶性增殖及转移。本研究中,CRC癌组织中lncRNA FOXC2-AS1表达上调。但其表达上调的机制尚不清楚,可能与FOXC2-AS1转录后调控异常有关。有研究报道,miR-548c-5p能够结合于FOXC2-AS1 mRNA的3′非编码区,导致FOXC2-AS1 mRNA的稳定性下降,进而降低lncRNA FOXC2-AS1的表达水平,但在CRC中miR-548c-5p表达水平降低,结合FOXC2-AS1 mRNA的能力降低,从而促进lncRNA FOXC2-AS1表达[14-15]。此外,CRC癌组织中lncRNA FOXC2-AS1的表达水平与肿瘤分期有关,lncRNA FOXC2-AS1促进肿瘤的发生发展。PAN等[16]报道,lncRNA FOXC2-AS1表达水平升高可以促进CRC肿瘤细胞内Ca2+水平升高,激活蛋白酪氨酸激酶2(FAK)信号通路的传导,增强FOXC2 mRNA的稳定性,从而促进CRC增殖、迁移和侵袭。因此,lncRNA FOXC2-AS1有可能成为新的CRC潜在有效治疗靶点。本研究进一步分析癌组织中lncRNA FOXC2-AS1的表达与患者生存预后的关系,结果表明高表达lncRNA FOXC2-AS1的CRC患者5年总体生存率降低,表明lncRNA FOXC2-AS1的高表达可能导致患者的不良预后,检测癌组织中lncRNA FOXC2-AS1的表达有可能成为提示CRC患者预后的肿瘤标志物。
EZH2属于多梳蛋白家族成员,位于人类染色体7q36.1,参与调控早期胚胎发育、细胞分化及凋亡等生物学过程[17]。有研究报道,在舌鳞癌[18]、乳腺癌[19]等肿瘤中EZH2基因存在表达上调的现象,其能催化组蛋白H3赖氨酸27位的三甲基化,抑制下游抑癌基因P53等的表达,促进肿瘤细胞的恶性增殖及浸润、转移。本研究中,癌组织中EZH2 mRNA及蛋白的表达水平升高,可能与CRC中EZH2的转录调控异常有关。FENG等[20]研究表明,调控EZH2表达的转录因子E2F转录因子1(E2F1)表达水平升高,E2F1结合EZH2的基因启动子区,导致EZH2表达水平升高。本研究中,CRC中癌组织中EZH2的表达与肿瘤分期有关,表明CRC发生时EZH2促进肿瘤的发生发展。其机制可能是EZH2的表达水平升高激活Wnt信号通路,促进肿瘤细胞发生上皮间质转化。李妍等[21]发现,EZH2的表达上调能够抑制Wnt信号通路中β-连环蛋白的表达,促进N-钙黏素的表达,导致肿瘤细胞的浸润及转移能力增强。此外,本研究中高表达EZH2的患者生存预后较差,表明CRC癌组织中EZH2的表达可能有助于预测CRC患者的生存及预后。本研究进一步分析发现,CRC癌组织中lncRNA FOXC2-AS1与EZH2 mRNA表达水平呈正相关,目前二者之间的具体作用机制尚不清楚,但CHEN等[22]在前列腺癌体外细胞实验中发现,lncRNA FOXC2-AS1可作为分子海绵结合并抑制miR-1253的表达,进而促进miR-1253的下游靶基因EZH2的表达,在肿瘤细胞的增殖及恶性进展中发挥重要作用。
综上所述,CRC癌组织中lncRNA FOXC2-AS1、EZH2表达水平升高,lncRNA FOXC2-AS1与EZH2 mRNA表达水平呈正相关,可能均参与了CRC的发生发展。癌组织中lncRNA FOXC2-AS1、EZH2的高表达与肿瘤分期及患者不良预后有关,二者有可能成为新的诊断及治疗CRC的分子标志物,但其具体的作用机制和临床意义需深入研究。
