中医药治疗肌萎缩侧索硬化疗效机制的研究策略
2021-04-14吴晓俊
潘 昊,刘 特,吴晓俊
1.重庆医科大学药学院,重庆 400016
2.上海市中医老年医学研究所,上海 200031
3.上海中医药大学中药研究所,上海 201203
肌萎缩侧索硬化(amyotrophic lateral sclerosis,ALS)是以脊髓前角细胞、脑干运动神经核以及锥体束受累为主要表现的运动神经元病,其病情进展迅速、预后极差,通常在发病后2~5 年因多器官衰竭而死亡[1],因此也是一种具有致命性的神经退行性疾病。绝大多数的ALS为散发性,家族性ALS 约占5%。目前尚无确切有效的针对ALS 的治疗药物。
无论是散发性还是家族性ALS,因其表现为渐进性的肌肉痿软无力甚至萎缩,因此中医认为其属于“痿症”。大多数的中医医家认为本病以本虚为主或虚实夹杂,其中本虚以脾肾阳虚为主,夹杂胃、肝和肺亏虚。因此,目前中医大多使用健脾益气补肾法治疗ALS,取得了一定的疗效[2]。然而,已发表的ALS 中医临床研究大多为个案报道或病例数较少,并且研究设计欠规范,也缺少机制研究,因此较难获得广泛的认可,对ALS治疗的指导意义有限,极大地阻碍了中医药诊治ALS 研究的发展。此外,既往研究建立的ALS 模型系统及治疗策略既有优势,也存在不足[3]。
潘卫东团队与朱旭莹团队基于中医药治疗ALS的确切疗效,使用模拟散发性ALS 进程的条件性敲除ADAR2 基因的小鼠(AR2 小鼠)以及能够反映家族性ALS 发病机制的SOD1G93A动物模型,对中医药治疗ALS 的机制进行了有益的探索[4-5]。本文对ALS 发病机制的最新进展进行综述,并且结合中医药治疗ALS 基础研究的新进展,提出探索中医药治疗ALS 疗效机制的研究策略,以期为中医药治疗神经退行性疾病的研究提供更多的理论依据。
1 ALS 的发病机制
既往研究认为ALS 的主要发病机制是运动神经元损伤。随着基因、分子细胞学和转基因动物相关研究的进展,目前认为神经胶质细胞炎症在ALS 发病机制中发挥重要作用。运动神经元与神经胶质细胞相互作用,共同参与ALS 的发病。
1.1 神经元损伤相关发病机制
1.1.1 兴奋性神经元毒性机制
ALS 的发病机制至今未明,特别是对于散发性ALS 的发病机制仍未达成共识。目前,兴奋性神经元毒性和钙离子超载被认为是ALS 神经元损伤的最主要机制之一,其中以兴奋性氨基酸的细胞毒性诱发钙离子过度内流的细胞毒性假说为代表(图1)。
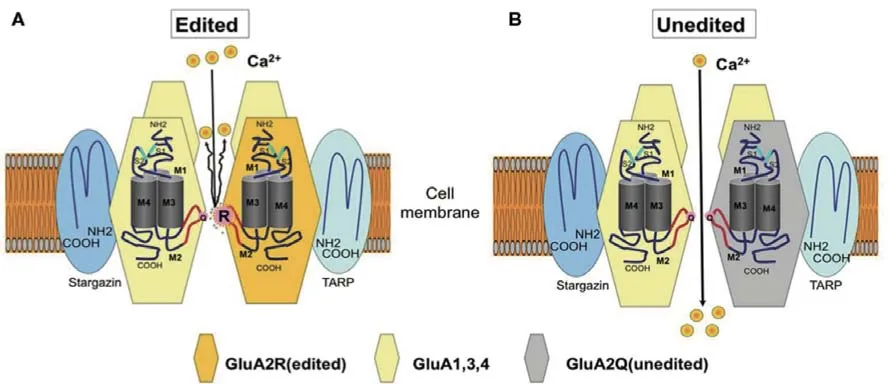
图1 兴奋性氨基酸的细胞毒性诱发钙离子过度内流。A:正常编辑的离子型谷氨酸受体GluA2;B:条件性敲除ADAR2基因的小鼠(AR2小鼠)的运动神经元仅表达Q/R 部位未编辑的GluA2,出现异常Ca2 +渗透,从而导致神经元进行性死亡。
通过条件性敲除ADAR2 基因构建模拟ALS发病及疾病进展的AR2 小鼠模型,ADAR2 缺乏导致小鼠脊髓前角细胞发生神经变性,缺乏ADAR2 的运动神经元表达未经Q/R 位点编辑的GluA2,其亚基装配中未经编辑的离子型谷氨酸受体GluA2 出现异常Ca2+渗透,从而导致神经元进行性死亡。此外,在AR2 小鼠中,异常的AMPA 受体导致Ca2+内流而过度激活Ca2+依赖的钙蛋白酶(calpain);钙蛋白酶将1 号常染色体TARDBP基因编码的TDP-43 蛋白降解成具有聚集倾向的片段,这些片段是TDP-43 致病的基础;激活的钙蛋白酶还可以通过切割参与核质转运的分子(包括核孔蛋白)破坏细胞核-细胞质转运以及基因表达。上述证据启发研究者针对ADAR2 基因表达下调,探索ALS 的分子靶向治疗策略[6-7],并且通过使用ADAR2 基因敲除动物模型开展了一系列干预策略研究。例如,给予AR2小鼠口服吡仑帕奈或者进行以腺病毒相关病毒为载体的ADAR2 基因治疗,均取得了一定的疗效,但均为临床前研究[8-9]。在开展中医药治疗ALS疗效机制的研究时,可参考上述研究方法。
1.1.2 线粒体功能障碍
线粒体对于细胞的存活和代谢具有关键作用,对神经元而言尤为重要。在神经元中,除了通过氧化磷酸化产生ATP 以外,线粒体在磷脂合成、钙稳态和细胞凋亡中也具有重要作用。尽管大脑的质量只占人体质量的2%,但消耗了人体所产生的20%的ATP(静止休息状态),因此神经元有着很高的代谢需求。鉴于神经元的高代谢活性和能量需求,线粒体维持能量的产生以及钙稳态对于神经元功能的维持而言尤为重要。
许多与家族性或散发性ALS 发病机制相关的蛋白如超氧化物歧化酶(superoxide dismutase,SOD)1、TDP-43、肉瘤融合蛋白(fused in sarcoma,FUS)和C9orf72 二肽重复蛋白,已被证实与线粒体之间存在相互作用[10-11]。有研究发现,ALS 患者神经元的细胞呼吸速率下降以及ATP 生成减少,此外在散发性ALS 患者的脊髓中发现电子传递链复合物Ⅰ、Ⅱ、Ⅲ和Ⅳ的活性降低[12-13]。SOD1G93A转基因小鼠在出现ALS 运动症状之前,脑和脊髓中ATP 的合成已受损,线粒体呼吸速率亦下降,并且贯穿于整个病程中,同时伴有电子传递复合物链活性的下降[14]。
WIEDEMANN 等[15]发现,脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)通过调控线粒体运动促进BDNF 介导的神经递质释放;BDNF 通过酪氨酸激酶受体B(tyrosine kinase receptor B,TrkB)激活下游PI3K、PLC-γ 和瞬时受体电位阳离子通道(transient receptor potential cation channel,TRPC)信号通路,促进细胞内钙的释放以及细胞外钙离子内流,该作用在突触部位尤为明显;线粒体外膜上的钙离子感受器Miro1 与钙离子结合后,促使线粒体从微管上脱落下来,并在突触前部位聚集,为BDNF 介导的神经递质的释放提供能量。中医药治疗ALS 的疗效机制中是否也涉及调控运动神经元的线粒体功能及其动态变化,有待进一步探索。
1.1.3 轴浆转运障碍
轴浆转运障碍可能是导致ALS 患者神经元损伤的另一个重要途径。BDNF 选择性地结合并激活TrkB,二者结合是逆轴浆转运的关键一环。研究发现,JNK 相互作用蛋白3(JNK interacting protein 3,JIP3)可以通过与TrkB 的近膜区直接结合,将TrkB 连接至马达蛋白kinesin-1 的轻链上,介导TrkB 的顺轴突转运,并且调节BDNF 诱导的细胞外调节蛋白激酶(extracellular regulated protein kinase,Erk)的激活以及轴突中丝状伪足的形成[16]。
磷酸化的神经丝蛋白(neurofilament protein,NFP)在病理状态下进入轴突后,NFP轻链(neurofilament-light,NF-L)和NFP 中链(neurofilament-middle,NF-M)最先开始磷酸化;随后,NF-M 和NFP 重链(neurofilament-heavy,NF-H)的磷酸化作用逐渐增强,而NF-L 的磷酸化程度逐渐减弱。在NFP 的磷酸化过程中,蛋白激酶A 和蛋白激酶C 等分别作用于其亚基的不同特异性序列上,促进多种底物磷酸化。NFP 过度表达(异常磷酸化)可导致其降解障碍或发生异常聚集,严重影响NFP 向轴浆运输,引发神经元变性,从而导致ALS。
上述研究阐述了SOD1G93A转基因小鼠的脊髓前角运动神经元核周出现NFP 的异常磷酸化以及发生聚集的原因。通过基因调控抑制SOD1G93A转基因小鼠运动神经元核周NFP 的异常磷酸化,减少其在核周的异常聚集,维持细胞骨架的完整性,以及改善轴浆运输,从而延缓神经元变性,这可能也是中医药治疗ALS 疗效机制的研究方向之一。
1.1.4 神经营养因子缺陷
神经营养因子是一类能够促进神经元存活和分化以及维持功能完整的蛋白质,包括BDNF、睫状神经营养因子(ciliary neurotrophic factor,CNTF)、胶质细胞源性神经营养因子(glial cell line-derived neurotrophic factor,GDNF)、胰岛素样生长因子(insulin like-growth factor,IGF)和成纤维生长因子(fibroblast growth factor,FGF)等[17]。在这些神经营养因子中,BDNF 最受关注。BDNF 是脑内含量最丰富的神经营养因子,增强BDNF 信号已成为延缓ALS 病情进展的干预策略之一。
神经营养因子可通过旁分泌、内分泌或自分泌方式释放。旁分泌的神经营养因子来自于邻近细胞如胶质细胞、施万细胞或毛细血管内皮细胞和肌纤维等[18]。内分泌的神经营养因子则来源于远端细胞如室管膜细胞,通过血液或脑脊液进行传递[19]。自分泌则是指运动神经元自我提供神经营养因子的能力。
通过小分子药物调节BDNF 受体TrkB 以增强BDNF 信号的传递,可以延长体外退化神经元的存活能力[20],并使ALS 模型小鼠的运动神经元丢失减少、运动能力提高[21]。BDNF 也被证实能够增强体外培养的运动神经元的存活能力[22]。本课题组的前期研究发现,在经β-淀粉样蛋白(amyloid β-protein,Aβ)处理的神经细胞和老年性痴呆小鼠模型中,活性异常升高的糖原合成酶激 酶3β(glycogen synthase kinase 3β,GSK3β)磷酸化发动蛋白1(dynamin-1,Dyn1)的第774 位丝氨酸,导致TrkB 内吞以及下游Akt 信号通路激活受损;使用多肽TAT-Dyn1-SpS 可以特异性阻止GSK3β 对Dyn1 磷酸化,挽救受损的TrkB 内吞以及下游Akt 信号激活,从而改善小鼠的学习和记忆能力[23]。
对于ALS 而言,神经肌肉接头(neuromuscular junction,NMJ)间的信号传递可以提供新的干预靶点,这是因为ALS 中存在神经突触末梢与肌肉之间的连接障碍。事实上,适当的合理运动在延缓ALS 病情进展、保护NMJ 以及维持运动功能以提高生活质量等方面显示出一定的疗效。BDNF基因的转录、翻译和分泌受神经活动调节,而运动训练能够增加啮齿动物脊髓和骨骼肌中BDNF mRNA 和蛋白的表达。在ALS大鼠模型中,大脑和跖肌中BDNF/TrkB 信号通路严重受损,而恢复BDNF 信号是一个很好的ALS 治疗选择,能够通过结合TrkB 促进损伤的运动神经元存活[24]。对于恢复BDNF 信号通路的探索,可能也是中医药治疗ALS 疗效机制的研究方向之一。
1.2 神经炎症相关发病机制
神经炎症是ALS 的病理学表现之一。神经炎症是由活化的小胶质细胞、星形胶质细胞以及浸润的CD4+和CD8+T 淋巴细胞引起,与ALS 病程有关[25-26]。研究发现,神经炎症可能由退化的运动神经元与周围小胶质细胞之间的相互作用所引起,而小胶质细胞介导的突触修剪可能导致ALS神经突触的进行性丢失[27]。
与广泛表达SOD 突变体的转基因小鼠相比,仅在神经元中表达SOD 突变体可能无法诱发运动神经元疾病,或者运动神经元疾病的发病较晚、进展缓慢并且小鼠的生存时间较长[28-29]。另一项研究发现,在运动神经元以外的其他细胞中表达SOD 突变体的动物模型仍出现ALS 病理学改变,表明运动神经元之外的其他细胞对ALS 的致病至关重要[30-31]。并且,从ALS 动物模型的小胶质细胞中特异性去除SOD 突变体后,其病情进展明显延缓,存活率增加[32-33]。给予尚未出现症状的SOD1G37R转基因小鼠腹腔注射脂多糖(lipopolysaccharide,LPS)后可导致ALS 症状提前出现[34]。由此可见,小胶质细胞参与了ALS的病理生理过程。
激活的小胶质细胞至少有2 种不同的表型,即M1 型(毒性)和M2 型(保护性),以响应不同的微环境信号,进而分泌多种效应分子[35]。M1 型小胶质细胞释放促炎症介质,包括白细胞介素(interleukin,IL)-1、IL-6、肿瘤坏死因子、趋化因子、前列腺素E2和诱导型一氧化氮合酶等[30-31]。由抗炎细胞因子IL-4、IL-10 或IL-13诱导的M2 型小胶质细胞能够抑制炎症,通过吞噬作用清除细胞碎片,促进细胞外基质重建,并且通过释放营养因子支持神经元的存活[35]。对SOD1G93A转基因小鼠的小胶质细胞进行转录组分析,发现参与抗炎途径的基因(包括IGF1、颗粒蛋白前体和髓系细胞触发受体2 基因)与潜在的神经毒性因子(包括基质金属蛋白酶12 和经典促炎细胞因子)相关基因的表达均上调[36],表明ALS 小鼠同时表达M1 型和M2 型小胶质细胞。
将野生型星形胶质前体细胞局部移植至SOD1 基因突变大鼠的颈脊髓,可以延缓大鼠的疾病进展,并且延长生存时间[33]。反之,将表达SOD1G93A突变体的星形胶质前体细胞移植至野生型小鼠的脊髓,可导致局部运动神经元变性,引发中度的运动功能障碍[34]。由此提示,星形胶质细胞在ALS 的病理进程中亦发挥一定的作用。
星形胶质细胞经诱导可表现为神经毒性A1型反应性星形胶质细胞或神经保护性A2 型反应性星形胶质细胞[35]。神经炎症刺激物(如LPS)可诱导生成神经毒性A1 型反应性星形胶质细胞,引发神经毒性以及促进神经退行性变;缺血可诱导生成神经保护性A2 型反应性星形胶质细胞,后者通过分泌神经营养因子以促进神经保护和神经修复。正常的星形胶质细胞可以通过分泌某些因子(研究最多的是神经营养因子),远距离保护ALS 患者的运动神经元。
2 基于临床前研究制定中医药治疗ALS 疗效机制的研究策略
基于中医理论“脾主四肢肌肉”“肾者作强之官”,ALS 的基本病机为脾肾阳虚。使用AR2小鼠模型开展中医药治疗ALS 的疗效研究,发现健脾补肾方能够明显改善小鼠的四肢握力,以及延缓疾病进展,推测可能是通过调控ADAR2 基因的表达而发挥作用。在SOD1G93A转基因小鼠模型中,健脾补肾方的疗效也得到了进一步的验证,显示健脾补肾方能够明显延迟ALS 的发病时间、改善运动功能以及延长生存时间;推测其作用机制可能是通过抑制NFP 异常磷酸化以及减少其在核周的聚集,从而维持细胞骨架的完整、减轻轴索的萎缩、改善轴浆运输以及延缓神经变性,继而达到保护神经细胞的目的[36]。
目前有不少基于中医理论“健脾补肾”辨证论治ALS,并且取得一定疗效的中药方剂。这些方剂是否通过保护神经元细胞和(或)调节胶质细胞活性等机制而发挥治疗作用,有待进一步探讨。
本课题组认为,中医药治疗ALS 疗效机制的研究策略是开展中药方剂干预不同的ALS 转基因动物模型的疗效验证研究,旨在探索中药方剂对于神经元和胶质细胞的作用以及其保护神经元和调节神经胶质细胞的分子机制,并在此基础上构建转基因小鼠以进一步验证中药方剂治疗ALS 的机制(图2)。通过开展上述研究,提出中药方剂及其活性成分对于神经细胞毒性可能的作用机制,例如通过调节谷氨酸受体亚基的活性来调控病理性TDP-43 片段的聚集,改善神经元的线粒体功能及其轴浆转运,促进神经营养因子的合成和分泌,或者在神经胶质炎症中抑制有害炎症以及调节抗炎活性因子等。
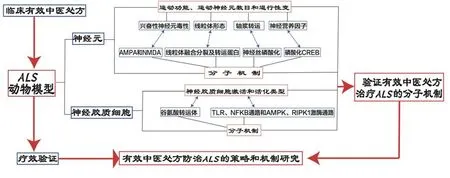
图2 中医药治疗肌萎缩侧索硬化疗效机制的研究策略
