凝血酶敏感蛋白-1与血管新生
2021-04-02王继红于光远
王继红, 于光远, 姜 颖
(辽宁师范大学 生命科学学院,辽宁 大连 116081)
凝血酶敏感蛋白-1(Thrombin-sensitive protein, Thrombospodin-1, TSP-1)是由人体内多种细胞分泌的一种多结构域、多功能的细胞外基质糖蛋白,具有调节细胞增殖与黏附的功能,其功能与血管新生、炎症、伤口愈合及癌症等许多生理病理活动相关[1].
在TSP-1参与的多种生理病理活动中,其表现出的对血管新生的调节功能引起人们的关注.血管新生是从预先存在的血管系统中生出新血管的过程,这是胚胎发育、伤口愈合、癌症等生理、病理条件所必需的.肿瘤生长尤其依赖血管新生过程,以此达到输送氧气和营养、带走毒素和代谢物的目的.了解TSP-1对血管新生的调控功能及作用机制,有助于对TSP-1作用于血管新生靶点和通路的认识,并为以TSP-1为基础的内源性血管新生抑制剂的研究提供参考.因此,本文将对TSP-1的结构、血管新生调控功能及作用机制进行综述.
1 TSP-1的结构特征
如图1所示,TSP-1是一个分子量为450 kDa的同源三聚体,每一个TSP-1亚基都包含一个氨基末端和一个羧基末端球状结构域(G domain, G结构域),两者中间由一个细连接链连接.N端包含有一个肝素结合结构域(Heparin-binding domain, HBD),也被称为N结构域.紧接N结构域的是与三聚体组装相关的前胶原蛋白同源区(Procollagen homology domain, P结构域).P结构域后是TSP-1所含有的3种重复序列,分别为typeⅠ序列(Thrombospondin typeⅠrepeats, TSR1s)、typeⅡ序列(TSR2s)、typeⅢ序列(TSR3s).TSR1s由围绕着6个半胱氨酸残基的模体重复3次组成,其不同的活化序列在肿瘤进程中起着不同的作用;TSR2s也含有3个由6个半胱氨酸残基围绕的模体,它由60个氨基酸组成,具体功能尚未见报道;7个Ⅲ型重复序列TSR3s富含天冬氨酸残基,具有Ca2+结合特性[2].
2 TSP-1结构域受体及其功能
2.1 N结构域受体及功能
N结构域受体包括肝素(Heparin)、硫酸乙酰肝素蛋白多糖(HSPG)、多配体聚糖(Syndecan)、硫酸糖脂(Sulfated glycolipid)、多糖(Decorin)、纤维蛋白原(Fibrinogen)、整合素(α3β1、α4β1、α5β1、α9β1)[1-2].
关于其功能的研究表明,从TSP-1的N端水解下来的25 kDa的片段具有促进血管生成的作用,同时还与内皮细胞的侵袭相关[3].
2.2 前胶原蛋白同源区P结构域受体及功能
P结构域受体包括CD36(GPIV)、Ⅰ~Ⅴ型胶原(Collagen typeⅠ~Ⅴ)、层连蛋白(Laminin)、纤连蛋白(Fibronectin)、纤溶酶原(Plasminogen)[1-2].
P结构域可能具有抑制血管新生和内皮细胞迁移的功能[4].
2.3 C端结构域(G结构域)受体及功能
G结构域可以与多种细胞相互作用,也被称为细胞结合结构域(Cell-binding domain, CBD).该CBD中负责与细胞进行相互作用的肽的序列已经被鉴定出来,分别为IRVVM和RFYVVM[5].Sid等人的研究表明,TSP-1的C端结构域可与整合素相关蛋白(Integrin-associated protein, IAP, CD47)结合,这是其能够参与肿瘤细胞凋亡、黏附及侵袭等过程的原因之一[6].
2.4 TSR1s受体及功能
TSR1s由3个裂解素模体(Lysogenic motif 8)类重复序列组成,与来自疟原虫的环孢子蛋白(Circumsporozoite protein, CS蛋白)同源.该序列受体包括Latent TGFβ、CD36、HSPG、β1 integrin(α1β1、α2β1、α3β1、α4β1、α5β1、α6β1、α7β1、α8β1、α9β1、αVβ1)、Sulfated glycolipid、Ⅰ~Ⅳ型胶原(Collagen typeⅠ~Ⅳ)、Laminin、Fibronectin、纤维蛋白原(Fibrinogen)、刺激血管性血友病因子(von Willebrand factor, vWF)、Plasminogen、基质金属蛋白酶-2(Matrix metalloproteinase-2, MMP-2)、Heparin、富含组氨酸糖蛋白(Histidine rich glycoprotein).
该序列参与诱导内皮细胞凋亡,并抑制内皮细胞的增殖及血管新生[7-8].
2.5 TSR2s受体及功能
TSR2s受体包括β1 integrin(α1β1、α2β1、α3β1、α4β1、α5β1、α6β1、α7β1、α8β1、α9β1、αVβ1)、Collagen typeⅠ~Ⅳ、Laminin、Fibronectin、Plasminogen.
TSR2s与表皮生长因子前体具有同源性[7-8].
2.6 TSR3s受体及功能
TSR3s受体包括整合素αⅤβ3、整合素αⅡβ3、组织蛋白酶G(Cathepsin G)、弹性蛋白酶(Elastase)、凝血酶(Thrombin)、二价阳离子.
TSR3s与小白蛋白(Parvalbumin)和钙调蛋白(Calmodulin, CaM)的结构同源,这些重组体构成了TSP-1的多个钙结合位点,且TSR3s中含有arg-gly-asp-ala(RGDA)氨基酸序列[7-8](图1).
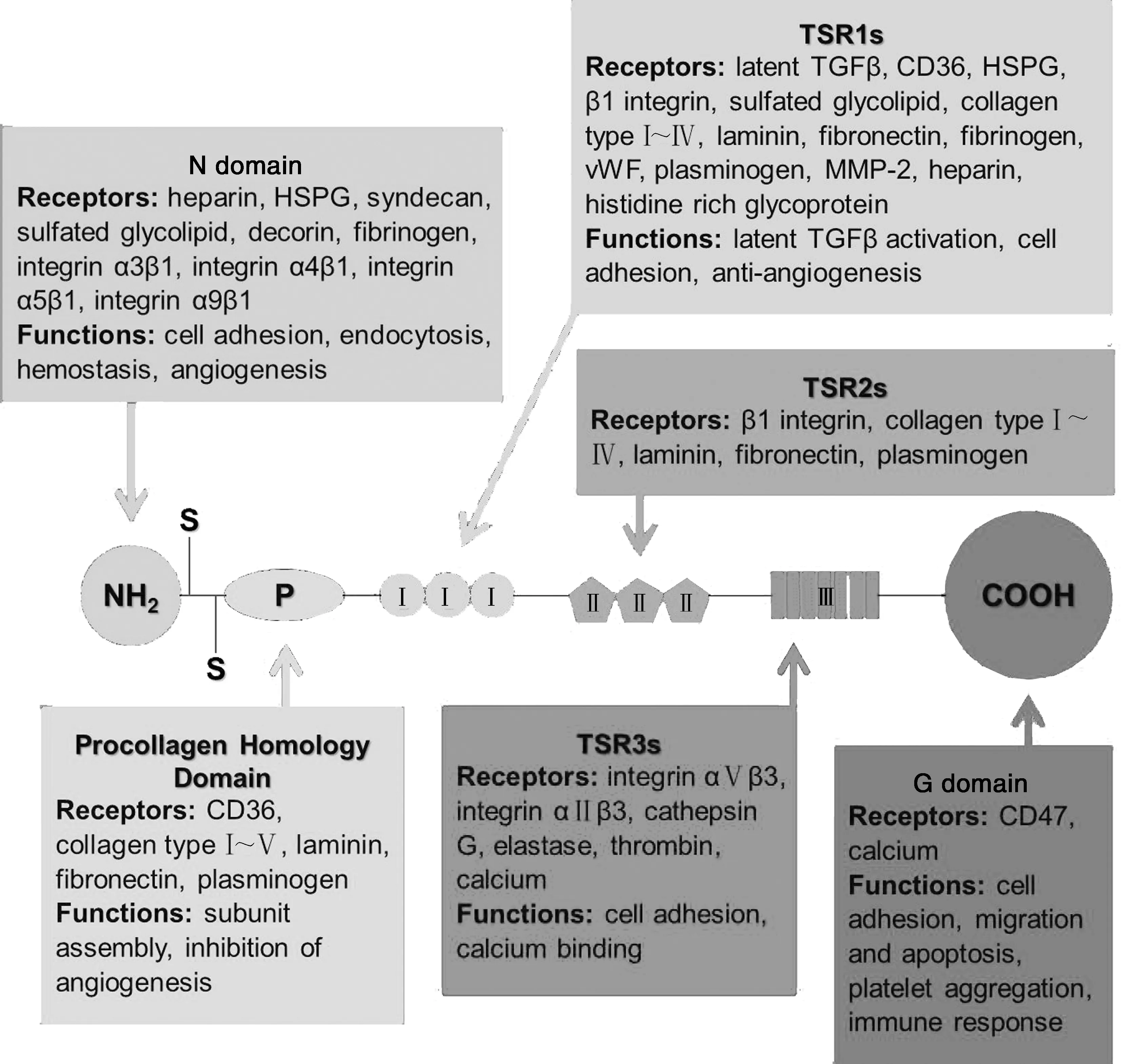
图1 TSP-1的结构及功能性结构域(根据文献[2]修改)Fig.1 Structural and functional domains of TSP-1 (modified from reference [2])
3 TSP-1涉及的信号通路
如上所述,TSP-1的多种功能取决于其结构域可与多种细胞表面受体分子相互作用,其作用机制与TSP-1的受体涉及的通路有关.除此之外,TSP-1还可以与多种参与血管新生的蛋白酶相互作用,包括纤溶酶原、尿激酶、基质金属蛋白酶、凝血酶、组织蛋白酶和弹性蛋白酶等[9].TSP-1的多数结构域可以结合多个受体,也表明受体系统之间可以相互作用、相互影响(图2).
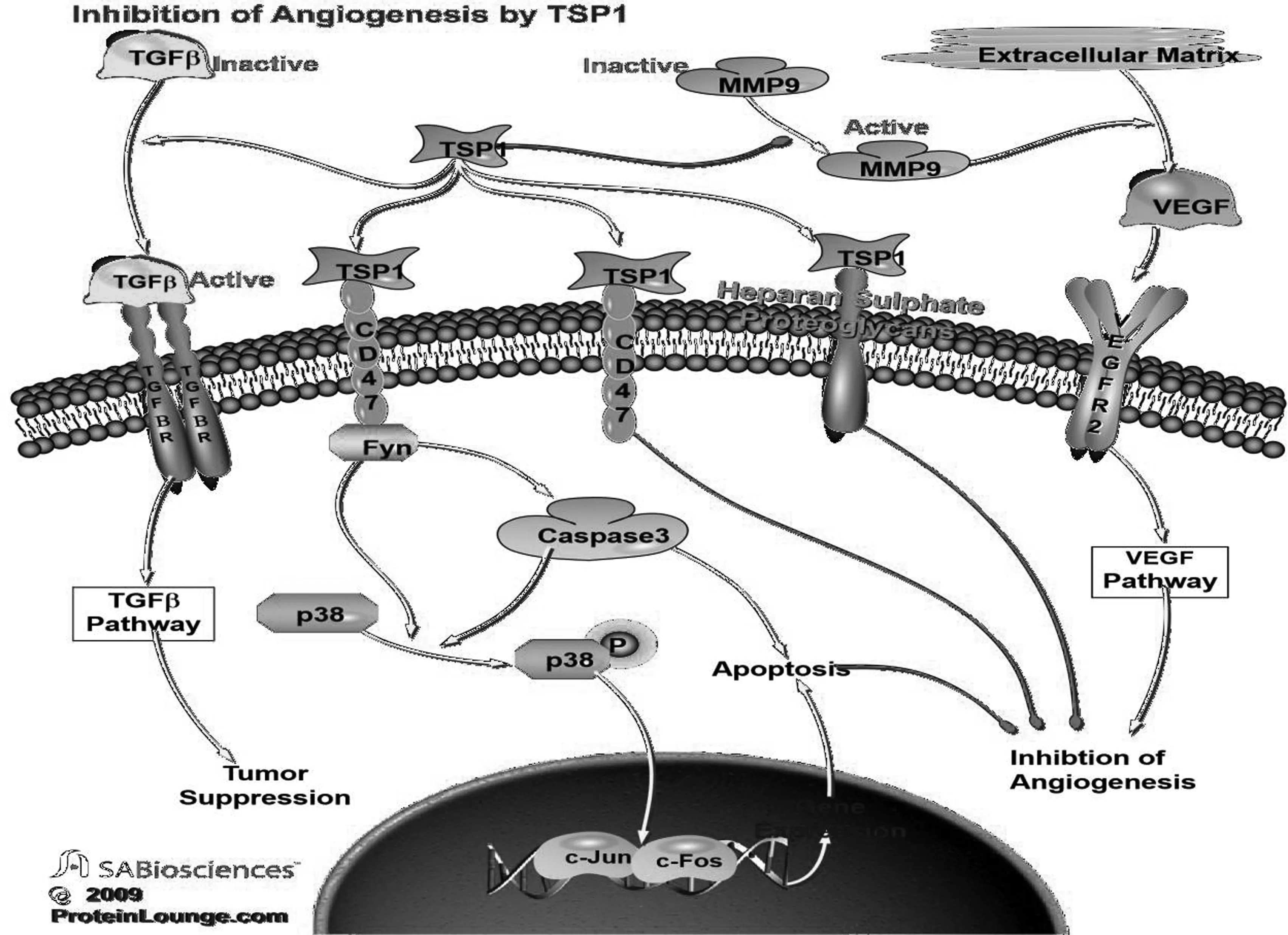
图2 TSP-1抑制血管生成的信号通路(Protein Lounge数据库)Fig.2 Inhibition of angiogenesis by TSP-1 (proteinlounge.com)
4 TSP-1与血管新生
血管新生对于恶性肿瘤的生长、迁移乃至预后的过程都有极其重要的影响.TSP-1可通过抑制血管内皮细胞的增殖、黏附、迁移、侵袭等活动诱导细胞凋亡,从而抑制肿瘤的血管新生,进而控制肿瘤的发生与发展[10-13]. 虽然有部分研究表明,TSP-l的裂解氨基末端表现出促血管新生的作用[14-15],且组织中的相关蛋白酶裂解产生的TSP-1片段也可能具有促进血管新生的作用[16],但更多的研究认为,TSP-1是内源性血管新生抑制剂[17-18].
4.1 TSP-1与生长因子的关系
血管内皮生长因子(Vascular endothelial growth factor, VEGF)是一种多功能细胞因子,可直接或间接促进血管生成.在恶性肿瘤中,VEGF处于过度表达状态,可以促进垂体内皮细胞的增殖和迁移,TSP-1则能够抑制VEGF的上述作用[19].秦云研究发现,在原发性肝癌中,VEGF表达水平与TSP-1水平呈负相关,VEGF表达水平越高,TSP-1水平越低[20],该现象在乳腺癌细胞中也有体现[19].另外,TSP-1与活性基质金属蛋白酶(Matrix metalloproteinase, MMPs)的结合可以阻断细胞外基质中的VEGF与其受体的结合,进而抑制血管生成[21].而Kaur等研究发现,TSP-1可以与CD47结合,抑制VEGF与其受体VEGFR2结合,从而发挥抑制血管新生的作用[22].Lindner等人的研究结果表明,TSP-1通过其肝素结合域与碱性成纤维细胞生长因子-2(Basic fibroblast factor-2, bFGF-2)竞争性结合硫酸乙酰肝素蛋白多糖(HSPGs),从而抑制血管生成[23].TSR1s还可结合并激活转化生长因子-β(Transforming growth factor-β, TGF-β),从而抑制内皮细胞迁移、血管新生和肿瘤生长[24-26].
4.2 TSP-1与血管内皮细胞表面黏附分子的相互作用
TSP-1可以和血管内皮细胞表面多种黏附分子结合,包括CD36、整合素和CD47等在内的12种以上细胞黏附分子受体[27-28].
CD148是一种跨膜蛋白酪氨酸磷酸酶,在多种类型细胞中表达的TSP-1是其重要的功能配体.TSP-1中的TSR1s可与CD148分子相互作用,通过增强CD148的活性促进酪氨酸的脱磷酸化,从而抑制内皮细胞的增殖.而在缺乏CD148时,TSP-1并未表现出抑制内皮细胞增殖的作用[29-30].TSP-1的氨基末端可通过抑制内皮细胞与基质纤连蛋白的黏附,使内皮细胞黏着斑丧失,从而间接抑制内皮细胞增殖[31].
TSP-1与CD36之间的相互作用被认为是抑制血管新生的重要机制[32-33].Volpert等人的研究表明,通过CD36-p59fyn-半胱天冬酶3(Caspase-3)-p38促分裂原活化蛋白激酶(p38 MAPK)级联反应、c-Jun氨基末端激酶和Fas/Fas配体的活化,CD36分子介导内皮细胞凋亡是TSP-1抑制血管新生作用的重要机制[34-36].
TSP-1还可通过与β1整合素相结合抑制内皮细胞的迁移[37],而TSP-1氨基末端的肝素结合位点能够与钙网蛋白(Calreticulin, CRT)等细胞表面蛋白相互作用,从而调节细胞的黏附功能及运动功能,进一步影响内皮细胞的迁移[38].
4.3 来源于TSP的多肽片段抗血管新生及抗肿瘤研究进展
由于TSP是一种具有多结构域的蛋白质,其上述功能与结构的相关性也引起了科学家们的关注.目前,对来源于TSP-1的多肽片段进行的功能研究已取得一定的进展.
Guo等人合成了TSP-1的Ⅰ型重复序列肽,研究结果表明,该合成肽及完整的TSP-1均能诱导牛主动脉内皮细胞发生凋亡[39],证明其具有抑制牛内皮细胞血管新生的功能.Iruela-Arispe等人采用含有第二个和第三个基因重组蛋白的片段(非前胶原区域)进行了抗血管新生实验.研究结果表明,Ⅰ型重复序列的氨基末端对bFGF-2诱导的血管新生具有更强效的抑制作用[40].Grundker等人基因重组表达了一个由人TSP-2的N末端区域和IgG-Fcl片段组成的融合蛋白(N-TSP2-Fc),并对其进行了血管新生和抗肿瘤的相关研究.体内实验结果表明,每天腹腔注射N-TSP2-Fc,可显著抑制免疫缺陷裸鼠乳腺中的人乳腺癌MDA-MB-435和MDA-MB-231细胞的生长及体内肿瘤血管化,还能够明显抑制乳腺癌在淋巴结的区域转移及肺的远端转移,这说明N-TSP2-Fc是一种有效的肿瘤转移抑制因子[41].Shen等人利用基因克隆手段,将PF4(58-70)与TSP-1(429-459)基因连接在一起,编码了一个融合蛋白TSF.实验结果表明,TSF可以呈剂量依赖性抑制牛主动脉内皮细胞BAEC的增殖和迁移.GST-TSF、PF4(58-70)和TSP-1(429-459)也能抑制BAEC的增殖和迁移,但其抑制率没有TSF高.CAM实验结果显示,TSF、GST-TSF、PF4(58-70)和TSP-1(429-459)都具有抗血管新生作用,但TSF的效果最优.体内实验结果表明,TSF可强效抑制Lewis肺癌,抑制率可达68.75% (剂量:1.00 μmol/kg).结果表明,该团队关于TSF基因的设计取得成功,TSF同时具有抗血管新生和抗肿瘤功能[42].
5 结 语
综上所述,TSP-1是一种具有多结构域和多受体的细胞外基质蛋白,这使其具有多样性的功能和复杂的作用靶点与信号通路.已有研究表明,来源于人的TSP-1片段具有抑制血管新生继而抑制肿瘤的功能,这为开发以TSP-1为基础的血管新生抑制剂提供了启示.目前,本研究团队将目光聚焦在海洋生物TSP-1的功能研究上,因此关于人源TSP-1的结构、功能及其抗血管新生作用机制的研究成果对于进一步的研究具有非常重要的参考价值.研究不同物种来源的TSP-1结构域片段的抗血管新生功能及作用机制,对于血管新生抑制剂新药的探寻和创新性研发具有重要的科学意义.
