IL-17a通过STAT3信号通路调节HaCaT细胞中IL-6、IL-22、IL-23的表达
2021-03-27刘瑞真吴小末
刘瑞真 吴小末


【关键词】 IL-17a HaCaT细胞 IL-6 IL-22 IL-23 STAT3
[Abstract] Objective: To explore the effect of interleukin-17a (IL-17a) on the expression of IL-6, IL-22, IL-23 in human immortalized keratinocytes (HaCaT) cells and possible mechamism of IL-17a regulating IL-6, IL-22, IL-23 in keratinocytes. Method: HaCaT cells were divided into blank control group (DMEM high-glucose medium only), induction group (DMEM high-glucose medium containing 80 μg/L IL-17a) and inhibitor group (DMEM high-glucose medium containing 80 μg/L IL-17a and 10 μg/L STAT3 inhibitor Piceatannol). After 48 h, we examined the expression of IL-6, IL-22, IL-23 by double antibody sandwich enzyme-1inked immunosorbent assay (ELISA) in the cells supernatant and realtime polymerase chain reaction (RT-PCR) was used to detect the mRNA expression levels of IL-6, IL-22, IL-23 in HaCaT cell of all group. Protein expression of STAT3 was detected by Western Blot. Result: Compared with blank control group and inhibitor group, the expression levels and mRNA of IL-6, IL-22 and IL-23 in HaCaT cells in induction group were significantly increased (P<0.05). Compared with the blank control group and the inhibitor group, the expression level of STAT3 protein in HaCaT cells in the induction group was significantly increased (P<0.05). Conclusion: Il-17a can promote the secretion of IL-6, IL-22 and IL-23 by HaCaT cells, which may be regulated by STAT3.
[Key words] IL-17a HaCaT cells IL-6 IL-22 IL-23 STAT3
First-author’s address: Dermatology Hospita of Fuzhou, Fuzhou 350000, China
doi:10.3969/j.issn.1674-4985.2021.26.004
銀屑病是一种慢性、复发性、炎症性皮肤病,全球发病率为2%~3%[1]。近年来该病发病率逐渐上升,其发病机制一直是皮肤科的研究热点,该病一度被认为是由TNF介导的Th1型免疫应答相关的疾病。随着第3种辅助性T细胞(T helper 17 cell,Th17)的发现,传统的银屑病免疫学发病机制受到了很大的挑战[2]。Th17是一种新发现的CD4+效应T细胞,分泌IL-17a、IL-17F、IL-22等,而其中IL-17a被认为是银屑病生理发病机制的关键[3-4],IL-17a具有诱导趋化、抑制中性粒细胞凋亡、促进新生血管形成、促进活化的角质形成细胞产生更多趋化因子、促进其他细胞因子(TNF-α、IL-1、IL-6)生成等作用[5]。以往研究发现银屑病患者外周血及其皮损处IL-6、IL-17、IL-22、IL-23表达水平明显增高[6-7]。关于银屑病发病机制信号通路的研究发现,信号传导和转录激活因子3(signal-transducer and activator of transeription-3,STAT3)在银屑病患者皮损处角质形成细胞中的表达也是升高的,该细胞因子与信号传导和转录因子被证实与细胞的增殖分化及凋亡关系密切,与银屑病角质细胞的过度增生可能有着一定的联系。有研究发现IL-17a可激活STAT3,进而激活细胞增殖的细胞内信号通路,在银屑病角质形成细胞增殖中发挥重要作用[8]。本研究通过建立IL-17a诱导HaCaT细胞增殖模型,探讨IL-17a调控角质形成细胞中IL-6、IL-22、IL-23表达的可能机制。
1 材料与方法
1.1 材料 (1)细胞。HaCaT细胞株(人永生化表皮細胞)购于ATCC。(2)主要药物和试剂。IL-17a抗体购于abcam IL-6 ELISA试剂盒、IL-22 ELISA试剂盒、IL-23 ELISA试剂盒购于abcam;STAT3抑制剂(白皮衫醇)购于MCE;DMEM培养液、胎牛血清、0.25%胰蛋白酶/EDTA、青霉素/链霉素双抗溶液购自美国Gibco公司;BCA蛋白浓度测定试剂盒(50T)购于北京索来宝科技有限公司;STAT3WB抗体购于abcam公司。(3)主要仪器。CO2恒温培养箱、超净工作台、倒置相差显微镜、冷冻高速离心机,QPCR仪,酶标仪,80 ℃低温冰箱、-20 ℃冰箱、4 ℃冰箱,电泳系统及电泳槽,凝胶成像系统。
1.2 方法
1.2.1 细胞培养 HaCaT细胞使用高糖DMEM培养基(内含10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素),培养条件为5%CO2、37 ℃恒温培养箱,饱和湿度95%。以5×106个/mL HaCaT细胞铺于6孔板中,用含10%胎牛血清的高糖DMEM培养基培养24 h。待其细胞达到70%~80%融合度时开始分组。
1.2.2 细胞分组与处理 空白对照组(DMEM高糖培养基)、诱导组(含80 μg/L IL-17a的DMEM高糖培养基)、抑制剂组(含80 μg/L IL-17a的DMEM高糖培养基和10 μmol/L白皮衫醇),每组设置3个复孔,细胞重复培养6次,刺激48 h后分别收集上清和细胞。
1.2.3 ELISA法检测细胞分泌炎症因子IL-6、IL-22、IL-23 收集上述不同分组的细胞培养上清液,应用ELISA法检测IL-6、IL-22、IL-23浓度,按试剂盒说明书进行操作,每个样本和标准品均设3个复孔,用酶标仪在450 nm波长下测定吸光度(A)值,根据标准曲线计算出样品浓度。
1.2.4 Real-time PCR法检测细胞因子IL-6、IL-22、IL-23 mRNA的表达 Trizol法提取细胞总RNA,使用逆转录酶进行逆转录,得到相应cDNA,以β-actin为参照,用Ultra SYBR Mixture进行扩增,检测细胞因子IL-6、IL-22、IL-23的mRNA表达。引物见表1。反应条件:95 ℃ 10 min;95 ℃ 15 s、60 ℃ 60 s,45个循环。实验结果以Ct值反映基因mRNA含量,采用2-ΔΔCt对数据进行相对定量分析。
1.2.5 Western Blot法检测各组细胞STAT3表达水平 48 h后收集细胞提取蛋白,BCA法测定蛋白浓度,取10 μg蛋白样本,经SDS-PAGE后,转膜,用5%牛血清白蛋白封闭,封闭完将NC膜放入装有一抗(β-actin,STAT3)的抗体杂交盒中,摇床4 ℃孵育过夜。第二天用TBST洗涤孵育好的NC膜,洗3次,10 min/次。清洗完毕后,将NC膜放入
1︰5 000稀释的鼠二抗杂交盒中,水平摇床上室温孵育2 h;将NC膜平置于透明膜上,Thermo ECL试剂盒的A液和B液等体积混合后加到膜表面,暗处静置3 min后去除膜上发光液,置于透明膜上。采用凝胶成像系统Versa DocTM imaging system发光检测,收集条带图像。用凝胶成像系统分析条带灰度值,确定样品中目的蛋白表达的相对含量。
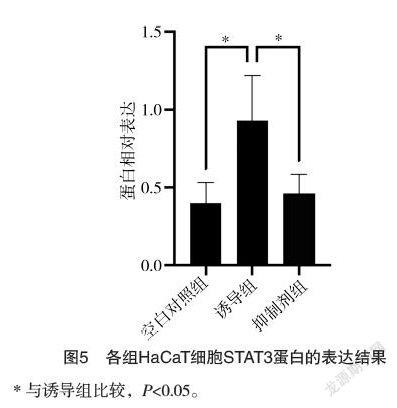
1.3 观察指标 比较各组HaCaT细胞IL-6、IL-22、IL-23表达水平;比较各组HaCaT细胞IL-6、IL-22、IL-23 mRNA结果;比较各组HaCaT细胞STAT3蛋白表达情况。
1.4 统计学处理 用SPSS 22.0统计软件进行分析,实验数据均采用(x±s)表示,方差齐性用单因素方差分析(one-way ANOVE),多组间两两比较采用t检验,以P<0.05表示差异有统计学意义。
2 结果
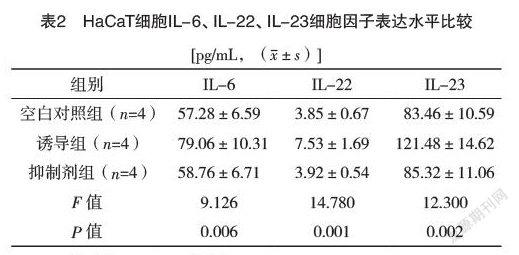
2.1 各组HaCaT细胞IL-6、IL-22、IL-23表达水平比较 空白对照组、诱导组和抑制剂组HaCaT细胞IL-6、IL-22、IL-23表达水平比较,差异均有统计学意义(P<0.05);与空白对照组和抑制剂组比较,诱导组的HaCaT细胞IL-6、IL-22、IL-23表达水平均明显升高,差异均有统计学意义(P空白对照组=0.028 0、0.042 9、0.014 6,P抑制剂组=0.030 6、0.041 3、0.031 3)。见图1~3和表2。
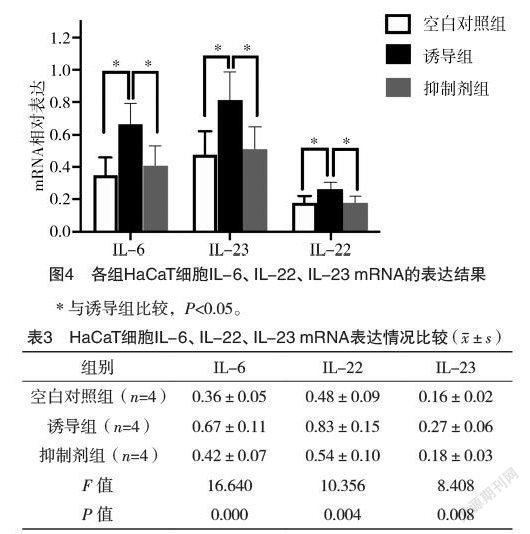
0.012 8、0.043 9、0.019 8,P抑制剂组=0.037 7、0.045 6、0.046 8)。见图4和表3。
3 讨论
IL-17a是一个促炎症细胞因子,银屑病患者皮損处角质形成细胞IL-17a的表达水平明显升高,提示IL-17a在银屑病的发病中起着至关重要的作用[9]。STAT3是一种重要的转录因子,与肿瘤、自身免疫性疾病等相关,通过参与Th17细胞分化、角质形成细胞过度增生与异常分化、与炎症细胞相互作用、真皮血管增生等重要病理过程在银屑病发病中起关键作用[10-11]。有研究发现,IL-17可通过激活JAK2/STAT3信号通路促进角质形成细胞VEGF的表达,提示STAT3可能介导IL-17诱导角质细胞的增殖[12]。通过研究笔者发现IL-17a可以促进HaCaT细胞分泌IL-6、IL-22、IL-23。其中IL-6与表皮、真皮细胞的生长、分化有关,可引起自身抗原体呈异常而触发自身免疫反应,可直接刺激T细胞向表皮迁移、促进角质形成细胞和T细胞增殖和活化,且和银屑病的严重程度相关[13];IL-22是一种具有免疫调节作用的炎症性因子,主要由活化的Th22细胞、Th17细胞以及NK细胞分泌产生[14]。有研究发现IL-22在银屑病患者皮损和外周血的表达异常升高,通过调节角质形成细胞的增殖和分化从而促进银屑病的发生发展[15],此外IL-22与银屑病患者的病情严重程度有关,不同分期患者的PASI评分与血清IL-22呈正相关[16]。IL-23是银屑病发病过程中IL-17和IL-23/Th17轴的一个不可或缺的细胞因子。IL-23不仅可以诱导角质形成细胞增殖,还促进新生血管生成并募集中性粒细胞与巨噬细胞等[17],还可促进Th17细胞的分化、活化,加强Th17细胞诱发免疫紊乱和维持其功能是[18]。通过研究笔者还发现IL-17a刺激HaCaT细胞分泌IL-6、IL-22、IL-23的这一过程,可通过抑制STAT3的表达而被抑制,提示STAT3在IL-17a促进银屑病发生发展过程中的重要作用,通过阻断STAT3的表达,可以使IL-17a促角质形成细胞分泌炎症性细胞因子的能力下降,从而减缓角质细胞的增殖速度同时减轻局部的炎症反应[19],进而减缓疾病的进展。
尽管目前IL-17、IL-23抗体在银屑病治疗中取得了非常显著的成效[20],但作用于STAT3及其上游通路的相关因子如JAK1/2,也是目前一个治疗靶点,其口服及外用药物的剂型,以及其较低的经济成本、较少诱导的不良免疫反应,为其在临床中的应用起到了一个很好的铺垫,本研究进一步验证了STAT3在银屑病发病过程中起的重要作用,为今后开展银屑病新的靶向治疗提供理论依据。
参考文献
[1] Aguilar-Flores C,Castro-Escamilla O,Ortega-Rocha E M,et al.Association of Pathogenic Th17 Cells with the Disease Severity and Its Potential Implication for Biological Treatment Selection in Psoriasis Patients[J].Mediators of Inflammation,2020,2020:1-16.
[2] Hawkes J E,Yan B Y,Chan T C,et al.Discovery of the IL-23/IL-17 Signaling Pathway and the Treatment of Psoriasis[J].The Journal of Immunology,2018,201(6):1605-1613.
[3] Blauvelt A,Chiricozzi A.The Immunologic Role of IL-17 in Psoriasis and Psoriatic Arthritis Pathogenesis[J].Clin Rev Allergy Immunol,2018,55(3):379-390.
[4]解欣然,张蕾,刘欣,等.丹皮酚通过STAT3通路抑制IL-17A诱导的角质形成细胞活性和细胞因子分泌[J].中国病理生理杂志,2020,36(10):1854-1859.
[5] Chen K,Kolls J K.Interluekin-17A (IL-17A)[J].Gene,2017,614:8-14.
[6] Andrea C,Paolo R,Elisabetta V,et al.Scanning the Immunopathogenesis of Psoriasis[J].International Journal of Molecular Sciences,2018,19(1):179.
[7]张小静,陈绍斐,李硕,等.PV患者外周血T细胞亚群、IL-17A和IL-23表达及临床意义[J].分子诊断与治疗杂志,2021,13(5):832-835.
[8] Sakkas L I,Bogdanos D P.Are psoriasis and psoriatic arthritis the same disease?The IL-23/IL-17 axis data[J].Autoimmun Rev,2017,16(1):10-15.
[9] Mercurio L,Failla C M,Capriotti L,et al.Interleukin (IL)-17/IL-36 axis participates to the crosstalk between endothelial cells and keratinocytes during inflammatory skin responses[J/OL].PLoS ONE,2020,15(4):e0222969.
[10]陈怡雯,苏婷,苏忠兰.银屑病与STAT3[J].中华皮肤科杂志,2019,52(7):502-505.
[11]孙淑娜,魏海峰,许博涵,等.龙胆泻肝汤对人HaCaT细胞STAT3信号通路的调控研究[J].中国中西医结合皮肤性病学杂志,2020,19(3):220-223.
[12]卢永申,魏明.IL-17A对人永生化角质形成细胞角蛋白17表达及STAT3信号通路的影[J].山东医药,2018,58(10):25-28.
[13]魏荣,吴斌,吕静.白细胞介素-6抑制剂对银屑病模型大鼠背部皮肤组织的影响及作用机制[J].中国老年学杂志,2020,40(4):856-860.
[14]张鼎伟,张燕飞,汪炜,等.SPINK7对IL-22介导的角质细胞异常增殖及炎症应答的影响[J].中国免疫学杂志,2021,37(1):26-30.
[15] Wawrzycki B.Interleukin-22 and Its Correlation with Disease Activity in Plaque Psoriasis[J].Arch Immunol Ther Exp (Warsz),2019,67(2):103-108.
[16]杨正生,戴秀荣,王心妹,等.斑块状银屑病患者血清白细胞介素-22水平与病情严重程度的相关性[J].中华实用诊断与治疗杂志,2020,34(11):1129-1131.
[17]王雾,杨梅,蒋梦雅,等.人参皂苷CK对咪喹莫特诱导小鼠银屑病的治疗作用[J].中国药理学通报,2021,37(1):31-37.
[18]肖光文,陈美任,周正锋,等.sPD-1、IL-17A、IL-23和IL-37在寻常型银屑病患者血清中的表达与意义[J].中国免疫学杂志,2021,37(5):591-594.
[19]李明遥,黎艳红,赵毅.JAK抑制剂在自身免疫性疾病皮損中的应用[J].内科急危重症杂志,2021,27(2):98-101.
[20]姜蔚蔚,张春雷.银屑病生物制剂治疗新进展[J].现代中西医结合杂志,2019,28(30):3412-3415.
(收稿日期:2021-08-10) (本文编辑:张爽)
