老年大鼠慢性阻塞性肺疾病模型建立后认知功能的变化
2021-03-25万朝晖刘冰景珩吴苏宁
万朝晖 刘冰 景珩 吴苏宁


【摘要】 目的:探討老年大鼠慢性阻塞性肺疾病模型建立后认知功能的变化。方法:选择60只老年雄性SD大鼠,按照随机数字表法分为COPD组(30只)和对照组(30只)。COPD组大鼠采用气道内滴注脂多糖和香烟烟熏法建立慢性阻塞性肺疾病模型。模型建立后,采用HE染色法观察两组的组织形态学变化。在慢性阻塞性肺疾病模型建立后的第1、7、14、30天,采用Morris水迷宫系统检测两组的平均逃避潜伏期。采用t检验和重复测量方差分析比较两组平均逃避潜伏期的差异和变化。结果:实验期间,COPD组3只大鼠死亡,对照组2只大鼠死亡,其余大鼠存活良好。HE染色显示两组间有显著性差异。干预前,两组平均逃避潜伏期比较,差异无统计学意义(P>0.05);慢性阻塞性肺疾病模型建立后第1、7、14、30天,COPD组老年大鼠的平均逃避潜伏期均明显长于对照组(P<0.05),差异逐渐增大。结论:慢性阻塞性肺疾病模型建立后,老年大鼠的平均逃避潜伏期增加,认知功能下降,随着时间的推移,老年大鼠的认知功能越来越差,应早期进行临床干预。
【关键词】 慢性阻塞性肺疾病 老年 认知功能
Changes of Cognitive Function after Establishment of Chronic Obstructive Pulmonary Disease Model in Elderly Rats/WAN Zhaohui, LIU Bing, JING Heng, WU Suning. //Medical Innovation of China, 2021, 18(33): 00-008
[Abstract] Objective: To explore the changes of cognitive function of aged rats after the establishment of chronic obstructive pulmonary disease model. Method: A total of 60 aged male SD rats were selected and divided into the COPD group (30 rats) and the control group (30 rats) according to the method of random number table. The COPD group rats were established COPD model by intratracheal instillation of lipopolysaccharide and fumigation. After the establishment of the model, HE staining was used to observe the histopathological changes of the two groups. On the first day and the 7th, 14th and 30th day after the establishment of the COPD model, Morris water maze system was used to detect the average escape latency of the two groups, t-test and repeated measurement analysis of variance were used to compare the differences and changes of the average escape latency of the two groups. Result: During the experiment, 3 rats in the COPD group died, 2 rats in the control group died, and the other rats survived well. HE staining showed that there was significant difference between the two groups. Before intervention, there was no significant difference in the average escape latency between the two groups (P>0.05); on the first day, the 7th, 14th and 30th day after the establishment of COPD model, the average escape latency time of the old rats in the COPD group were significantly longer than those of the control group (P<0.05), the difference gradually increased. Conclusion: After the establishment of COPD model, the average escape latency of elderly rats increases and the cognitive function decreases, with the passage of time, the cognitive function of elderly rats becomes worse and worse, so clinical intervention should be carried out early.
[Key words] COPD Elderly Cognitive function
First-author’s address: Jining First People’s Hospital, Jining 272100, China
doi:10.3969/j.issn.1674-4985.2021.33.002
慢性阻塞性肺疾病(COPD)具有显著的肺外合并症,神经系统功能障碍是COPD的主要肺外并发症之一,通常表现为感觉运动功能障碍[1],也有不同程度的短期和长期记忆障碍和注意力障碍[2-3]。认知功能障碍是指患者存在一项或多项功能受损如记忆、视空间觉、执行能力、计算和理解能力等。合并认知功能障碍的COPD患者生活质量明显下降,再住院率及死亡率升高[4]。COPD患者认知障碍的风险随着COPD持续时间而增加[5]。当血氧饱和度低于88%时,认知障碍的发生率增加了2.5倍[6]。Hoiland等[7]报道,长期氧疗的COPD患者认知功能评分高于未进行氧疗患者。因此,认知障碍与COPD严重程度存在相关性,但目前有关COPD病程中认知功能变化特征的研究较少。因此,本研究旨在建立老年大鼠COPD模型,同时评估不同时间点老年大鼠认知功能的变化,并与正常老年大鼠进行对比分析,现报道如下。
1 材料与方法
1.1 实验动物 本研究选用60只雄性SD大鼠,月龄18~20个月,体重450~500 g,均购自北京乾信实验动物有限公司。将大鼠按照随机数字表法分为COPD组(n=30)和对照组(n=30)。大鼠被饲养在室温26~28 ℃、每天日照时间为12 h的动物实验室,所有大鼠能够自由进食和饮水。在动物实验室中适应性喂养1周后,对大鼠进行测试。
1.2 建立COPD模型 大鼠COPD模型采用气道内滴注脂多糖和香烟烟熏法建立[8]。模型在30 d内完成。在第1、14天,将10%水合氯醛注射到大鼠的腹腔中进行麻醉。麻醉成功后,将200 μL脂多糖(1 g/L)注射入气道。在第2天至第30天(第14天除外),大鼠每天早上和下午接受两次烟熏,间隔时间超过6 h。将大鼠置于1 m3的密闭房间中,每天连续吸入香烟烟雾2次,每次10支香烟。对照组气道内注射0.9%氯化钠溶液。
1.3 观察指标及判定标准 (1)组织形态学观察。第31天应用苏木精-伊红(HE)染色观察两组支气管肺组织病理学变化。乙醇脱水、二甲苯透明、蜡杯浸泡、包埋和切片后,将染色的载玻片干燥。在光学显微镜下观察两组大鼠染色支气管和肺组织的病理变化,进行形态学分析,确认COPD建模成功。(2)认知功能检测。采用北京硕林苑科技有限公司设计的Morris水迷宫系统检测大鼠的认知功能。控制室温度为25 ℃,内部环境保持低光和安静。向水池中加入水,水面覆盖1 cm的平台,调节水温到25 ℃,水面被分成四个象限,即1、2、3、4,平台被放置在第一象限的中心。大鼠分别从四个象限的中央面向池壁放入水中。观察60 s,记录大鼠找到并停留在平台顶部的时间,即为逃避潜伏期,若60 s内未找到平台或仅发现平台的被记录为60 s。取四个象限所用时间的平均值来计算平均逃避潜伏期。干预前,用上述方法训练大鼠3 d,大鼠在进入水中前平均每次在平台顶部停留20 s[8-9]。在COPD模型建立后的第1、7、14、30天,根据上述方法检测并记录平均逃避潜伏期。
1.4 统计学处理 采用SPSS 26.0统计软件对所得数据进行处理。计量资料以(x±s)表示。两组比较采用独立样本t检验。重复测量的数据采用方差分析,P<0.05为差异有统计学意义。
2 结果
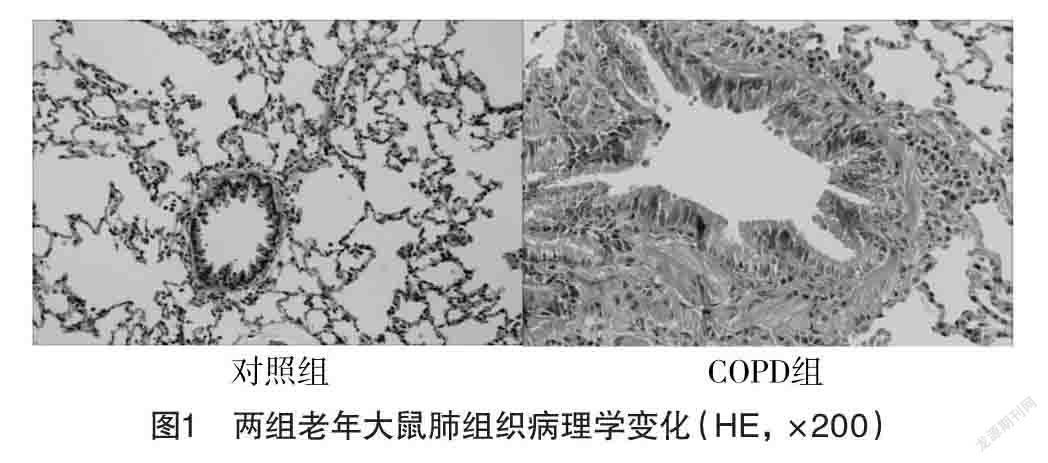
2.1 老年大鼠肺组织形态学观察 在实验过程中,由于建模不当和麻醉剂过量,COPD组有3只大鼠死亡、对照组有2只大鼠死亡。通过HE染色,对照组老年大鼠肺腔通畅、肺泡结构完整、形态正常、纤毛形态正常、支气管平滑肌未见明显增厚。COPD组的肺支气管壁明显增厚、管腔变窄、肺泡壁破裂并变薄、肺泡融合形成水泡、支气管内有大量炎症细胞浸润、纤毛脱落并虚脱、大量上皮细胞脱落。见图1。
2.2 两组老年大鼠平均逃避潜伏期比较 干预前,两组平均逃避潜伏期比较,差异无统计学意义(P>0.05)。在COPD模型建立后的第1、7、14、30天,COPD组老年大鼠的平均逃避潜伏期均明显长于对照组,差异均有统计学意义(P<0.05);重复测量设计方差分析结果显示,随着时间的推移,COPD组内老年大鼠的平均逃避潜伏期逐渐增加(P<0.05),见表1和图2。
3 讨论
COPD是一种以不完全可逆的气流受限为特征的慢性炎症性疾病,且在55岁之后发病率明显增加[10]。一项基于中国纵向健康长寿调查的队列研究显示,COPD与中国老年人认知障碍和痴呆发病率增加独立相关[11]。核磁共振分析发现,COPD患者进行性脑结构损伤、脑局部自发活动同步性异常、内在的功能枢纽和连接性改变与COPD相关认知障碍有关[12-13],因此,早期识别COPD患者认知功能的变化对改善其预后尤为重要。Morris水迷宫模型是检验啮齿动物模型学习记忆功能的经典实验,能够客观反映动物模型的认知水平。平均逃避潜伏期越长,动物获取空间信息的能力越差[14]。本研究采用最经典的Morris水迷宫系统检测老年COPD大鼠的认知功能,结果表明,老年COPD大鼠的平均逃避潜伏期明显高于对照组,且Morris等[2]报道,严重COPD的动物模型表现出显著的记忆障碍、焦虑、运动和自主神经障碍,提示COPD模型的建立可导致老年大鼠认知功能障碍。
尽管大量研究证实COPD和认知障碍存在相关性,但目前有关肺功能、低氧血症、疾病严重程度、病程等因素和认知障碍的风险仍不确定[11-12,15],可能与不同研究方法相关,如评估量表、年龄、样本量、缺乏适当的参照。一项基于COPD患者的前瞻性研究发现,基线COPD病史>5年患者认知障碍风险显著增加,但在校正吸烟、糖尿病、高血壓、冠状动脉疾病等因素后COPD与认知障碍风险增加无显著相关性,经过认知障碍亚型分析,COPD患者非遗忘性认知障碍风险升高2倍[16]。而且一项对2 000名随访25年结果显示,中年(39~64岁)诊断COPD在晚年(65~80岁)发生认知障碍的风险增加近2倍,反而晚年诊断COPD似乎与认知障碍呈负相关[17],由此推测,COPD患者的认知障碍可能与COPD的持续时间呈“剂量依赖性”,认知障碍可能开始于慢性气道损伤的早期阶段[18],但上述研究中COPD诊断来源于患者自我报告或医疗记录,缺乏肺功能、病理学等依据,且基线和随访之间的较长时间间隔可能导致偏倚。因此,本研究通过设立4个观察时间点客观评估老年大鼠认知功能,结果发现随着时间的增加老年大鼠的平均逃避潜伏期也逐渐增加(认知功能越来越差),表明COPD作为认知障碍的危险因素,早期积极治疗COPD,对预防或延迟认知障碍的发生和发展有重要作用。
COPD患者的認知障碍独立于肺部疾病相关危险因素(如年龄和吸烟等),但也受到相关危险因素和/或呼吸限制(如低氧血症)的影响[7,19]。因此还需进一步研究证实COPD和认知障碍的关系及相关机制,以更好地理解COPD患者认知功能下降的发生发展。目前关于COPD患者认知障碍的潜在病理生理机制包括大脑缺氧、脑结构改变和与炎症介质相关的神经元损伤[12-13]。研究显示,COPD低氧血症和认知障碍存在关系,氧气疗法和肺康复可降低认知障碍的风险[7]。但是COPD患者认知障碍的病理机制复杂多样,低氧血症本身并不能解释COPD中发生的认知变化,也缺乏在大量人群中进行的前瞻性纵向研究。YIN等[13]研究发现,随着COPD患者的症状从轻度到重度,患者脑的白质和灰质也表现出不同程度的损害。海洋生物活性化合物可以通过抗氧化、保护神经元细胞等机制延缓COPD患者认知功能下降[20]。另外,中性粒细胞与淋巴细胞比值与COPD的严重程度有关[13],因此炎症因子“溢出”可能导致COPD患者的认知障碍,未来的炎症因子或二氧化碳潴留可能是COPD患者认知障碍的潜在机制。
综上所述,本研究发现老年COPD大鼠的平均逃避潜伏期较对照组增加,认知功能下降,且随着时间的推移,老年COPD大鼠的平均逃避潜伏期逐渐增加,老年COPD大鼠认知功能越来越差。因此,在临床实践中应注意评估COPD患者认知功能,并尽早进行临床干预,对于提高COPD患者生活质量和降低死亡率非常重要。
参考文献
[1]陈琰,钱频,袁琳.慢性阻塞性肺疾病肺外合并症的治疗现状和研究进展[J/OL].中华肺部疾病杂志(电子版),2020,13(1):100-103.
[2] Morris C,Mitchell J W,Moorey H,et al.Memory,attention and fluency deficits in COPD may be a specific form of cognitive impairment[J].ERJ Open Res,2019,5(2):229-2018.
[3] Cleutjens F A,Franssen F M,Spruit M A,et al.Domain-specific cognitive impairment in patients with COPD and control subjects[J].Int J Chron Obstruct Pulmon Dis,2017,12:1-11.
[4] Ouellette D R,Lavoie K L.Recognition, diagnosis, and treatment of cognitive and psychiatric disorders in patients with COPD[J].Int J Chron Obstruct Pulmon Dis,2017,12:639-650.
[5] Kakkera K,Padala K P,Kodali M,et al.Association of chronic obstructive pulmonary disease with mild cognitive impairment and dementia[J].Curr Opin Pulm Med,2018,24(2):173-178.
[6] Kotel’Nikov V N,Osipov I O,Zayats Y V,et al.Assessment of Cardiac Vegetative Control during Acute Graduated Exogenous Normobaric Hypoxia in Rats[J].Bulletin of Experimental Biology & Medicine,2018,164(5):591.
[7] Hoiland R L,Mladinov S,Barak O F,et al.Oxygen therapy improves cerebral oxygen delivery and neurovascular function in hypoxaemic chronic obstructive pulmonary disease patients[J].Exp Physiol,2018,103(8):1170-1177.
[8]赵朝华,廖和和,王甲林,等.阿奇霉素对慢阻肺大鼠肺脏病理损伤、氧化应激及TLR4/NF-κB信号通路的调节作用[J].西部医学,2019,31(12):1831-1836.
[9] TIAN H,DING N,GUO M,et al.Analysis of Learning and Memory Ability in an Alzheimer’s Disease Mouse Model using the Morris Water Maze[J/OL].J Vis Exp,2019,29(152):e60055.
[10] Singh D,Agusti A,Anzueto A,et al.Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Lung Disease: the GOLD science committee report 2019[J].Eur Respir J,2019,53(5):1900164.
[11] XIE F, XIE L.COPD and the risk of mild cognitive impairment and dementia: a cohort study based on the Chinese Longitudinal Health Longevity Survey[J].Int J Chron Obstruct Pulmon Dis,2019,14:403-408.
[12] LI H,XIN H,YU J,et al.Abnormal intrinsic functional hubs and connectivity in stable patients with COPD: a resting-state MRI study[J].Brain Imaging Behav,2020,14(2):573-585.
[13] YIN M,WANG H,HU X,et al.Patterns of brain structural alteration in COPD with different levels of pulmonary function impairment and its association with cognitive deficits[J].BMC Pulm Med,2019,19(1):2-10.
[14] Illouz T,Madar R,Okun E.A modified Barnes maze for an accurate assessment of spatial learning in mice[J].J Neurosci Methods,2020,9(334):108579.
[15] Samareh F M,Hashemi-Bajgani S M,Naghibzadeh-Tahami A,et al.Cognitive Impairment among Patients with Chronic Obstructive Pulmonary Disease Compared to Normal Individuals[J].Tanaffos,2017,16(1):34-39.
[16] Singh B,Parsaik A K,Mielke M M,et al.Chronic obstructive pulmonary disease and association with mild cognitive impairment: the Mayo Clinic Study of Aging[J].Mayo Clin Proc,2013,88(11):1222-1230.
[17] Rusanen M,Ngandu T,Laatikainen T,et al.Chronic obstructive pulmonary disease and asthma and the risk of mild cognitive impairment and dementia: a population based CAIDE study[J].Curr Alzheimer Res,2013,10(5):549-555.
[18] Dal N R W,Bonadiman L,Tognella S,et al.Extent and prevalence of cognitive dysfunction in chronic obstructive pulmonary disease, chronic non-obstructive bronchitis, and in asymptomatic smokers, compared to normal reference values[J].Int J Chron Obstruct Pulmon Dis,2014,9:675-683.
[19] WANG T,MAO L,WANG J,et al.Influencing Factors and Exercise Intervention of Cognitive Impairment in Elderly Patients with Chronic Obstructive Pulmonary Disease[J].Clin Interv Aging,2020,21(15):557-566.
[20] Prinzi G,Santoro A,Lamonaca P,et al.Cognitive Impairment in Chronic Obstructive Pulmonary Disease (COPD): Possible Utility of Marine Bioactive Compounds[J].Mar Drugs,2018,16(9):313.
(收稿日期:2021-08-25) (本文編辑:占汇娟)
