Musca domestica cecropin协同头孢曲松钠抗鼠伤寒沙门氏菌及生物被膜作用研究
2021-03-24曾佳利桂水清卢雪梅
曾佳利,桂水清,卢雪梅
沙门氏菌是具有重要意义的人兽共患病原菌之一。对于人类,沙门氏菌的主要污染源是受污染的食物和水源,沙门氏菌可寄生在人类和动物的胃肠道中,其中受威胁最大的是儿童、老年人及免疫缺陷个体[1]。在我国,每年由沙门氏菌引起的食物中毒事件占所有食源性中毒事件的比例高达40%~60%,其中鼠伤寒沙门氏菌 (Salmonellatyphimurium) 是引起急性胃肠炎的主要病原菌之一,该菌宿主范围广泛,包括人类和动物[2-3]。
抗菌肽(Antimicrobial peptides,AMP)是一类具有广谱抗菌活性的小分子多肽,对病毒、真菌、原虫和癌细胞等均有杀灭作用,且对革兰阴性及阳性细菌有着高效广谱的杀伤力。抗菌肽主要作用机制大致可分为两类:膜结构破坏型与非膜结构破坏型[4-9],并且它们大多数具有净正电荷,这种净电荷与相当比例 (高达30%) 的疏水残基结合,是其抗菌活性的基础[10-12]。抗菌肽由于其特殊的抗菌机制使菌株不易产生耐药性,将是一种新型的抗菌药物。本课题组前期实验从家蝇幼虫脂肪体cDNA文库中克隆出一种家蝇抗菌肽(Muscadomesticacecropin, MDC),发现家蝇抗菌肽MDC能够在体外杀死多种革兰阴性菌和革兰阳性菌[13-14],同时对多重耐药大肠杆菌临床分离株的作用显著,溶血毒性低[15]。头孢曲松钠是第三代头孢菌素类抗生素,主要抗菌机制为影响细菌细胞壁的生物合成,抗菌谱广,是临床上抗菌治疗应用最广泛的抗生素类药物之一[16-17]。但根据研究表明,头孢曲松钠过度使用可导致鼠沙门氏菌产生耐药性[18],所以联合用药不失为一种新选择。
本研究拟通过体外实验分别观察MDC、头孢曲松钠及联合用药对鼠伤寒沙门氏菌的抑菌作用,同时检测MDC与头孢曲松钠联合用药对生物膜活性影响,并初步探讨它们之间的协同抗菌机制,评估2种药联用治疗鼠伤寒沙门氏菌感染的潜在应用价值。
1 材料与方法
1.1材料与仪器
1.1.1实验菌株及药物 鼠伤寒沙门氏菌CMCC5011购自广东省微生物菌种保藏中心;头孢曲松钠1.0 g/瓶购自广东三才医药集团有限公司;抗菌肽MDC纯度97.15%;分子量:4 301.59 Da北京中科亚光生物科技有限公司合成。
1.1.2主要试剂 甲醇、二甲基亚砜购自广州化学试剂厂;无水乙醇、二甲苯购自天津市大贸化学试剂厂;戊二醛25%溶液购自天津市科密欧化学试剂有限公司;MRS培养基购自广东环凯微生物科技有限公司;胰蛋白胨购自广东环凯微生物科技有限公司;TSBg培养基购自广东环凯微生物科技有限公司;0.5%无菌TTC溶液购自广东环凯微生物科技有限公司。
1.1.3仪器 MD 2500荧光倒置显微镜、DMI 2500显微镜,德国Leica公司;Model 680酶标仪,美国Bio-Rad公司,721分光光度计,上海菁华科技有限公司;流式细胞仪,美国BD公司;冷场发射扫描电子显微镜JSM-6330F、JEM1400透射电镜,日本电子株式会社。
1.2方 法
1.2.1MIC和MBC测定 采用微量肉汤二倍稀释法分别测定MDC及头孢曲松钠对鼠伤寒沙门氏菌的最小抑菌浓度(minimal inhibit concentration, MIC)和最小杀菌浓度(minimum bactericidal concentration, MBC)。将100 μL浓度为1×106CFU/mL的鼠伤寒沙门氏菌菌液加入96孔板,然后加入100 μL稀释好的MDC(2 mg/mL~4 μg/mL)及头孢曲松钠(0.25~128)μg/mL,于37 ℃恒温培养细菌18 h后将96孔板取出,以无细菌生长的最小药物浓度为MIC值。无菌操作下,吸取0.1 mL MIC值对应孔及大于MIC值的4个孔中的菌液,在LB固体培养基上均匀涂布,在37 ℃培养24 h,无菌落出现的最大稀释度对应的药物浓度值为最低杀菌浓度(MBC)值[20]。每组重复3次,取平均值。
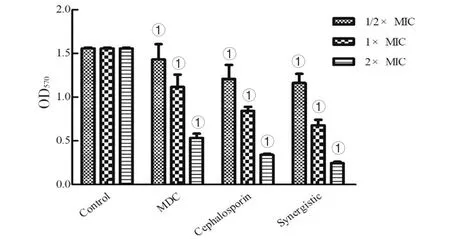
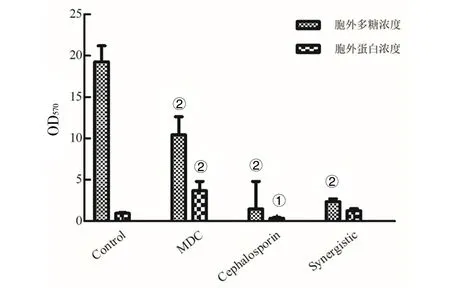
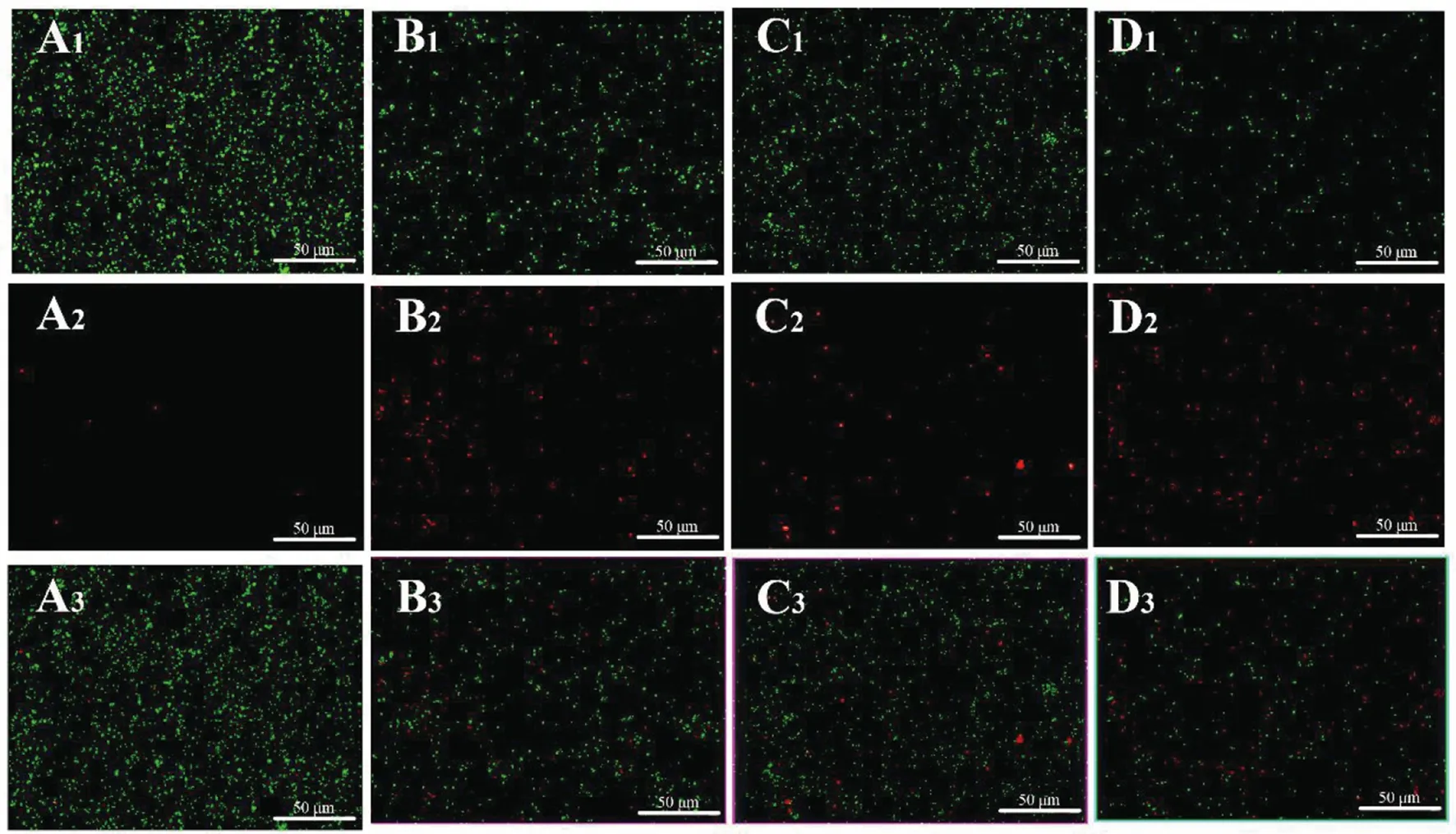
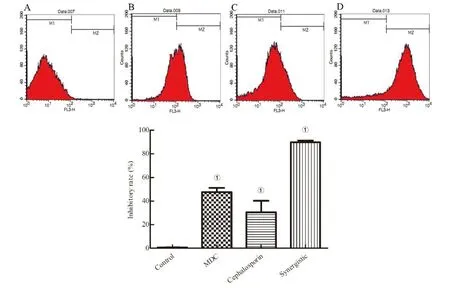
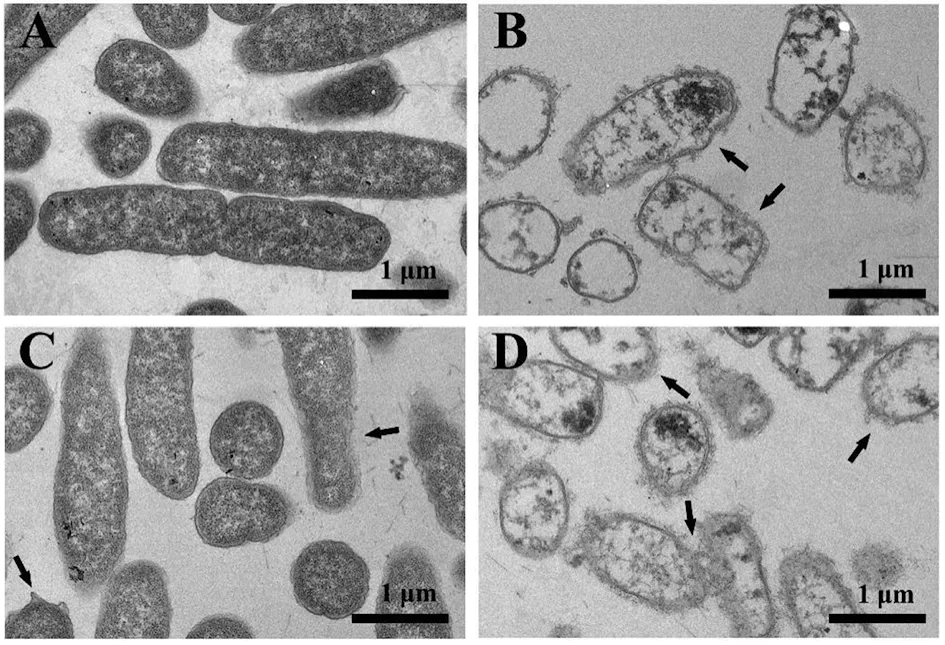
1.2.2FIC测定 根据头孢曲松钠(甲)、MDC(乙)对鼠伤寒沙门氏菌的MIC值和MBC值,将甲乙2种药依次稀释至浓度为2×MIC、1×MIC、1/2×MIC、1/4×MIC、1/8×MIC、1/16×MIC、1/32×MIC、1/64×MIC,共8个药物浓度梯度并做好标记。加入100 μL的菌液然后按梯度浓度依次加入甲50 μL于对应的孔中,随后再按梯度浓度差异顺序在垂直方向加入同体积的乙,标记后37℃恒温培养箱中培养18 h。第2天取出96孔板,观察各孔菌液的浑浊程度。棋盘法则计算联合指数 (fractional inhibitory concentration,FIC),根据FIC指数=MIC(联合用药组)/MIC(甲组单用)+MIC(联合用药)/MIC(乙组单用)。其中FIC值≤0.5时,表示甲与乙之间为协同抑菌作用;当FIC值处于0.5 1.2.3MDC和头孢曲松钠对生物被膜的作用 结晶紫染色实验中MDC组浓度为2×MIC,1×MIC,0.5×MIC;头孢曲松钠组浓度为2×MIC,1×MIC,0.5×MIC;联合用药组包括MDC与头孢曲松钠,2种药物的终浓度均达到1×MIC,培养基为空白对照组,纯菌液为阴性对照组。无菌6孔板每孔放入1张盖玻片作为生物被膜的载体,加入500 μL菌液,按照分组依次加入药液37 ℃恒温培养18 h后弃上清,无菌NS清洗3次,99%甲醇溶液固定,2%的结晶紫溶液染色5 min,洗去非特异吸附结晶紫后封片,于显微镜下观察拍摄。 对生物被膜初始附着的影响,盖玻片放入96孔板中,每孔加100 μL的菌液,给药组加入100 μL药液,TSBg培养基组为空白组,不加药组为阴性组,37 ℃培养箱培养2 h;无菌NS清洗3次,99%甲醇溶液固定,2%的结晶紫溶液染色5 min,每孔加入33%冰乙酸溶液160 μL,然后置于摇床振摇10 min;结晶紫完全溶解后,酶标仪(570 nm)测定OD值,每组重复3次。 采用96孔板测定MDC和头孢曲松钠对已形成的鼠伤寒沙门氏菌生物被膜的破坏作用。使用无菌96孔板接种浓度为1×106CFU/mL的菌液,每孔各100 μL;37 ℃培养24 h;弃去孔中的溶液,用NS清洗3次;按照分组依次加入药液100 μL (每个浓度3个复孔) ,37 ℃继续培养24 h;弃去孔中溶液后按照上述步骤操作酶标仪检测,每组重复3次。 1.2.4对胞外物质含量测定 摇菌管内加入5 mL稀释好的菌液,同时加入终浓度为128 μg/mL 的MDC和终浓度为1 μg/mL的头孢曲松钠,生理盐水作为对照组,每组重复6次。37 ℃培养箱培养8 h,EP管中加入1.8 mL菌液,离心20 min后,将沉淀加入蒸馏水重溶,然后加入37%的甲醛,4 ℃放置3 h后转移至室温,再加入1 mol/L的NaOH溶液在4 ℃放置3 h,离心后留取沉淀待查。采用苯酚-硫酸法测定胞外多糖的含量,BCA试剂盒法测定胞外蛋白的含量。 1.2.5荧光染色与流式细胞术 (Flow cytometry,FCM) 采用PI染液和SYTO 9染液对生物被膜进行荧光染色。将活化的鼠伤寒沙门氏菌菌液浓度稀释为5×108CFU/mL,以盖玻片为载体加入菌液培养18 h;加入药物后37 ℃ 静置处理1 h;取NS 1 mL,加入SYTO 9 (5 mmol/L) 0.5 μL、PI (7.5 mmol/L) 3.7 μL,混合均匀后加入6孔板中,室温避光染色15 min,用NS洗去未结合的荧光染液,荧光防淬灭剂封片,荧光显微镜下拍摄。 FCM的基本处理同上,避光染色15 min,将样品转移至流式管,流式上样处理。 1.2.6扫描电子显微镜 (Scanning electron microscope,SEM) 与透射电子显微镜 (Transmission electron microscope,TEM) 将生长至对数期的鼠伤寒沙门氏菌用PBS洗3次,调整浓度至1.5×108CFU/mL;将菌液加入Eppendorf 管中,再分别加入MDC和头孢曲松钠以及MDC和头孢曲松混合组 (使各管中药物终浓度为MIC),对照组加入等量的PBS;给药60 min后,离心收集菌体,在2.5%戊二醛中避光固定,PBS洗3次后制成菌悬液;依次用30%、50%、5%和95%乙醇脱水,每次10 min,无水乙醇重复脱水2次,每次10 min;将样品放入二氧化碳临界点干燥器内,干燥后的标本放入高真空蒸发器内,喷金镀膜,扫描电子显微镜下进行观察拍摄。 细菌培养和样本制备同SEM,药物作用60 min后,用2.5%戊二醛-1.5%多聚甲醛-0.1 M PBS (pH 7.2) 在4℃固定2 d;0.1 M PBS (pH 7.2) 漂洗3次,1%锇酸-1.5%亚铁氰化钾4℃固定1.5 h,0.1 mol/L PBS (pH 7.2) 漂洗3次,将样品脱水,制样后切片采用乙酸铀-柠檬酸进行染色。保存样品,于TEM下拍摄。 1.2.7数据分析 实验数据使用 Graphpad Prism 5 软件进行分析绘图,采用方差分析(ANOVA),检验水准α=0.05。 2.1MDC和头孢曲松钠抗菌结果与FIC值 MDC对鼠伤寒沙门氏菌的MIC为128 μg/mL,MBC为256 μg/mL;头孢曲松钠对鼠伤寒沙门氏菌的MIC为1 μg/mL,MBC为4 μg/mL,表1为实验结果。MDC和头孢曲松钠联用后FIC指数为0.218,FIC<0.5说明MDC与头孢曲松钠有较强的协同作用,这与预期结果相一致。其中,联合用药时MDC的MIC值是自身单用的1/4,头孢曲松的MIC值是其单用时的1/32。 2.2MDC和头孢曲松钠对生物被膜作用 药物对生物被膜的形成影响实验结果如图1所示:MDC组和头孢曲松钠组梯度MIC倍数的药物浓度对其生物被膜形成能力的影响力也呈相应梯度,且相较于空白对照组也具有一定的抑制作用。在同MIC倍数浓度中,MDC和头孢曲松钠联合用药组对生物被膜形成能力的抑制作用最强,结果显示MDC和头孢曲松钠能协同抑制鼠伤寒沙门氏菌所形成的生物被膜。 表1 对鼠伤寒沙门氏菌MIC、MBC和FIC的测定 A为空白对照组;B为1/2×MIC组;C为1×MIC组;D为2×MIC组。1为MDC组;2为头孢曲松钠组;3为联合用药组。 如图2所示,可知MDC和头孢曲松钠在所有浓度下均能一定程度上抑制初始生物被膜的附着,且抑制效果与药物浓度成正相关。在同比MIC倍数下,头孢曲松钠组效果更好。MDC和头孢曲松钠联合用药组对生物被膜附着的抑制作用最强。对成熟生物被膜的破坏作用结果如图3所示,MDC和头孢曲松钠在低浓度剂量(0.5×MIC)下对成熟生物被膜的破坏作用微弱,当药物浓度升高后具有一定的破坏作用,高剂量(2×MIC)下效果明显增强,联合用药组的效果优于单独用药组。 注:①与空白对照组相比,P<0.001 2.3生物被膜胞外物质含量测定 胞外物质含量如图4所示,MDC组、头孢曲松钠组和联合用药组胞外多糖浓度均小于对照组,说明3组均对胞外多糖的产生具有一定抑制作用。MDC组蛋白含量过高,可能与细胞膜的破坏导致胞内蛋白外泄有关,头孢曲松钠组蛋白含量相较于对照组有明显的减少,联合用药组虽然蛋白含量高于空白对照组,但总体低于MDC。 注:①与空白对照组相比,P<0.05; ②与空白对照组相比,P<0.001 2.4荧光染色和流式细胞术 图5为鼠伤寒沙门氏菌荧光染色,SYTO 9能与细菌内的DNA结合发出绿色荧光,PI具有更强的与DNA结合能力,但PI不能对结构完整的细菌染色,只有细菌死亡后才能被染成红色。被SYTO 9染色的活菌呈绿色荧光,红色荧光为被PI染色的死菌,SYTO 9和PI标记荧光可以反映细菌的死亡率和细菌的存活状态。图中阴性对照组呈均匀绿色荧光,而MDC组和头孢曲松钠组细菌有不同程度死亡,联合用药组死亡的细菌数目远大于单独用药组,这进一步证明MDC和头孢曲松钠在抑菌杀菌过程中存在一定协同作用。流式结果如图6所示,用PI染色后M2区域表示细胞膜破坏数量,MDC组和头孢曲松钠组均有一部分细胞膜被破坏,两药同浓度下MDC对细胞膜破坏率达47%,头孢曲松钠为30%对细胞膜破坏作用低于MDC,两药联合后细胞膜破坏率达89%,死亡细菌的数量显著上升。 2.5SEM观察细胞表面结构变化 扫描电镜结果如图7所示,对照组细菌整体结构完整。MDC组整体结构明显破坏,细胞膜出现一定的损伤,有部分内容物溢出形成絮状。头孢曲松钠组出现菌体断裂,个别菌株严重变形,出现缢痕,具有凹陷结构。联用组不仅出现细胞内容物外泄,同时损坏程度相较于单独用药组明显增强。 2.6TEM观察细胞超微结构变化 图8中可看出对照组中的鼠伤寒沙门氏菌细胞膜与细胞壁结构完整,细胞质均匀。MDC组中的细菌发生菌体变形,大部分的胞内物质外泄,细胞质出现空腔。头孢曲松钠组中出现菌体变形严重,表面粗糙,界限模糊,具有凹陷结构。联用组不仅出现细胞壁与细胞膜间隙增宽,同时胞内物质降解,呈现乱絮状,只剩下细胞壁的空腔,且细胞壁疏松,外层模糊,损坏程度也明显强于MDC与头孢曲松钠组。 A为对照组,B为 MDC组,C为头孢曲松钠组,D为联用组,1为SYTO 9染色,2为PI染色,3为 merge A为空白对照组,B为MDC组,C为头孢曲松钠组,D为联用组 A为空白对照组,B为MDC组,C为头孢曲松钠组,D为联用组 A为空白对照组,B为MDC组,C为头孢曲松钠组,D为联用组 沙门菌病是危害严重的人兽共患病之一,在抗生素类药物滥用的大环境下,头孢曲松钠单独使用容易导致沙门氏菌耐药株的产生。家蝇抗菌肽(MDC)属于抗菌肽的一种,拥有特殊的抗菌机制,不易诱导耐药菌株的产生,使其具有良好的应用前景。从机制上看,头孢曲松钠其主要抗菌机制为影响细菌细胞壁的合成,MDC则主要作用于细胞膜,二者联用具有可行性,这为联合用药抗鼠伤寒沙门氏菌开辟一条新途径。 细菌生物被膜是粘附于非生物或生物表面的微生物细胞菌落, 并由细胞外多聚基质包裹[22]。有学者认为细菌对抗生素的耐药性除了与耐药菌株的大量产生有关,亦同细菌在体内形成的生物被膜相关,生物被膜被公认是造成包括抗生素治疗在内的多种疾病治疗手段失败的重要原因[23]。同时研究发现生物被膜能对抗机体的免疫防御机制,不利于抗感染治疗[24],以抗菌肽为代表的肽类抗菌物质是治疗生物被膜的重要途径,能治疗野生型和多药抗性生物被膜并防止致命的铜绿假单胞菌感染。在铜绿假单胞菌生物被膜感染的无脊髓生物模型中,抗菌肽与抗生素联合应用明显增强了杀菌效果[25]。生物被膜的附着是细菌形成生物被膜的第一个步骤,同样也是生物被膜形成最关键的一步。给药后,结晶紫染色结果显示两种药单独用药都能对生物被膜的初始附着与形成产生抑制作用,并且能破坏成熟生物被膜,两药联用后以上效果更为显著,能有效降低细菌的耐药性。生物被膜胞外物质含量的检测结果中发现,头孢曲松钠组中鼠沙门氏菌的胞外多糖含量最低,这或许与头孢曲松钠的抗菌机制有关,头孢曲松钠对细菌胞外多糖分泌的抑制作用需要进一步研究。有报道称抗菌肽能在细胞膜上形成环孔,致使胞内容物大量外泄[26]。扫描电镜和透射电镜结果显示MDC能损伤菌体细胞膜和结构,使细菌内容物溢出,出现空腔;而头孢曲松钠会破坏菌体细胞壁,使其变形断裂。两药联用后则会更大程度的破坏细胞结构,导致细菌死亡。 综上所述,家蝇抗菌肽MDC和头孢曲松钠能协同抑制鼠伤寒沙门氏菌及初始生物膜,破坏成熟生物膜。MDC主要作用于细胞膜致使内容物泄露,头孢曲松钠破坏细胞壁使细菌菌体断裂,两药联用时具有协同作用,增强抗菌和抗生物膜活性,二者机制形成互补,相辅相成。 利益冲突:无2 结 果



3 讨 论
