兔多杀性巴氏杆菌C51-17株在疫苗效力检验中保存方法的研究
2014-11-29王秀丽张立春丁家波
张 媛,李 建,张 磊,王秀丽,张立春,丁家波
(中国兽医药品监察所,北京100081)
兔多杀性巴氏杆菌病是家兔养殖业严重的常见病之一[1-2],为预防控制该病中国许多学者开展了大量的疫苗研发工作,已经获得新兽药证书的产品有兔病毒性出血症、多杀性巴氏杆菌病、产气荚膜梭菌病(A型)三联灭活疫苗(皖阜株+C51-17株+苏84-A株)等11个产品。这些产品的效力检验均采用免疫攻毒法进行,C51-17株是其常用的攻毒用菌株。该菌株1~5 CFU活菌皮下注射可致死家兔,攻击的菌数对疫苗效力检验结果影响很大,因此,攻毒剂量的准确性在以C51-17株为攻毒菌株的效力检验中显得尤为重要。为了保证攻毒剂量准确,必须对攻毒菌液浓度有准确的把握。传统采用将菌液4℃保存过夜计算菌存率及测定菌液吸光值估算菌液浓度的方法,在实际检验中发现,采用这两种方法估算的菌液浓度往往与攻毒菌液的实际浓度偏差较大,需要检验工作的重复,造成人力、财力的浪费。本试验拟采用将菌液分装后置-80℃冻存的方法对菌液进行预数,并比较了菌液3种不同处理方法对实际计数结果的影响。
1 材料与方法
1.1 材料
1.1.1 菌株 兔多杀性巴氏杆菌 C51-17株,由中国兽医微生物菌种保藏管理中心提供。
1.1.2 培养基 马丁肉汤、改良马丁琼脂,购自北京中海动物保健科技公司。
1.1.3 试剂 裂解血细胞全血,由中国兽医药品监察所提供。新生牛血清,购自美国Hyclone实验室公司。
1.1.4 实验动物 兔多杀性巴氏杆菌病阴性的健康家兔,2月龄,1.5 kg左右,三批,购自北京维通利华实验动物技术有限公司。
1.1.5 主要仪器设备 GNP-9270型隔水式恒温培养箱购自上海精宏实验设备有限公司。THZ-C型恒温振荡器购自太仓市实验设备厂。Herasafe KS生物安全柜购自德国Heraeus公司。酶标仪购自美国BIO-RAD公司。低温冰箱购自日本日立公司。
1.2 方法 本试验将C51-17菌液分别采用置4℃保存过夜计算菌存率、测定菌液吸光值及置-80℃冻存三种处理方法估算菌液浓度,并将上述三种方法获得的菌液浓度估值与实值分别通过t检验进行统计分析,以确定菌液浓度估值与实值最为接近的方法,此方法视为攻毒菌液最佳处理方法。对采用此方法处理过的菌液的稳定性及毒力进行了测定,并将此方法应用于疫苗效力检验,具体试验方法如下:
1.2.1 攻毒菌液最佳处理方法的筛选 按处理方法的不同,试验分A、B、C 3组,每组试验重复5次。
A组采用4℃过夜保存法,对C51-17菌液进行活菌计数后将其放置4℃保存过夜,然后再对其进行一次活菌计数,与第一次计数结果比较,计算出菌液放置4℃过夜后的菌存率,此过程为预数过程。按照与第一次培养菌液相同的培养条件再次培养C51-17菌液,对其进行活菌计数后将其放置4℃保存过夜,根据菌数结果及预数计算的菌存率估算出菌液浓度,同时对菌液进行活菌计数,计算出菌液浓度实值。
B组采用测定菌液吸光值法,用相同的培养条件培养5份C51-17菌液,对其分别进行活菌计数,同时分别测定OD450nm值,此过程为预数过程。按照与第一次培养菌液相同的培养条件再次培养C51-17菌液,测定其OD450nm值,根据预数菌液OD450nm值对应的菌液浓度,估算出此菌液浓度,同时对菌液进行活菌计数,计算出菌液浓度实值。
C组采用-80℃分装冻存法,将C51-17菌液分装置2支试管中,每支装量3 mL,同时放置-80℃冻存。取出1支室温融化后进行活菌计数,此过程为预数过程。至少间隔1 d,将第2支试管取出,室温融化,预数的菌液浓度即为此菌液浓度的估值,对其进行活菌计数,计算出菌液浓度实值。
采用t检验分析不同处理方法获得的菌液浓度估值与其实值间是否存在显著差异。首先根据检验数据求出平均值¯x及样本标准偏差s,将有关数据代入计算公式中计算t值。其次,根据选定的显著性水准α=0.05及df值,由t分布表查得t临界值。最后,将计算得到的t值与查表得到的t临界值比较,如果前者小于后者,则认为二者之间无显著性差异[3]。t值计算公式:

式中:x1—第一次检验测量数据的平均值;x2—第二次检验测量数据的平均值;s1— 第一次检验测量数据的标准偏差;s2—第二次检验测量数据的标准偏差;n1—第一次检验测量的测量次数;n2—第二次检验测量的测量次数。1.2.2 攻毒菌液最佳处理方法的检定 方法处理过的菌液的稳定性试验:将C51-17菌液分装置5支试管中,每支装量3 mL,置-80℃冻存。于冻存后1、5、15、25、35 d 分别各取出1 支,室温融化后进行活菌计数。
采用稳健统计方法,测定Z比分值,用于分析菌液置-80℃保存不同时间后浓度变化程度。Z比分值采用X、XM、Norm IQR来确定。Z比分值计算公式:Z=(X-XM)/Norm IQR,式中:Z为稳健比分值;X为检验数据;XM为中位值;Norm IQR为标准化四分位距,Norm IQR=0.7413×四分位间距(IQR)。
判定标准为:︱Z︱≤2表示菌液浓度变化不显著;2<︱Z︱<3时,表示结果可疑;︱Z︱≥3表示菌液浓度变化显著。
方法处理过的菌液的毒力测定:将置-80℃冻存过的 C51 -17 菌液稀释为1、2、3、4、5、6、7、8、9、10、11、12 CFU/mL共12个剂量组,每个剂量组颈部皮下注射家兔2只,每只注射1 mL,注射后观察10 d。
方法应用于疫苗效力检验进行MLD测定:用C51-17菌株制备三批氢氧化铝胶灭活疫苗,每批用兔4只,每只皮下注射疫苗1.0 mL,21 d后与对照兔4只,各皮下注射 C51-17株1MLD,观察10 d。三批疫苗效力检验使用不同批次家兔进行,每次攻毒前均需重新测定C51-17株对此批家兔的MLD。采用菌液分装置-80℃冻存法测定MLD。
2 结果
2.1 攻毒菌液最佳处理方法筛选试验结果 3种处理方法获得菌液浓度估值及实值计算方法见表1。
按照与表1相同的方法,每组试验均重复5次,结果见表2。

表1 3种处理方法第一次试验获得菌液浓度估值及实值结果

表2 三种处理方法获得菌液浓度估值与实值结果及统计分析
菌液3种处理方法的自由度f均为n1+n2-2=8,经查 t值表,临界值均为 t0.05(8)=2.306 。采用将菌液分装置-80℃冻存法测定的t值为2.130,小于临界值2.306,这表明在α=0.05显著性水平时,菌液浓度估值与实值差异不显著。采用将菌液置4℃保存过夜法和测定菌液吸光值法测定的t值分别为2.437和2.357,均大于临界值,这表明在α=0.05显著性水平时,两种方法获得的菌液浓度估值与其实值间差异显著。仅将此两种方法相比较,采用测定菌液吸光值法测定的t值较将菌液置4℃保存过夜法与临界值更为接近,表明采用测定菌液吸光值法较将菌液置4℃保存过夜法更为准确。
2.2 攻毒菌液最佳处理方法检定试验结果
2.2.1 冻存菌液稳定性试验结果 菌液冻存时间及活菌计数结果见表3,稳健统计参数见表4。

表3 菌液冻存时间及活菌计数结果
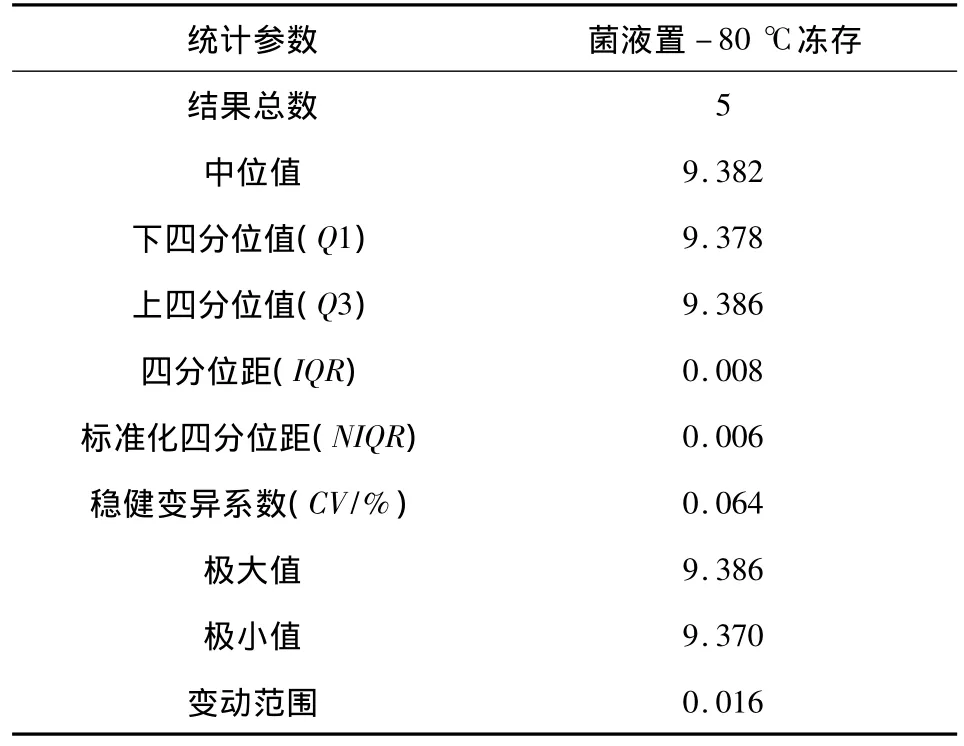
表4 冻存菌液浓度稳健统计参数
结果显示,将菌液等量分装置-80℃冻存1、5、15、25、35 d 菌液浓度检验结果︱Z︱均≤2,说明菌液冻存35 d内浓度变化不显著。
2.2.2 冻存菌液毒力测定结果 12个剂量组注射兔在10个观察日内死亡情况见表5,可见,攻毒菌液采用-80℃冻存的方法处理对菌液毒力没有影响,皮下注射3 CFU可致家兔2/2死亡。

表5 冻存菌液毒力测定结果
2.2.3 冻存方法应用于疫苗效力进行MLD测定检验结果 3批疫苗效力检验结果见表6,结果表明,采用将攻毒菌液置-80℃冻存的方法进行疫苗的效力检验,能确保对照成立,说明在兔多杀性巴氏杆菌病灭活疫苗效力检验中可以采用-80℃冻存的方法进行攻毒菌液的预数。

表6 疫苗效力检验结果
3 讨论
从采用菌液分装置-80℃冻存法与将菌液置4℃保存过夜法及测定菌液吸光值法对菌液浓度的估值与其实际浓度的偏差来看,采用菌液分装置-80℃冻存法估算的菌液浓度与菌液实际浓度最为接近,从而保证用这种方法进行疫苗效力检验时,攻击菌液的剂量与1MLD更为一致,检验结果更能反映疫苗质量。兔多杀性巴氏杆菌病灭活疫苗效力检验周期一般为31 d,本试验结果表明菌液在不添加任何保护剂的情况下置-80℃保存35 d,菌数变化范围不超过5%。
为了确保试验的准确性,本研究对每组试验进行了5个重复。理想状态下,菌液浓度估值与实值完全一致,二者之差为0,本研究以此理论值作为标准,采用t检验分析不同处理方法获得的菌液浓度估值与实值之差和理论值0之间是否存在显著差异。t检验是数理统计中一种检验平均值的检验方法,可用于检查分析方法或操作过程是否存在较大的系统误差。而在冻存菌液稳定性试验中,菌液浓度没有一个标准值,故本研究采用稳健统计方法,通过测定Z比分值分析不同冻存时间获得菌液浓度的离散程度,Z值越低说明不同冻存时间获得的菌液浓度越接近。
杜立业等[4]将酒酒球菌加入保护剂稀释的菌体放入液氮冷冻保存6个月后,菌株存活率仍可达到99%以上。由于许多从事细菌类疫苗检验的实验室不具备液氮,因此本试验尝试将菌液放置-80℃低温冰箱保存,结果表明在检验周期内菌液浓度变化不大,可以满足疫苗效力检验需要。而且,本试验没有在菌液中添加任何保护剂,避免保护剂中的某些成分会对菌液毒力产生影响,或刺激动物出现某种异常反应。
从菌液冻存后毒力测定结果来看,冻存对菌液毒力无影响,采用菌液分装置-80℃冻存法进行兔多杀性巴氏杆菌病灭活疫苗效力检验,可以保证对照组兔全部死亡,检验成立。此方法较传统的将菌液置4℃保存过夜法及测定菌液吸光值法大大减少了工作量,且攻击剂量更准确。王丽婵等[5]将制备的百日咳攻击菌于液氮中保存,4年中毒力无明显变化,稳定性良好。有液氮保存条件的实验室可以尝试将菌液放置液氮中长期保存,每次测毒及攻毒前取出一支融化,稀释后进行攻击,如果这种做法对菌株毒力没有影响,不仅可以进一步简化检验操作,而且可以提升检验的准确性。在今后工作中将继续摸索和探讨能促使检验工作高效准确的检验方法。
[1] 吕惠序,董钦正.兔巴氏杆菌病的防治[J].农业科技通讯,1981,10:35.
[2] 兰小兵,余长贵.兔巴氏杆菌病的综合防治研究[C].重庆:第七届重庆市饲料工业发展战略研讨会暨第八届饲料工业协会会员大会论文集,2010.
[3] 鲁秀恒,孔宪忱.如何应有t检验正确评价粮油分析检验结果[J].粮油仓储科技通讯,1995,(1):37 -40.
[4] 杜立业,王 华,金 刚,等.酒酒球菌液氮超低温保存[J].微生物学报,2011,51(9):129 -135.
[5] 王丽婵,卫 辰,张路民,等.百日咳攻击菌液氮保存毒力稳定性的动态监测[J].中国生物制品学杂志,2012,25(7):118-119.
