EMR和ESD在胃黏膜下肿瘤中的应用研究
2021-03-17石大伟
陈 杰,石大伟
(河南省直第三人民医院消化科,河南 郑州 450006)
胃黏膜下肿瘤是指源于胃黏膜层以下各类型肿瘤的总称,其以良性居多,且多数无明显临床表现。该病多是在行普通消化内镜中意外发现,内镜下往往可见表面光滑的隆起,病变位于胃黏膜下,对于标本的采取有一定的困难[1]。部分胃黏膜下肿瘤如为胃肠间质瘤,有恶性病变的潜在威胁,并且其危险度与肿瘤大小有相关性[2];胃黏膜下肿瘤如为平滑肌瘤,其性质虽为良性,但随着肿瘤体积的增大,其会对邻近器官形成压迫,从而引发多种临床表现。因此,临床建议应早期切除胃黏膜下肿物并送病理活检[3-5]。传统的外科手术治疗创伤范围较大,对消化道的破坏范围及程度较大,且住院时间较长,术后胃肠功能恢复较慢,治疗费用较高,对患者经济状况、生活质量都带来了极大压力。目前,内镜下黏膜切除术(EMR)和内镜黏膜下剥离术(ESD)的临床应用范围较广泛,但对于哪种术式能使患者更加受益,尚无明确定论。本研究探讨了EMR和ESD术式的疗效及安全性。
1 资料与方法
1.1一般资料 选取2017年1月至2018年6月该院消化科门诊诊断为胃黏膜下肿瘤患者120例作为观察对象,根据内镜术式不同分为EMR组和ESD组,每组60例。纳入标准:(1)经内镜下可见胃黏膜隆起性病变,诊断为胃黏膜下肿瘤;(2)本次就诊前未行手术治疗。排除标准:(1)有ESD手术禁忌证;(2)合并其他严重性病变;(3)病例资料不完整或缺失。EMR组中男36例,女24例;年龄32~75岁,平均(48.33±6.52)岁;病灶直径(1.85±0.94)cm。ESD组中男38例,女21例;年龄30~72岁,平均(46.27±5.91)岁;病灶直径(1.80±1.08)cm。2组一般资料比较,差异无统计学意义(P>0.05)。
1.2方法
1.2.1治疗方法 2组均完善术前准备:行消化内镜检查,再次明确诊断,并确认病灶位置、形态、范围等,完善术前相关检查包括血常规、凝血、生化等指标及心电图、胸片等常规检查,告知患者治疗目的及可能出现的风险和并发症,并签署知情同意书,术前禁食、禁水10 h。(1)EMR组行EMR,评估患者基本情况后,经静脉给药实行全身麻醉,并放置面罩给氧,操作全过程密切监测患者生命体征,对各种突发状况及时、有效地进行处理。①标记病变部位:内镜经消化道进入胃腔,确定病变部位、范围、大体观,采集图像,在病灶周围电凝逐点标记,手法及力度要适宜,避免引发穿孔、出血。②区分病变组织:沿标记点进行黏膜下注射,选用亚甲蓝、生理盐水等混合液,使肿物周围处隆起,便于同正常组织区别。③切除病变部位:在内镜下运用电凝或电切一次性或多次交替切除病变组织。创面出血较严重者,可予以电凝止血处理,或使用肽夹封闭。④固定标本:固定组织标本,及时送检做病理检测。(2)ESD组行ESD,操作步骤中标记病变部位、区别病变组织的方法同上,待肿物周围处隆起后切开病灶周围黏膜,黏膜下剥离和黏膜下注射交替进行,最后完整剥离。最后,进行创面处理、固定标本并送检。术后将2组患者送入病区,平卧,禁食,并予以补液、营养支持、抑酸保护胃黏膜、预防感染等治疗。密切观察患者生命体征及排便、排气情况,注意观察有无黑便、腹痛等并发症,并积极处理。
1.2.2观察指标 观察2组手术相关指标(包括手术时间、术中出血量及住院时间)、黏膜下肿物整块切除率、完全切除率和并发症发生情况,以及术后3个月内原发切除部位及周围1~2 cm肿物残留情况。术前及术后1 d采用双抗体免疫法检测2组血清去甲肾上腺素(NE)、皮质醇(COR)水平,比较2组应激反应情况。
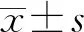
2 结 果
2.12组手术相关指标比较 EMR组手术时间低于ESD组,术中出血量多于ESD组,住院时间长于ESD组,差异有统计学意义(P<0.05)。见表1。

表1 2组手术相关指标比较
2.22组黏膜下肿物整块切除率、完全切除率及肿物残留率比较 EMR组整块切除率、完全切除率低于ESD组,差异有统计学意义(P<0.05)。EMR组肿物残留率高于ESD组,差异无统计学意义(P>0.05)。见表2。

表2 2组黏膜下肿物整块切除率、完全切除率及肿物残留率比较[n(%)]
2.32组并发症发生情况比较 EMR组并发症总发生率高于ESD组,差异有统计学意义(P<0.05)。见表3。

表3 2组患者并发症情况比较[n(%)]
2.42组血清NE、COR水平比较 2组术前血清NE、COR水平比较,差异均无统计学(P>0.05)。2组术后血清NE、COR水平比较,差异有统计学意义(P<0.05)。见表4。

表4 2组患者血清NE、COR水平
3 讨 论
胃黏膜下肿瘤是指源于胃黏膜层以下的隆起性病理改变,以良性为多数出现,病理分型主要有胃肠道间质瘤、平滑肌瘤、脂肪瘤等类型[6]。大部分胃黏膜下肿瘤患者并无明显的特异性临床表现,往往是行消化内镜检查、CT检查、上消化道造影时偶然发现,其中消化内镜能够发现胃黏膜下肿物的位置、形态、体积、是否伴有糜烂、是否充血水肿及分泌物覆盖等情况,但由于该病变在肉眼下观察均呈现光滑隆起,对于肿物的诊疗还需借助病理检测及与其他技术手段相互配合[7]。近年来,EMR和ESD在临床上广泛应用于消化系统疾病,如胃癌前病变、早期胃癌等[8-9]。
病灶部位是否能够得到整体切除是镜下治疗的关键,完全、彻底地切除能够有效降低肿瘤复发率。此外,整块切除能够保证送检标本的完整性,有利于病理学正确评估。本研究结果显示,ESD组黏膜下肿物整块切除率、完全切除率均高于EMR组,肿物残留率低于EMR组。考虑主要与2种术式操作方法有所区别相关。EMR主要通过镜下切除部分胃黏膜,切除深度可至黏膜下组织,以达到切除病灶的效果。但EMR对直径超过2 cm病变组织的整块切除率相对较低,容易出现病灶残留,不利于预后[10]。ESD是近年来在EMR基础上逐步发展的一种内镜技术手段[11],可精准、直观地将病灶完整剥离,具备微创、安全、有效的优势特色,在临床上广泛应用,如在消化道癌前病变及早期癌阶段。该技术借助消化内镜切除病灶范围,在标本摄取方面更加完整且对胃黏膜损害性小,有助于病理检测的精准性,且病灶清除率较高,能够降低肿物残留率及复发率[12],有较好的短期和长期疗效。本研究结果显示,ESD组手术时间高于EMR组,术中出血量少于EMR组,住院时间短于EMR组,差异均有统计学意义(P<0.05)。通过镜下注射药物使病灶隆起后,EMR可一次或多次将病灶切除。然而ESD需要在剥离过程中继续注射药物刺激病灶隆起,操作更复杂,耗时更长,但创伤更小,患者恢复较快。出血和穿孔是镜下操作的常见并发症,本研究中2种术式出现了出血、穿孔并发症,且EMR组并发症总发生率高于ESD组。本研究结果还显示,2组术后血清NE、COR水平比较,差异有统计学意义(P<0.05)。分析其原因:2种微创术式在术中对胃黏膜有不同程度的刺激,从而对机体产生不同程度创伤,产生应激反应。但ESD整块切除率较高,减少术中分次操作频率,且手术时间短、出血量较少,从而降低应激反应水平。
综上所述,ESD治疗胃黏膜下肿瘤的疗效及安全性可能优于EMR,但仍需进一步扩大样本、长期追踪随访加以论证。但是,ESD操作难度更大,需要改良已有技术,发展新型技术,提高医师操作技能,强化科室间的协作运行能力,从而进一步提高其疗效及安全性。