DHA脂质体对脂代谢的改善作用
2021-03-02杨瑞利卢娜张慧周赛楠张青薛长湖唐庆娟
杨瑞利,卢娜,张慧,周赛楠,张青,薛长湖,2,唐庆娟
(1.中国海洋大学食品科学与工程学院,山东青岛 266003)
(2.海洋国家实验室海洋药物与生物制品功能实验室,山东青岛 266237)
脂质代谢紊乱已被认为是严重疾病的标志[1]。脂代谢紊乱与肥胖,非酒精性脂肪肝(non-alcoholic fatty liver disease,NAFLD),糖尿病,动脉粥样硬化密切相关[2]。NAFLD的特征是肝内脂肪细胞过度沉积[3],现已成为世界上最常见的慢性肝病,占全球总人口的1/4[4]。近年来,随着人们生活水平的提高,其膳食结构逐渐从以植物性食物为主的饮食转变为以动物性食物为主的高热量高脂肪含量饮食[5]。由于饮食结构的改变,NAFLD的发病率逐渐提高,对人类健康造成了极大的危险[6]。因此改善脂代谢紊乱和肝细胞脂质沉积对预防和治疗NAFLD至关重要。
二十二碳六烯酸(Docosahexaenoic acid,DHA)属于N-3多不饱和脂肪酸家族中的重要成员,广泛存在在鱼、虾、蟹、海藻等海洋生物中,深海鱼油中的DHA尤为丰富。DHA主要有甲酯、乙酯(Ethyl ester,EE)、甘油三酯(Triglyceride,TG)、磷脂等四种类型,目前市售的DHA主要是乙酯型和甘油三酯型[7]。TG-DHA无论是对人体代谢吸收率,生物利用率还是安全性都明显优于EE-DHA[8]。很多文献都曾报道富含DHA的深海鱼油具有降脂减肥,调节脂代谢紊乱,抗炎,抗癌等生物活性[9]。Kembra[10]等人的研究表明DHA可以通过调控高脂饮食小鼠脂肪酸合成基因及脂肪酸氧化分解相关基因的表达调节脂质代谢。LIU[11]等人发现DHA可以在一定程度上改善长期高脂饮食导致的非酒精性脂肪肝。但鱼油属于脂溶性物质,难以在实验动物体内直接消化吸收。有文献报道,经乳化后的鱼油比天然更易吸收,且能显著增加血浆中的DHA含量[12]。但乳化后的鱼油仍然有令人难以接受的腥味物质,这在很大程度上限制了鱼油产品的开发利用[13]。目前市面上大多是DHA微胶囊,所用壁材一般为蛋白质和明胶,包埋率仅为10%左右,溶于水后仍然有鱼腥味[14]。很多文献都曾报道,脂质体可以掩盖鱼油腥味,且消化吸收特性,抗氧化性能等更佳[15-17]。Xiaodan[18]等人的研究表明DHA脂质体可以通过上调CPT-1的mRNA表达和蛋白表达;下调FAS的mRNA表达和蛋白表达来降低HepG2细胞甘油三酯沉积。Mengru[19]等人的研究发现,DHA脂质体可以通过肝脏脂解和胆固醇外排抑制非酒精性脂肪肝大鼠肝脏脂质沉积。目前大多数的研究主要集中在DHA脂质体的制备,对其生物活性的探究相对较少,尤其是在动物实验水平上研究DHA脂质体对脂代谢调控的报道更是少之又少。大大影响了鱼油精深产品的开发利用。
本实验主要通过体外细胞实验和动物实验,以DHA脂乳剂作对照,综合探究DHA脂质体对脂代谢的调节作用,为深海鱼油高附加值产品的开发应用提供理论依据。
1 材料与方法
1.1 原料与试剂
10/70 TG-DHA金枪鱼油,浙江舟山新诺佳生物技术有限公司;98%大豆磷脂酰胆碱(98% PC),西安艾诺医药科技有限公司;人肝癌HepG2细胞,上海生工生物工程有限公司;SPF级6周龄雄性C57BL/6J小鼠,济南朋悦实验动物繁育有限公司(许可证号:SPXY2019042001);甘油三酯(Triglyceride,TG)、总胆固醇(Total Cholesterol,TC)试剂盒,中生北控生物科技股份有限公司;脂肪酸合成酶(FAS)、苹果酸酶(ME)、肉碱棕榈酰转移酶(CPT-1)、脂蛋白酯酶(LPL)ELISA试剂盒,武汉优尔生商贸有限公司;猪胆盐,索莱宝生物科技有限公司;油酸(OA)、棕榈酸(PA),美国Sigma公司;TRIZOL试剂,美国Invitrogen公司;RNA纯化试剂盒,天根生化科技有限公司;5X All-In-One RT裂解反转录一体试剂盒,abm;EvaGreen Express 2X qPCR MasterMix,abm;10%低脂饲料(饲料代码TP23522)、45%高脂饲料(饲料代码TP23220),南通特洛菲饲料科技有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
RE-2000A旋转蒸发仪,上海亚荣生化仪器厂;Model680型酶标仪,美国BioRAD产品;Agilent7820型气相色谱仪,美国Agilent科技公司;19091N-113型HP-INNOWAX石英毛细管柱,美国Agilent科技公司;TGL-16G型台式离心机,上海安亭科学仪器厂;IQ5 Realtime PCR仪,美国Bio-RAD;NIKON/Ni-E电子荧光显微镜,南京伊若达仪器设备有限公司。
1.3 方法
1.3.1 DHA脂质体及DHA脂乳剂的制备
将一定比例的10/70 TG-DHA金枪鱼油和98%大豆磷脂酰胆碱溶解于95%食用酒精中,将其放置在磁力搅拌器上直至大豆磷脂酰胆碱完全溶解。然后在40 ℃,100 r/min条件下旋转蒸发、减压浓酸除有机试剂。室温冷却30 min,加超纯水洗膜,最后过200 nm聚碳酸酯膜,得到的白色乳状液体即为DHA脂质体乳状液。
向适量10/70 TG-DHA金枪鱼油中加入超纯水,之后加入0.5%猪胆盐作为乳化剂,然后不断振荡混匀,超声细胞破碎仪均质2 min,制成均一的牛奶状乳液,即为DHA脂乳剂[20]。
1.3.2 脂肪酸组分检测
前处理(甲酯化):分别取5 mg脂质体/脂乳剂样品和500 μg十九碳酸甘油三酯标准品置于甲酯化试管中,用氮气吹干试管中的有机试剂。向试管中加入2 mL HCl:甲醇(1:5V/V)溶液,充入氮气立即拧紧管口,然后将试管置于90 ℃金属浴中加热1 h。将其冷却至室温,向其中加入2 mL正己烷,充分混匀,室温静止直至液体分层。取上层溶液1 μL进行气相色谱分析[21]。
GC分析:载气为为高纯氮气,进样口采用分流模式(20:1)所用柱子为Supelcowax石英毛细管柱(30 m×0.25 mm,0.25 μm)。柱箱初温170 ℃,以5 ℃/min的速度升温至240 ℃,平衡时间为1 min。检测器为火焰离子化检测器(flame ionization detector,FID),进样口温度为260 ℃,检测器温度为260 ℃,氢气流量30 mL/min,空气流量400 mL/min,氮气尾吹流量:25 mL/min[22]。
GC数据分析:根据脂肪酸甲酯混标的出峰时间定性分析样品中脂肪酸组分。采用面积归一法,定量计算样品脂肪酸组分百分比。
1.3.3 细胞培养及分组
本实验选用人肝癌HepG2细胞,培养基选用含10%胎牛血清的高糖DMEM培养基,在含5% CO2,湿度为100%的37 ℃恒温培养箱中正常培养。当12孔板细胞密度长满70%~80%时,将其分为四组:空白对照组:DMEM培养基培养,模型组:含有1 mmol/L游离脂肪酸(油酸(OA):棕榈酸(PA)=2:1)混合物的DMEM培养基培养24 h,然后转移至正常DMEM培养基培养48 h[23];DHA脂乳剂组:含有1 mmol/L游离脂肪酸混合物的DMEM培养基培养24 h后,使用浓度为40 μg/mL的DHA脂乳剂干预48 h;DHA脂质体组:含有1 mmol/L游离脂肪酸混合物的DMEM培养基培养24 h后,使用浓度为40 μg/mL的DHA脂质体干预48 h。
1.3.4 油红O染色观察肝细胞脂质蓄积情况
等到各组细胞消化后,收集细胞。4%多聚甲醛固定液固定20 min,PBS请2次,双蒸水漂洗3次后空气晒干;待切片干燥后,将切片置于油红工作液中染色1 h;70%乙醇漂洗3次;在光学显微镜下观察油红染色后的阳性细胞。
1.3.5 HepG2细胞TG、TC含量测定
等到各组细胞消化后,收集细胞。试剂盒法检其TG、TC含量,具体方法按照试剂盒说明书进行操作。
1.3.6 Real-Time PCR检测脂代谢相关基因的mRNA表达量
等各组细胞消化后,收集各组细胞。Trizol法提取细胞中的总RNA,琼脂糖凝胶检测RNA完整性。通过测定溶液吸光值A260 nm/A280 nm比值确定所得RNA的纯度,比值1.8~2.0时用于下一步实验。按照5X All-In-One RT裂解反转录一体试剂盒进行反转录,将RNA反转成cDNA,具体方法按照试剂盒说明书进行操作。按照EvaGreen Express 2X qPCR MasterMix试剂盒说明书在冰上配置20 μL反应体系,该体系包括2×MasterMix 10 μL,PCR Forward、Reverse Primer各0.6 μL,cDNA溶液4 μL,无菌水4.8 mL。设置3个复孔,使用IQ5型荧光定量PCR仪进行测定,扩增条件:95 ℃,10 min;95 ℃,15 s,60 ℃,20 s,95 ℃,15 s(45个循环);65 ℃升温至95 ℃(0.5 ℃/10 s),内参基因为GAPDH,mRNA相对表达量用2-ΔΔCT法计算[24]。引物由上海生工生物工程有限公司合成;引物序列见表1。
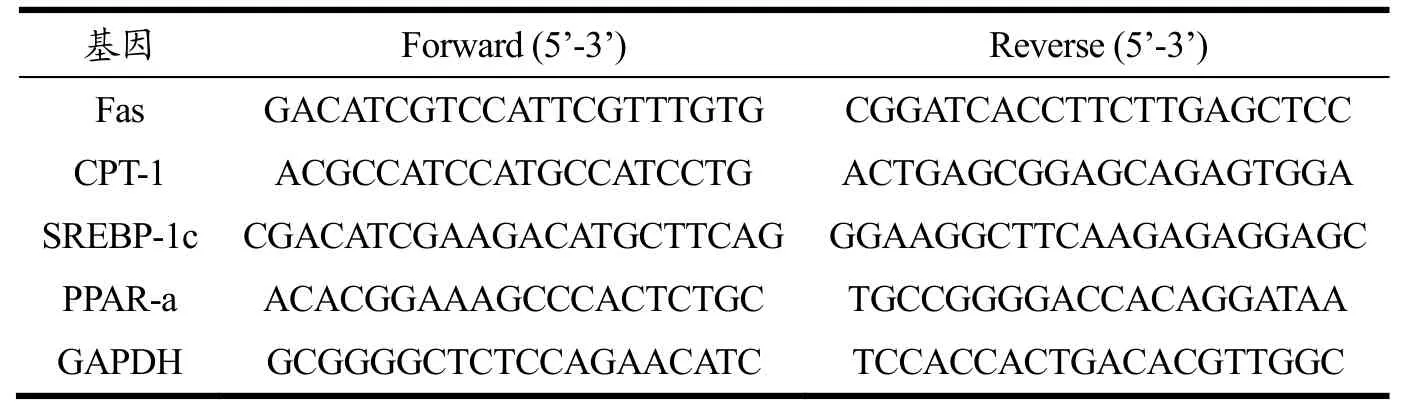
表1 引物序列Table 1 Primer sequence
1.3.7 动物饲养与分组
30只SPF级的雄性C57BL/6J小鼠暂养一周后,按体重随机分为四组,对照(C)组,模型(M)组,DHA脂乳剂(O-DHA)组,DHA脂质体(L-DHA)组,除C组喂养10%低脂饲料,其他组均喂养45%高脂饲料。4周后开始灌胃,O-DHA组灌胃DHA脂乳剂,L-DHA组灌胃DHA脂质体,C组和M组均灌胃生理盐水作对照,灌胃剂量1000 mg/(kg·bw)。饲养环境为普通环境,单笼单只,室温23±2 ℃,湿度55%~58%,12 h/12 h光暗循环,饲养期间所有动物均自由摄食和饮水。12周后,摘眼球取血脱颈椎处死小鼠,取小鼠肝脏、脂肪等组织称重并于-80 ℃冰箱保存。
1.3.8 小鼠生长指标测定

1.3.9 免疫组化测定蛋白表达量
取上述脂肪组织切片,全自动脱水浸蜡处理,将浸好蜡块的组织于包埋机内进行包埋,将修整好的蜡块用石蜡切片机切成厚4 μm的切片。石蜡切片脱蜡至水,置于盛满柠檬酸抗原修复缓冲液(pH 6.0)的修复盒中于微波炉内进行抗原修复。血清封闭,加入一抗,二抗,DAB显色,复染细胞核,梯度酒精脱水,二甲苯透明,封片,电子荧光显微镜下观察。
蛋白表达量的测定使用Image-Pro Plus 6.0软件选取蛋白阳性染色区域,计算面密度:面密度=IOD/待测区域组织面积(IPP)。
1.3.10 肝脏脂代谢相关酶活力测定
取各组小鼠肝脏溶于生理盐水中,匀浆、离心取上清液。试剂盒法检测各组小鼠脂肪合成酶(FAS)、苹果酸梅(ME)、脂蛋白酯酶(LPL)、肉碱棕榈酰转移酶(CPT-1)等肝脏脂代谢相关酶活力,具体步骤按照试剂盒说明书进行操作。
1.4 统计分析
所有实验均重复3次以上,结果以¯x±SD表示;所有实验数据均用SPSS 25.0软件进行统计分析,组间差异采用单因素方差分析(One-Way ANOVA),以p<0.05表示差异有统计学意义。
2 结果与讨论
2.1 DHA脂质体和DHA脂乳剂中脂肪组分检测
由表2可以看出,与DHA脂乳剂相比,DHA脂质体中的C16:0、C17:0、C18:0、C18:1、C18 2n-6等显著增多(p<0.05)。而C20 4n-6,EPA,C23:0,C24:0,DHA等显著减少(p<0.05)。但两种鱼油的总饱和脂肪酸与总不饱和脂肪酸并无显著性差异(p>0.05)。气相色谱法检测到TG-DHA脂乳剂中的DHA含量高达76.87%,而TG-DHA脂质体中的DHA含量为73.74%,因此在灌胃时根据两种形式鱼油中的DHA含量控制了实验小鼠的灌胃剂量,保证O-DHA组与L-DHA组小鼠摄入DHA量一致。
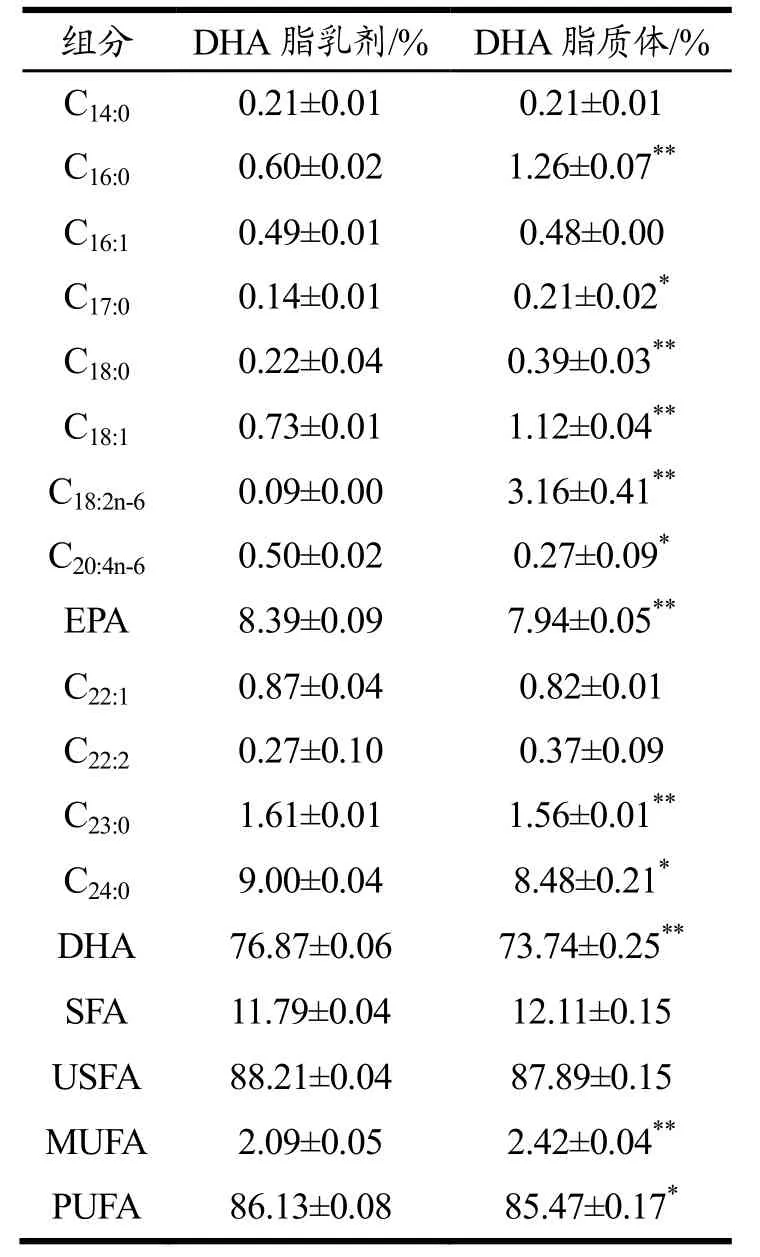
表2 两种形式DHA脂肪酸组分检测Table 2 Determination of fatty acid components in two forms of DHA
2.2 DHA脂质体对游离脂肪酸诱导的HepG2细胞脂质沉积的影响
最新研究表明,NAFLD的发生和发展是由肝细胞脂质蓄积、氧化应激、胰岛素抵抗等多种因素造成的[25,26]。其中脂质蓄积是NAFLD形成的危险诱因[27]。Lu[28]等人的研究表明,DHA-PC可显著降低游离脂肪酸可诱导HepG2细胞TG、TC含量的升高,降低HepG2细胞脂质沉积。由图1a/b可见,与空白(C)组相比,模型(M)组细胞内脂质和细胞内TC(增约4.75倍),TG(增约16.41倍)含量显著增加(p<0.05)。油红O染色是观察肝细胞脂质沉积的经典方法之一,由图1c可见,与C组相比,M组细胞内红色脂滴聚集显著增多。与M组比较,L-DHA组细胞内脂质和细胞内TC、TG含量均显著降低(p<0.05),分别降低了62.91%和48.73%。且与O-DHA组相比,L-DHA显著降低了细胞内的TC含量(降低约49.56%)(p<0.05)。相比于DHA脂乳剂,DHA脂质体改善细胞脂质沉积的作用更加显著。
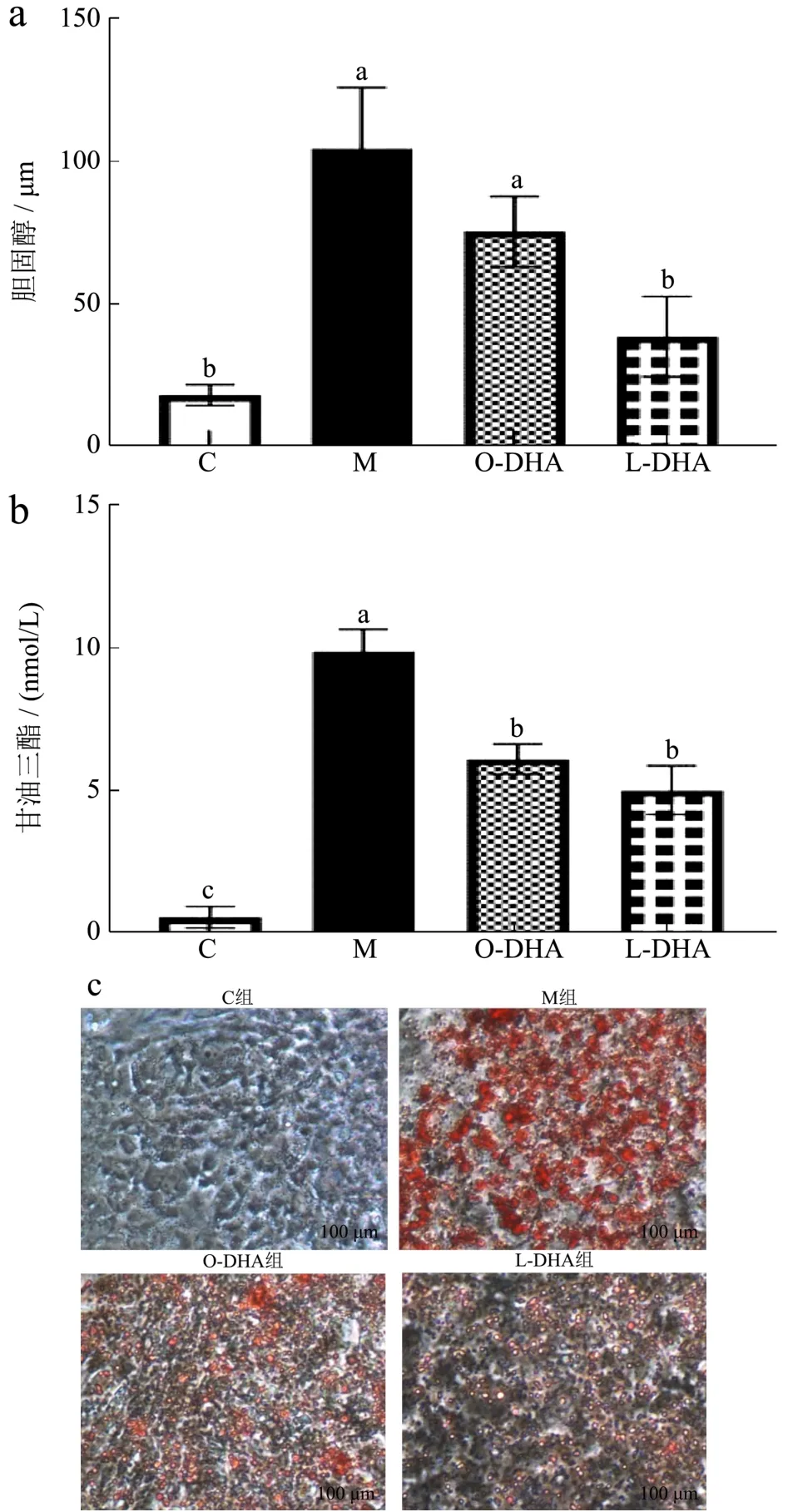
图1 DHA脂质体对HepG2细胞脂质沉积的影响Fig.1 DHA liposomes on lipid deposition in HepG2 cells
2.3 DHA脂质体对游离脂肪酸诱导的HepG2细胞脂代谢相关基因的影响
FAS是细胞内催化脂肪酸合成的关键酶,SREBP-1是脂质代谢重要的核转录因子。Kembra[29]等人发现n-3 PUFA可通过降低FAS,PPAR-α等与脂肪酸合成相关的mRNA表达改善游离脂肪酸诱导的HepG2细胞脂代谢紊乱。各组细胞中脂代谢关键基因的mRNA表达水平检测结果显示,与C组比较,M组细胞FAS(增加约7.32倍),SREBP-1(增加约13.22倍)的mRNA表达水平显著升高(p<0.05)(见2a/b)。与M组相比,L-DHA组FAS(48.62%),SREBP-1(38.53%)的mRNA相对表达量均显著降低(p<0.05)。且与O-DHA组比较,L-DHA组FAS(39.76%),SREBP-1(33.77%)的mRNA表达水平也均显著降低(p<0.05)。表明相比于DHA脂乳剂,DHA脂质体对游离脂肪酸诱导的HepG2细胞脂代谢紊乱的改善作用更加显著。

图2 DHA脂质体对HepG2细胞脂代谢相关基因的影响Fig.2 DHA liposomes on lipid metabolism related genes in HepG2 cells
2.4 DHA脂质体对高脂饮食小鼠体质量的影响
体外细胞实验表明DHA脂质体改善游离脂肪酸诱导的HepG2细胞脂质沉积的作用更加显著。长期高脂饮食会导致机体的能量摄入大于能量消耗,多余的能量会以脂肪的形式贮存在体内,最终导致脂代谢紊乱[30]。接着我们通过动物实验进一步探究DHA脂质体对脂代谢的调节作用。各组小鼠1~12周体质量如图3a所示,在第72~84 d,M组小鼠体重显著高于C组和L-DHA组。BMI作为身体质量指数,通过用来衡量机体胖瘦程度以及是否健康的一个指标[31]。如图3b所示,与C组相比,M组小鼠BMI(增约18.22%)显著升高(p<0.05),而DHA脂乳剂和DHA脂质体的摄入,显著降低了高脂饮食导致的实验小鼠BMI升高(p<0.05),分别降低约11.10%和10.40%。从图3a饲养期间实验小鼠体重变化来看,相比于DHA脂乳剂,DHA脂质体降低高脂饮食小鼠体质量的作用更加明显。

图3 DHA脂质体对高脂饮食小鼠体质量的影响Fig.3 DHA liposomes on body weight of high fat diet mice(n=10)
2.5 DHA脂质体对高脂饮食小鼠内脏脂肪堆积的影响
长期高脂饮食会导致脂代谢紊乱,造成体重增加,脂肪堆积[32]。由图4可见,高脂饮食饲养的M组(其中附睾脂肪增约34.43%,肾周脂肪增约68.50%小鼠的内脏脂肪含量显著高于正常组(p<0.05)。与M组相比,DHA脂乳剂和DHA脂质体的摄入均降低了高脂饮食小鼠内脏脂肪含量,其中DHA脂质体显著降低了高脂饮食小鼠附睾脂肪含量14.26%(p<0.05)。
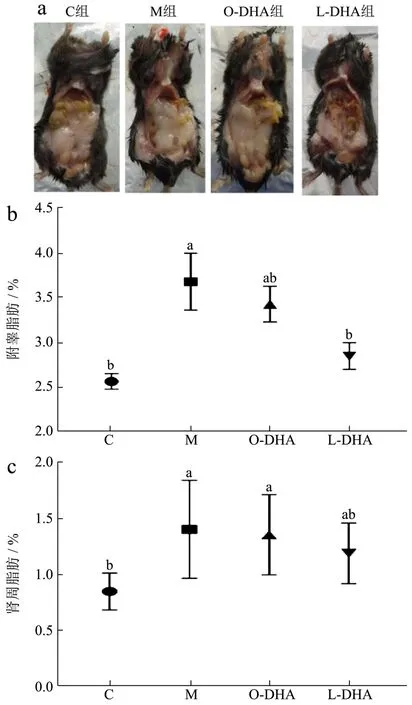
图4 DHA脂质体对高脂饮食小鼠内脏脂肪堆积的影响Fig.4 DHA liposomes on visceral fat accumulation in mice fed with high-fat diet
2.6 DHA脂质体对高脂饮食小鼠脂代谢相关蛋白的影响
前期我们检测了各组实验小鼠脂质代谢相关基因的表达,发现DHA脂质体和DHA脂乳剂均可以下调高脂饮食小鼠FAS的mRNA表达,上调CPT-1的mRNA表达。因此我们又检测了这两种酶的蛋白表达。
免疫组织化学染色法通常用来检测蛋白表达量,如图5a/b所示,与C组相比,M组小鼠FAS蛋白大量表达,增加了约87.57%。而DHA脂质体和DHA脂乳剂的摄入均显著降低了FAS的蛋白表达量(p<0.05),分别降低了74.29%和47.10%。由图5a/c可见,与C组相比,CPT-1在M组小鼠体内蛋白表达量减少(减少约35.39%)(p>0.05),而DHA脂质体的摄入显著增加了CPT-1(增加约1.7倍)蛋白表达(p<0.05)。
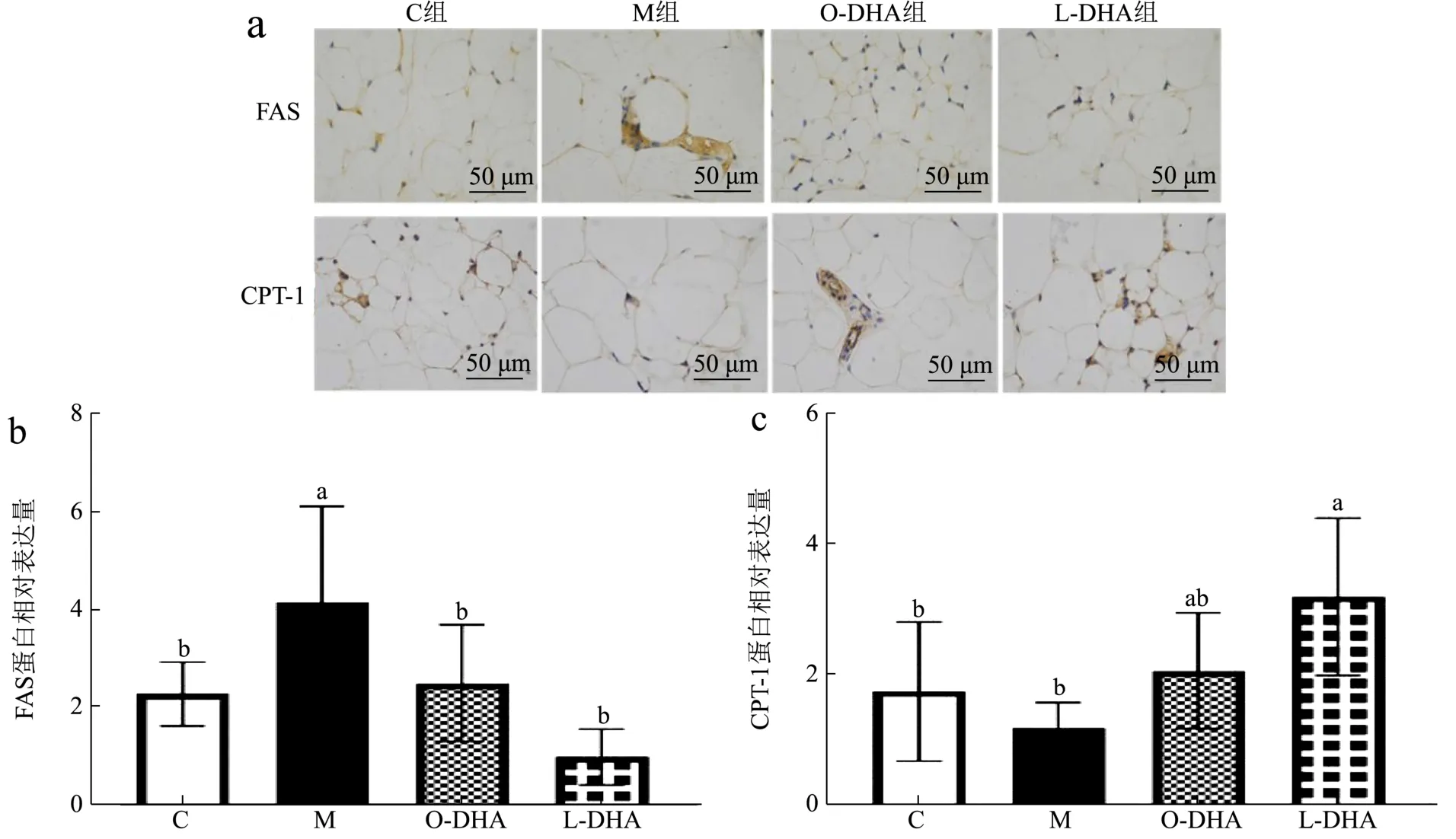
图5 DHA脂质体对高脂饮食小鼠脂代谢相关蛋白的影响Fig.5 DHA liposomes on lipid metabolism related proteins in mice fed with high-fat diet (n=10)
2.7 DHA脂质体对高脂饮食小鼠脂代谢相关酶活力的影响
肝脏是人体内脂肪合成的重要场所。脂肪酸合成酶是脂肪酸合成过程中的限速酶,苹果酸酶是催化苹果酸生成丙酮酸的酶,这两种都是促进脂肪酸合成的酶[33]。由图6a/b可见,与C组相比,M组小鼠FAS(58.50%)、ME(11.92%)酶活性显著升高(p<0.05),而DHA脂质体和DHA脂乳剂的摄入均显著降低了高脂饮食导致的FAS(DHA脂质体降低约30.33%,DHA脂乳剂降低约24.28%)、ME(DHA脂质体降低约11.79%,DHA脂乳剂降低约9.24%)酶活力的升高(p<0.05)。肉碱棕榈酰转移酶是脂肪酸β-氧化过程中的限速酶。脂蛋白酯酶是促进脂肪酸分解成甘油三酯的酶[34]。由图6c/d可见,与C组相比,高脂饮食会抑制M组实验小鼠CPT-1(2.58%)、LPL(0.43%)酶活力,而DHA脂质体和DHA脂乳剂的摄入均促进了这两种酶的活力(p<0.05)。其中DHA脂质体升高高脂饮食小鼠肝脏内CPT-1,LPL的浓度分别约10.08%,15.12%,DHA脂乳剂升高高脂饮食小鼠肝脏内CPT-1,LPL的浓度约18.95%,7.02%。Liu X,Joseph等人也发现DHA可以通过调节小鼠肝脏中脂肪酸合成和氧化分解相关酶活力,从而调节脂代谢相关基因与蛋白的表达来调节脂代谢[35,36]。本实验结果表明,DHA脂质体和DHA脂乳剂均可以通过抑制脂肪酸酸合成相关酶活力,升高脂肪酸分解和β氧化相关酶活力,改善高脂饮食诱导的脂质代谢紊乱。

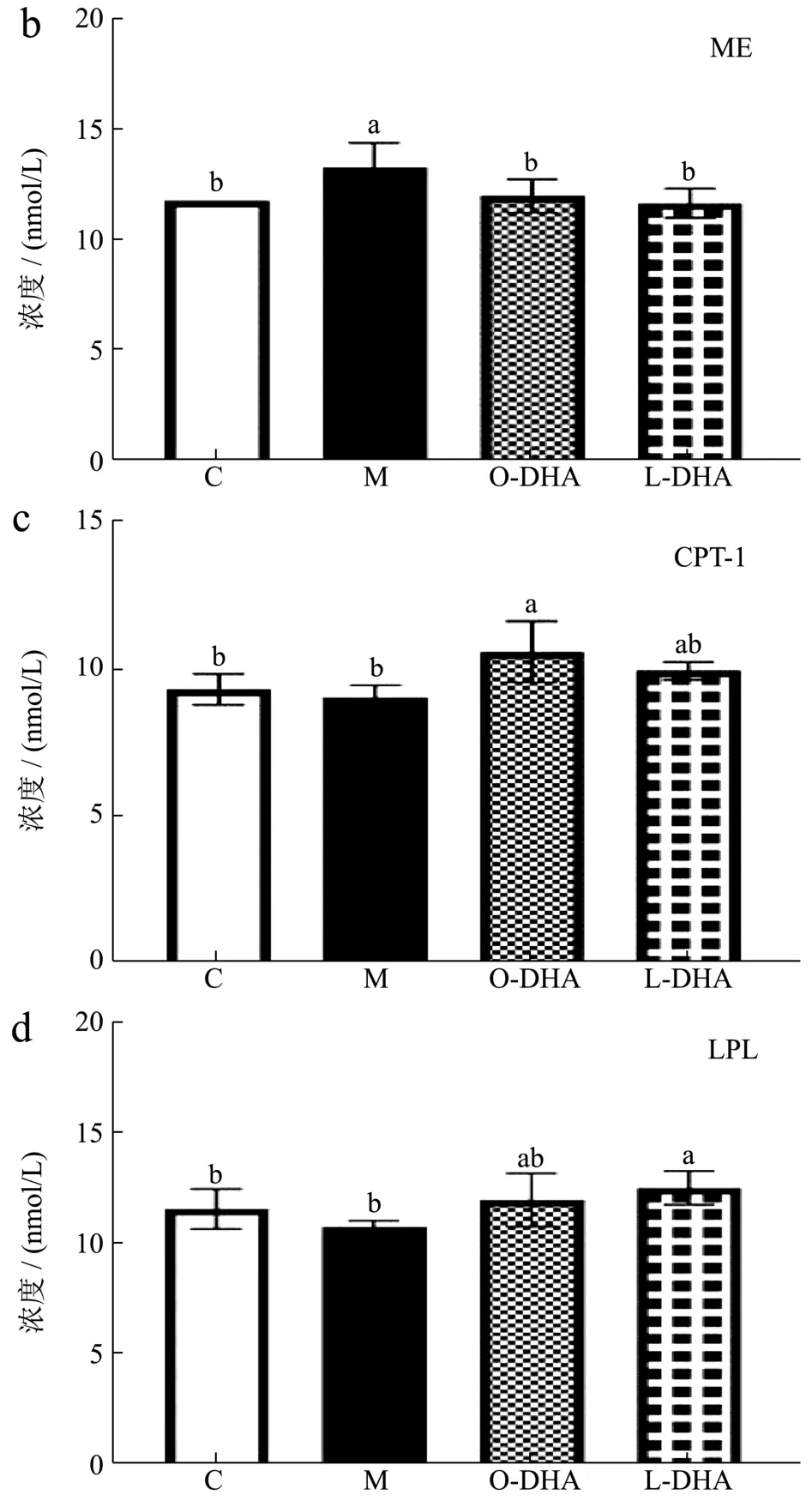
图6 DHA脂质体对高脂饮食小鼠脂代谢相关酶活性的影响Fig.6 DHA liposomes on activities of lipid metabolism related enzymes in mice fed with high-fat diet (n=10)
3 结论
本研究首先利用游离脂肪酸诱导HepG2细胞脂质沉积,观察DHA脂质体和DHA脂乳剂对HepG2细胞的改善作用。结果表明DHA脂质体和DHA脂乳剂均对游离脂肪酸诱导的HepG2细胞脂质沉积具有一定的改善作用,其中DHA脂质体的作用效果更加明显,DHA脂质体显著降低了HepG2细胞TG,TC含量以及FAS,SREBP-1的mRNA表达。其次采用高脂饲料建立高脂饮食小鼠模型,观察DHA脂质体和DHA脂乳剂对高脂饮食小鼠脂代谢紊乱的调节作用。结果发现,与细胞实验一样,DHA脂质体对高脂饮食小鼠脂代谢紊乱的调节作用更佳。DHA脂质体显著降低了高脂饮食小鼠体质量和内脏脂肪堆积。显著降低了FAS的蛋白表达,增加了CPT-1的蛋白表达,这与我们之前的基因检测结果一致。另外DHA脂质体显著抑制了高脂饮食小鼠FAS,ME等脂肪酸合成相关酶活力,显著促进了CPT-1,LPL等脂肪酸氧化分解相关酶活力。综上所述,本实验首次从体外细胞实验和体内动物实验综合探究,比较DHA脂质体和DHA脂乳剂对脂代谢紊乱的调剂作用。实验结果表明,相比于DHA脂乳剂,DHA脂质体改善脂代谢紊乱的作用更加显著。本研究有望促进鱼油精深产品的开发应用。
