慢性镉暴露对小鼠大脑皮质的毒性损伤作用
2021-02-06王莉闻双全贺双江曹莹邹辉顾建红刘学忠卞建春刘宗平袁燕
王莉,闻双全,贺双江,曹莹,邹辉,顾建红,刘学忠,卞建春,刘宗平,袁燕*
(1. 扬州大学兽医学院,江苏 扬州 225009;2. 江苏高校动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009)
镉是一种存在于环境中的重金属,与许多重金属不同,镉具有良好的水溶性,可经水体在土壤中富集并被植物吸收,通过食物链进入人和动物体内[1]。由于镉在体内能长期蓄积,不易排除,故易产生慢性和长期的病理效应,可损伤许多组织和系统,其中包括肝脏、肾脏、骨骼、睾丸、脑等[2-4]。慢性镉中毒可导致神经症状,如头痛、眩晕、嗅觉功能障碍等,引起帕金森病、阿尔兹海默症等神经退行性疾病[2,5]。此外,镉也是一种脂质过氧化诱导剂,能诱发机体产生过量的超氧化自由基,从而引起过氧化损伤。因此,其毒性与生物氧化损伤密切相关[6]。诱导自由基过量产生、导致机体氧化应激是镉主要毒性机制之一[3,7]。Almeer等[8]研究表明,小鼠经腹腔注射氯化镉6.5 mg/kg,连续处理7 d,导致镉在大脑皮质中累积,且与氧化和抗氧化失衡密切相关。为探究慢性镉暴露对小鼠大脑皮质的毒性损伤作用,本试验选取雌性BALB/c小鼠,用不同浓度氯化镉自由饮水染毒16个月的方式建立慢性镉中毒模型,测定脑系数、病理组织学、超微结构及氧化应激指标的变化,从体内探讨慢性镉暴露对小鼠大脑皮质的毒性损伤作用,为阐明镉神经毒性损伤机制提供理论依据。
1 材料与方法
1.1 实验动物
SPF级雌性BALB/c小鼠,由扬州大学比较医学中心提供。
1.2 主要试剂
总超氧化物歧化酶(T-SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-PX)、还原型谷胱甘肽(GSH)、丙二醛(MDA)检测试剂盒(南京建成生物工程研究所);BCA 蛋白定量试剂盒(南京诺唯赞生物科技有限公司) ;RIPA裂解液、蛋白酶抑制剂(新赛美生物科技有限公司);无水氯化镉(Sigma,USA);其他试剂均为国产分析纯。
1.3 动物分组与处理
36只5周龄SPF级雌性BALB/c小鼠,于室温(22±1) ℃,湿度控制在50%~60%的环境下预饲1周后随机分为3组分笼饲养,饮水中添加氯化镉的浓度分别为0(对照组)、5 和25 mg/L,持续饮用以上3种浓度的镉水16个月。试验结束后,禁食禁水12 h,腹腔注射2%戊巴比妥钠麻醉,剥离完整脑组织,分离大脑皮质备用。
1.4 脑系数测定
称量完整脑组织,计算脑系数,即脑系数(%)=脑重(g)/体重(g)×100 %。
1.5 大脑皮质病理组织学观察
取出脑组织,4%多聚甲醛固定,70%、80%、95%、100%乙醇梯度脱水,二甲苯透明,浸蜡,包埋,制作石蜡切片。乙醇洗去二甲苯,流水冲洗,苏木精染色,流水冲洗,1%盐酸酒精分化,流水冲洗,0.1%氨水返蓝,水洗至不变色,伊红复染,流水冲洗,自然干燥,中性树胶封片,光学显微镜下观察拍照。
1.6 大脑皮质超微结构的观察
冰上取1 mm×1 mm×1 mm大脑皮质组织块于2.5%戊二醛中,4 ℃固定,0.1 mol/L PBS清洗3次后1%锇酸固定,0.1 mol/L PBS清洗3次后分别用30%、50%、70%、80%、90%、95%、100%的乙醇进行梯度脱水,100%丙酮于室温下浸透12 min,树脂包埋组织块,60 ℃烘箱内放置48 h后切片,醋酸双氧铀和柠檬酸铅染色,透射电子显微镜观察其超微结构。
1.7 大脑皮质氧化应激指标测定
比色法检测大脑皮质中T-SOD、CAT、GSH-PX活性和GSH、MDA含量,按照南京建成生物工程研究所提供的试剂盒说明书进行检测。
1.8 数据统计与分析
应用SPSS 22. 0统计软件对数据进行显著性t检验和单因素方差(ANOVA)分析,数据以“平均值±标准差”表示,P<0.05表示差异显著,P<0.01 表示差异极显著。
2 结果与分析
2.1 慢性镉暴露对小鼠脑系数的影响
动物处死后,立即摘取各组小鼠完整脑组织,肉眼未见明显病理变化。称重、计算脑系数,结果如图1所示,与对照组相比,5和25 mg/L氯化镉组小鼠脑系数均显著下降(P<0.05)。

与对照组相比,*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。下同
2.2 慢性镉暴露对小鼠大脑皮质病理组织学的影响
如图2所示,对照组小鼠大脑皮层神经元形态规则,排列整齐密集,胞核大而圆,少见深染的神经元;镉组小鼠大脑皮层组织均可见不规则空洞(白色箭头),大量神经元细胞核深染、固缩,呈三角形或不规则形(黑色箭头),部分核仁不明显,胞核与胞质界限模糊,并伴有小胶质细胞增生(灰色箭头),且25 mg/L镉组还可见大量的神经元排列紊乱。
2.3 慢性镉暴露对小鼠大脑皮质超微结构的影响
如图3所示,对照组细胞核完整,染色质较均匀,线粒体嵴有少量断裂但结构较为完整;5 mg/L镉组细胞核出现明显的不规则形态,线粒体嵴断裂,基质中有片状空腔;25 mg/L镉组细胞核皱缩严重,核内染色质向细胞核膜边缘聚集(边聚),线粒体损伤较严重,大部分线粒体嵴断裂、溶解,基质中有片状空腔,呈空泡变性,线粒体膜部分破损。
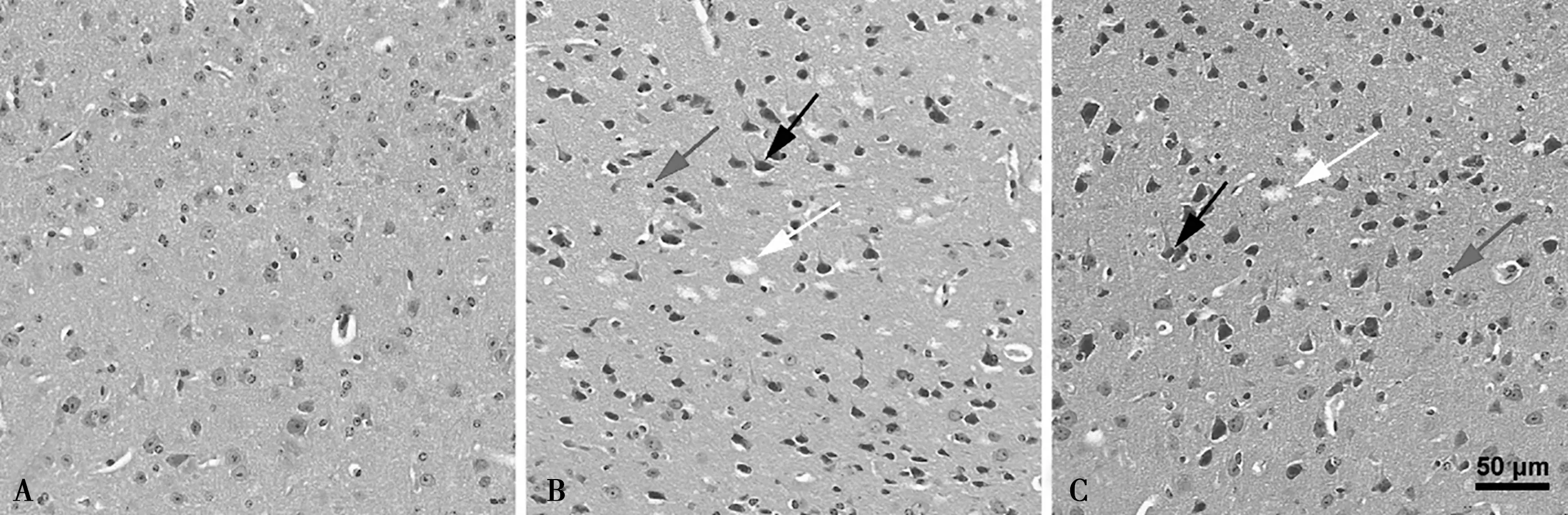
A.对照组;B.5 mg/L镉组;C.25 mg/L镉组
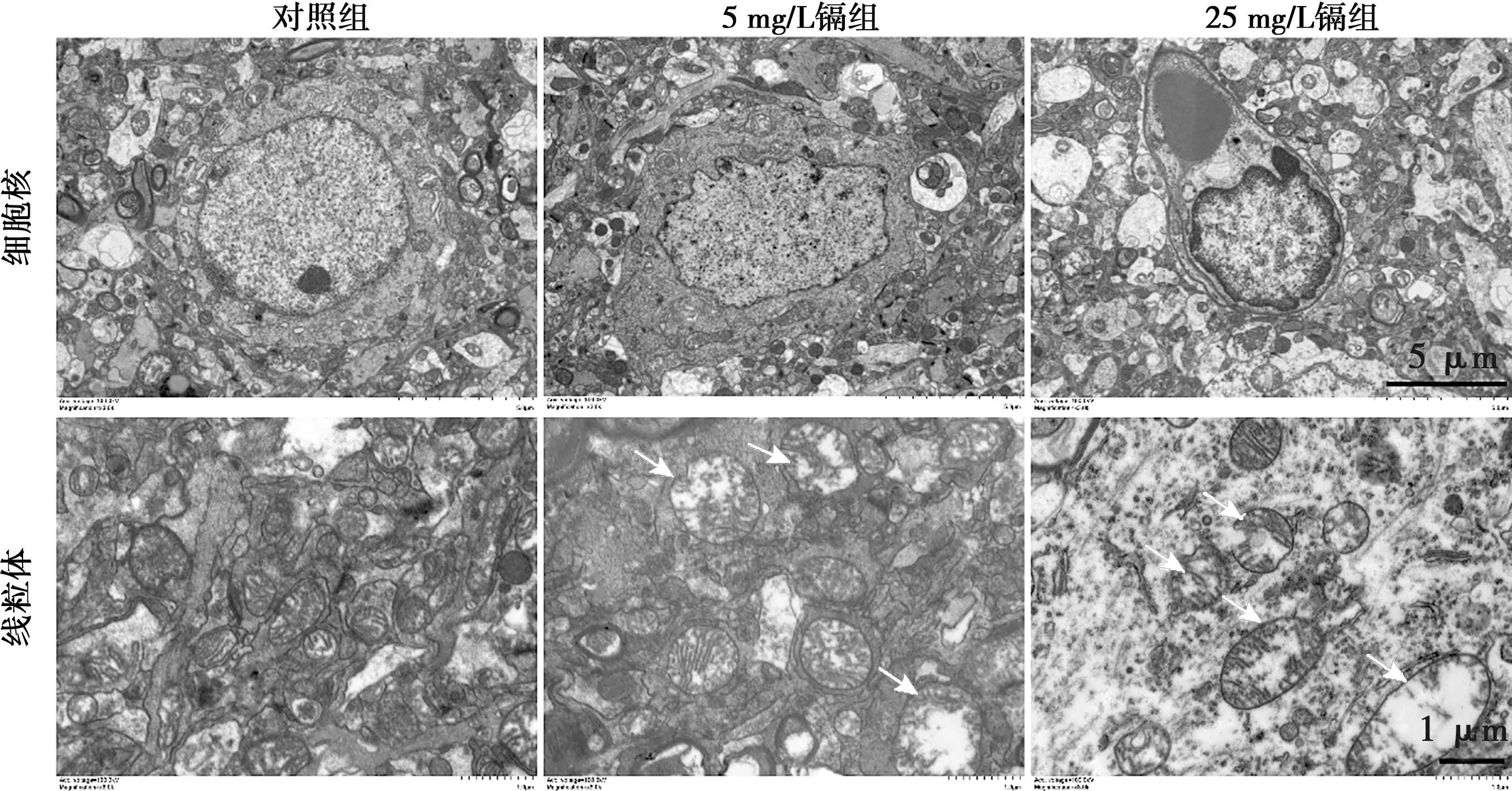
白色箭头指示损伤线粒体
2.4 慢性镉暴露对小鼠大脑皮质中氧化应激指标的影响
如图4所示,与对照组相比,5 mg/L和25 mg/L镉组小鼠大脑皮质中T-SOD活力均极显著下降(P<0.01),CAT活力显著下降(P<0.05),MDA、GSH含量极显著升高(P<0.01);5 mg/L氯化镉组GSH-PX活力显著升高(P<0.05),25 mg/L氯化镉组GSH-PX活力极显著升高(P<0.01)。
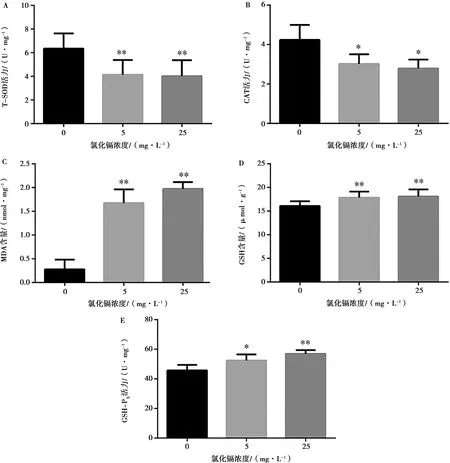
图4 小鼠大脑皮质中氧化应激指标的变化
3 讨论
镉是真核细胞中有毒且非必需的二价金属离子。慢性低浓度镉暴露主要是吸入含镉的烟雾和受污染的饮食引起,导致镉在神经系统积聚,严重影响神经系统功能[9-10]。脏器系数是毒理试验中常用指标,能直接反映靶器官的生长发育情况,也能间接地反映病理组织的变化。脏器系数增大,表示脏器充血、水肿或增生肥大等;脏器系数减小,表示脏器萎缩及其他退行性改变等。龙梦菲[11]研究表明,SD大鼠连续1周每日采用腹腔注射的方式给予醋酸镉(按体重2.5 mg/kg),可导致大鼠肾脏系数显著增大,造成肾脏充血、水肿或增生。赵世文[12]研究表明,SD大鼠经自由饮水染毒(50 mg/L醋酸镉溶液),连续处理12周,大鼠脑指数显著下降。本研究结果显示,镉暴露16个月导致小鼠脑系数显著降低,说明长期镉暴露对小鼠脑生长发育产生一定的影响。
病理组织学和超微结构的变化可直接反映致病因素对组织损伤的程度。在体内试验研究中,因所用动物的年龄和种属差异,镉导致实验动物中枢神经系统器质性损伤的报道有所不同。动物试验表明,小鼠皮下注射氯化镉,每周2次,每次2 mg/kg,可引起小鼠中脑黑质受损,神经元变性、坏死,黑质区有严重的软化灶形成,精神行为改变等[13]。Almeer等[8]研究表明,小鼠经腹腔注射6.5 mg/kg氯化镉,连续处理7 d,可引起小鼠皮质组织结构改变,表现为出现核染色深的退化神经元,炎性细胞浸润,细胞内外出现空泡。Unsal等[14]研究表明,大鼠皮下注射氯化镉1 mg/kg,连续处理30 d,导致大鼠额叶皮质组织结构异常改变,包括神经元胞质萎缩、核固缩以及空泡化,形成组织水肿。本研究发现,雌性BALB/c小鼠经不同浓度氯化镉(0、5和25 mg/L)自由饮水染毒16个月,可引起小鼠大脑皮质病理学改变,表现为神经元细胞核深染、固缩,呈三角形或不规则形,胞核与胞质界限模糊,并伴有小胶质细胞增生。重金属暴露可直接干扰线粒体内的巯氢基和巯基集团,释放大量的活性氧,当活性氧的水平达到一定高度,便会引起细胞超微结构的改变,导致线粒体功能损伤[15]。Yang等[16]研究表明,幼年小鼠经不同浓度氯化镉(1.87、3.74和7.48 mg/kg)自由饮水染毒,连续10 d,中、高剂量染镉组均可引起幼鼠大脑皮层神经元超微结构损伤,高剂量镉组超微结构损伤更为严重,表现为大脑皮层神经元异染色质边缘化,核膜不完整,核周间隙增宽,线粒体嵴模糊。Chen等[17]研究表明,小鼠经饮水暴露于不同浓度镉(0、10和50 mg/L)6周,可致小鼠大脑皮层神经元出现明显空泡化、不规则肿胀,线粒体嵴断裂。本研究表明,雌性BALB/c小鼠经不同浓度氯化镉(0、5和25 mg/L)自由饮水染毒16个月,可导致小鼠大脑皮质细胞核及线粒体损伤,表现为核皱缩,染色质边聚,线粒体嵴断裂、溶解,部分呈空泡变性。说明长期的镉暴露可致小鼠大脑皮质病理组织学及超微结构损伤。
氧化应激是镉致机体毒性作用的重要机制之一。氧化应激是由于正常的氧化与抗氧化平衡状态被破坏而引起的。当细胞发生氧化应激时,机体能够应付轻微的氧化应激,而严重的氧化应激超过细胞的抗氧化能力,会对脂质、蛋白质和DNA造成损害,甚至导致细胞死亡[18]。此外,自由基作用于脂质发生过氧化反应,氧化终产物为MDA,测定MDA的量可反映机体内脂质过氧化的程度,间接反映出细胞损伤的程度[19]。
SOD-CAT系统被认为是对抗活性氧类毒性的第一道防线,SOD可催化超氧阴离子自由基为H2O2,H2O2被CAT进一步分解为H2O和O2,从而减轻H2O2对组织的损伤[20]。曲莉等[19]研究表明,小鼠经腹腔注射氯化镉2.0 mg/kg,每周2次,连续4周,可引起小鼠脑组织SOD活性降低,MDA含量明显升高,导致脂质过氧化损伤。大鼠口服氯化镉5 mg/kg体重,处理6 d,可致大鼠脑组织中SOD与CAT活性降低,MDA含量增加[21]。SOD、CAT活性降低与MDA含量增加是氧化损伤的表现。本研究表明,镉暴露16个月能够引起小鼠大脑皮质中SOD、CAT活性降低以及MDA含量增加,说明慢性镉暴露可破坏脑组织的氧化平衡,引起脑组织氧化损伤。
GSH系统也是一种重要的抗活性氧的抗氧化防御系统[18]。GSH-PX是一种重要的过氧化物降解酶,将GSH氧化为谷胱甘肽二硫化物(GSSG)的过程中,促进过氧化氢的分解,从而保护细胞膜的结构和功能免受过氧化物的干扰和损伤。然后GSSG被谷胱甘肽还原酶(GR)还原为GSH,从而形成氧化还原循环以防止氧化损伤[22]。同时,GSH-PX以GSH为底物,将脂质过氧化物还原为无毒的脂质醇。这种相互转化的循环使细胞中的自由基得以持续清除[23]。赵世文[12]研究表明SD大鼠经自由饮水染毒(50 mg/L醋酸镉溶液),连续处理12周,导致大鼠大脑皮质GSH-PX活性和GSH含量升高。此外,Hatcher等[24]研究表明,GSH水平升高是细胞对镉的适应性反应,镉可促进细胞内GSH合成。本研究发现,镉暴露16个月可引起小鼠大脑皮质中GSH含量和GSH-PX活性升高,与前人研究结果一致,这是GSH系统被激活的表现。而在慢性镉暴露16个月引起细胞氧化损伤的情况下,GSH含量和GSH-PX活性仍然升高,这可能与GSH与GSH-PX的相互转化循环有关。
总之,慢性镉暴露可引起小鼠大脑皮质损伤,这可能与镉降低SOD-CAT抗氧化系统酶活性而引起的氧化应激有关。此外,GSH抗氧化防御系统在脑组织抵抗慢性镉毒性损伤中发挥重要作用,其具体机制有待进一步研究。
