Jagged-1抑制小鼠胚胎干细胞分化为造血干/祖细胞
2021-01-18陈日玲郑伟荣刘东强陈启康
陈日玲,郑伟荣,谭 霖,刘东强,史 惠,陈启康*
(1.广东医科大学附属顺德妇女儿童医院 儿科, 广东 顺德 528300; 2.泉州市第一医院 儿科, 福建 泉州 362000;3.广东医科大学附属医院 儿童医学中心, 广东 湛江 524023)
胚胎干细胞(embryonic stem cells,ESCs)是一种全能干细胞,具有被诱导分化为机体中的各种细胞类型的潜能[1]。随着干细胞研究的深入,建立了 “诱导多功能干细胞”技术,使体细胞有望重新编程为类似胚胎干细胞的全能分化潜能细胞。对于胚胎干细胞分化为造血干细胞/祖细胞(haematopoietic stem cell or haematopoietic progenitor cells,HSC/HPCs)相关机制的探索目前仍是一个研究热点[2]。前期研究发现Notch信号通路在胚胎干细胞分化为造血干细胞/祖细胞方面存在某种联系[3]。
Jagged-1是Notch主要的配体之一, 可与邻近细胞表面Notch的胞外结构域结合而触发 Notch 信号通路,通过HSE-1、DeiteX、Nur77、NF-κB和Numb等转录因子调节靶基因的表达,进而活化Notch信号传导通路。 DAPT为γ分泌酶抑制剂[4-5],可抑制早老素(presenilin1,PS1)依赖的γ分泌酶活性,进而抑制Notch受体的融蛋白性裂解即S3切割,阻断Notch受体活化的中心环节,使Notch受体分子无法进一步转变成有效的活性片段,最终抑制Notch信号通路的激活。
本研究旨在通过使用Jagged-1活化Notch信号通路及DAPT(γ-分泌酶抑制剂)抑制Notch信号通路,研究不同条件下该通路对小鼠胚胎干细胞分化为造血干/祖细胞中的影响,探讨Notch信号通路在小鼠胚胎干细胞分化中的作用。
1 材料与方法
1.1 材料
1.1.1 实验动物与细胞:清洁级8 ~10周昆明小鼠(19~22 g)(广东医科大学实验动物中心);细胞系:小鼠胚胎干细胞系C57[赛业(广州)生物科技有限公司]。
1.1.2 实验试剂:Knockout DMEM高糖培养基、DMEM高糖培养基、胎牛血清、非必需氨基酸、谷氨酰胺、2-巯基乙醇、青霉素、链霉素0.25% Trypsin-0.02% EDTA(胰蛋白酶)(Gibco公司);白血病抑制因子(Life Technology公司);抗体Anti-Mouse Sca-1 FITC、抗体Rat IgG2a K Isotype Control FITC、抗体Anti-Mouse CD34 eFluor 660、抗体Rat IgG2a K Isotype Control eFluor 660、抗体Anti-Mouse CD117 PE、抗体Rat IgG2a K Isotype Control PE(Ebioscience公司);Notch 1 抗体 (A-8)和CD34抗体(Santa Cruz公司);Protein Jagged-1(小鼠):Fc(human)(rec.)(AdipoGe公司);DAPT(Selleckchem公司);DMSO(MP Biomedicals公司);丝裂霉素C(上海新亚公司);氯仿、异丙醇、Tris碱、硼酸(广州化学制剂总厂);DEPC(Sigma-Aldrich公司);琼脂糖(Hydragene公司);DNase Ⅰ(RNase-free)(TaKaRa公司);Real-time PCR试剂盒(TOYOBO公司)。
1.2 方法
1.2.1 体外培养原代小鼠胚胎成纤维细胞(mouse embryonic fibroblast,MEF)作为胚胎干细胞的饲养层:无菌超净台内取出孕12.5 d胚胎,将躯干组织剪碎,消化法获得细胞悬液,铺皿后体外培养,隔天换液,2~3 d消化法传代培养。取第2~4代细胞经10 μg/mL丝裂霉素C处理作为饲养层。
1.2.2 体外增殖小鼠胚胎干细胞: 复苏小鼠胚胎干细胞在经10 μg/mL丝裂霉素C处理好的饲养层上,加含1 000 U/mL白血病抑制因子(leukemia inhibitory factor,LIF)的ESCs培养基,每天或隔天换液,3~4 d消化传代培养。
1.2.3 体外诱导分化小鼠胚胎干细胞
1.2.3.1 拟胚体形成:将诱导生长的拟胚体经0.25%胰蛋白酶-EDTA 消化后, 吹打制成单细胞悬液,差时贴壁法分离去除饲养层细胞,在无饲养层无LIF(1 000 U/mL)条件下培养4 d,可形成球形拟胚体。
1.2.3.2 细胞的分组及处理:按计划分5组加药处理培养10 d。
EB(拟胚体细胞,embryoid cell)组、对照组、Jagged-1组、DAPT组和Jagged-1-DAPT组。其中EB组即为拟胚体细胞冻存10 d后复苏组;对照组为无饲养层无LIF培养基条件下培养拟胚体细胞,处于自然分化状态;其余各组为加入活化剂或(和)抑制剂并在无饲养层无1 000 U/mL LIF条件下培养的拟胚体细胞(Jagged-11 00 ng/mL, DAPT 10 nmol/mL),加药后培养10 d,属于调控分化状态。
1.2.4 流式细胞测量术检测小鼠造血干/祖细胞:收集诱导分化培养10 d的细胞,流式细胞测量术检测小鼠胚胎干细胞特异性表型CD31、SSEA1及造血干/祖细胞特异性表型CD117、 CD34、Sca1。
1.2.5 实时定量PCR检测相关基因表达:抽提上述诱导10 d各组细胞的总RNA, RT-qPCR检测Notch信号通路基因Notch1、Notch2、Notch4和Hes1;小鼠胚胎干细胞表型基因SSEA1、 Oct4;及造血干/祖细胞表型基因Sca1、H2k和c-kit。

表1 PCR引物序列和产物大小Table 1 Sequence of PCR primers and size of PCR products
1.3 统计学分析
2 结果
2.1 拟胚体形成
ESCs体外增殖对饲养层条件要求较高,饲养层细胞(MEF)活性好,则ESCs增殖迅速,形成的鸟巢样克隆数多,形态均一。而饲养层活性差时,ESCs克隆数明显减少,且大小不一;去除抑制分化的饲养层及LIF,悬浮培养2~3 d可形成球形拟胚体(embryoid body),即EB组细胞(图1): A: MEF原代体外培养 细胞展开呈梭形,增殖状态好,2~3 d汇合度90%或以上;B:饲养层制备,经丝裂霉素C处理24 h后可见细胞形态呈明显的纤维样改变;C: ESCs体外增殖,ESCs培养3~4 d形成明显的克隆,克隆数较少且克隆大小不等,形态基本规则;D:诱导EB形成,扩增的ESCs克隆消化为单细胞,去除LIF及饲养层条件下培养,2~3 d后出现球形拟胚体。
2.2 形态学观察ESCs分化的细胞
将拟胚体消化成单细胞后接种在明胶预处理的6孔板中,细胞贴壁后加药,观察各组分化情况(图2)。A: 拟胚体细胞镜下形态,细胞呈克隆样,克隆表面光滑,边缘清晰,细胞排列紧密,细胞间黏附性强,透光度较高,颜色较均匀;B: 为自然分化干细胞镜下形态,细胞呈克隆样,克隆体积变大,边缘较清晰,但细胞间黏附性较差,结构松散,透光度较差,内可见较多棕色团块;C:为加入Jagged-1后干细胞镜下形态,细胞虽呈克隆,体积增大,但细胞排列较紧密,边缘清晰,透光度降低,克隆内见小部分深色团块;D:为加入DAPT后干细胞镜下形态,细胞呈克隆样,克隆体积明显增大,形状不规则,边缘模糊,克隆间相互联系,结构松散,克隆内呈淡黄, 透光度差。E: 为加入Jagged-1及DAPT后干细胞镜下形态,细胞呈克隆样,与D组情况类似,可见克隆体积增大,形状不规则,边缘模糊,克隆内可见呈黄色或深棕色团块。
2.3 流式细胞测量术鉴定细胞分化结果
流式细胞测量术检测诱导10 d各组细胞的分化效果(表 2)。EB形成时已有少量ESCs分化为CD117+CD34+Sca1+造血干/祖细胞;Jagged-1组细胞胚胎干细胞数较对照组和 Jagged-1-DAPT组明显增多(P<0.05)(图3,5)。Jagged-1-DAPT组分化的HSC/HPC数较control组及Jagged-1组明显增多(P<0.05)(图4,6)。

A.microscopic morphology of MEF primary culture in vitro; B.microscopic morphology of feeding layer preparation; C.microscopic morphology of ESCs in vitro proliferation; D.microscopic morphology of induced EBs formation图1 不同时期拟胚体的形态特点Fig 1 Formation of embryoid bodies at different times

A.microscopic morphology of embryoid cells(EBs); B.microscopic morphology of naturally differentiated stem cells(control); C.microscopic morphology of stem cells after Jagged-1 was added(Jagged-1); D.microscopic morphology of stem cells after DAPT was added(DAPT); E.microscopic morphology of stem cells after DAPT and Jagged-1 was added(Jagged-1-DAPT)图2 诱导10 d后各组的拟胚体的形态特点Fig 2 Formation of embryoid bodies for 10 days in each group
表2 CD31+SSEA1+细胞及CD117+CD34+Sca1+细胞在各组中所占百分比Table 2 Percentage of CD31+SSEA1+ cell and CD117+ CD34+Sca1+ cells in each
2.4 实时定量PCR检测相关基因表达
2.4.1 检测干细胞相关表型基因SSEA1、Oct4、c-Kit、H-2k和Sca1表达量变化如下:与ESCs组相比,除Jagged-1组SSEA1及Oct4 mRNA表达量外无明显降低,其余各实验组的SSEA1(P<0.01)及Oct4(P<0.05)mRNA表达量明显降低,提示存在ESCs分化,而Jagged-1组蛋白通过激活Notch通路抑制ESCs的分化;检测造血干/祖细胞基因特异性基因c-Kit、H-2k,各实验组均可测出。DAPT组及Jagged-1-DAPT组表达量较其余各组明显增多(P<0.05)。
2.4.2 Notch信号通路相关基因Notch1、Notch 2、Notch 4表达量变化: 与ESCs组细胞相比,Jagged-1-DAPT组、DAPT组及对照组的Notch1,2,4的mRNA的表达量均有降低,考虑为胚胎干细胞分化后Notch1,2,4基因可能受到抑制;DAPT组及Jagged-1-DAPT组之Notch1、Notch4表达量较对照组降低(P<0.05)(表3)。
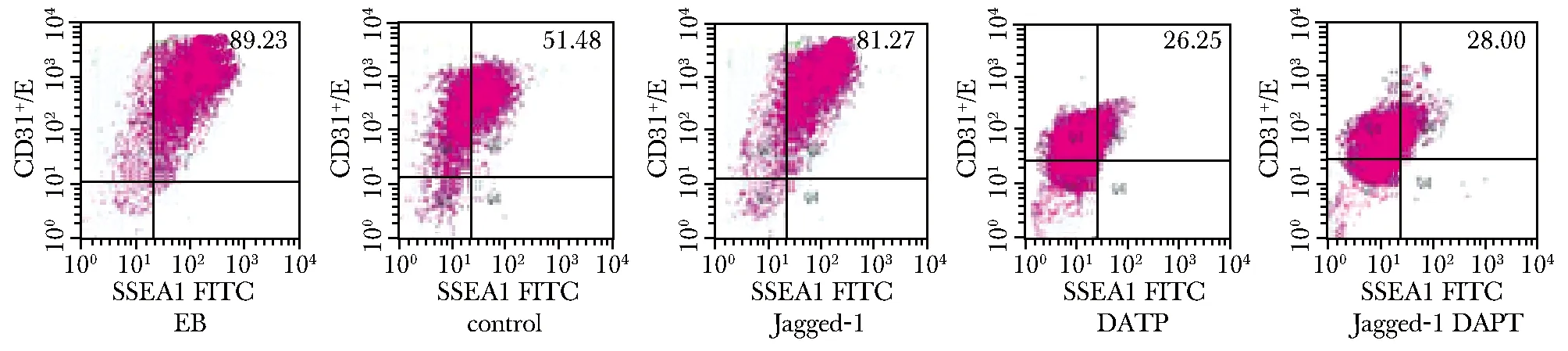
图3 胚胎干细胞分化流式图Fig 3 Flow chart of the embryonic stem cells
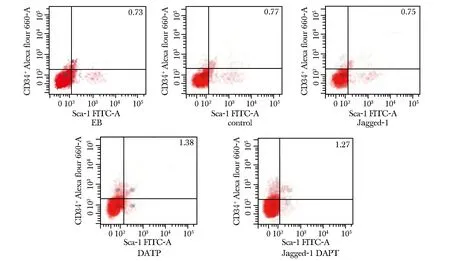
图4 造血干细胞分化流式图Fig 4 Flow chart of the haematopoietic stem cells
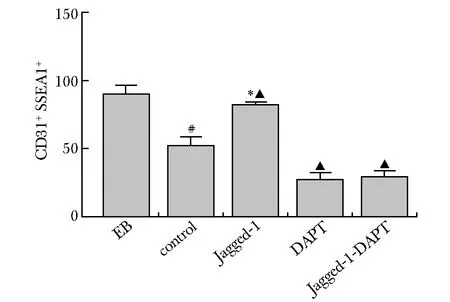
#P<0.05 compared with EB group;▲P<0.05 compared with concrol group; *P<0.05 compared with Jagged-1 group图5 CD31+SSEA+胚胎干细胞百分比Fig 5 Percentage of CD31+SSEA+ in each groups
3 讨论
胚胎干细胞具有多种分化潜能,可定向诱导分化成特异性细胞。如内皮细胞、神经干细胞、造血干细胞等。其中造血干细胞移植可用于治疗造血及免疫系统功能障碍性疾病[6-7],如何诱导胚胎干细胞高效分化为造血干细胞仍是目前研究的热点。
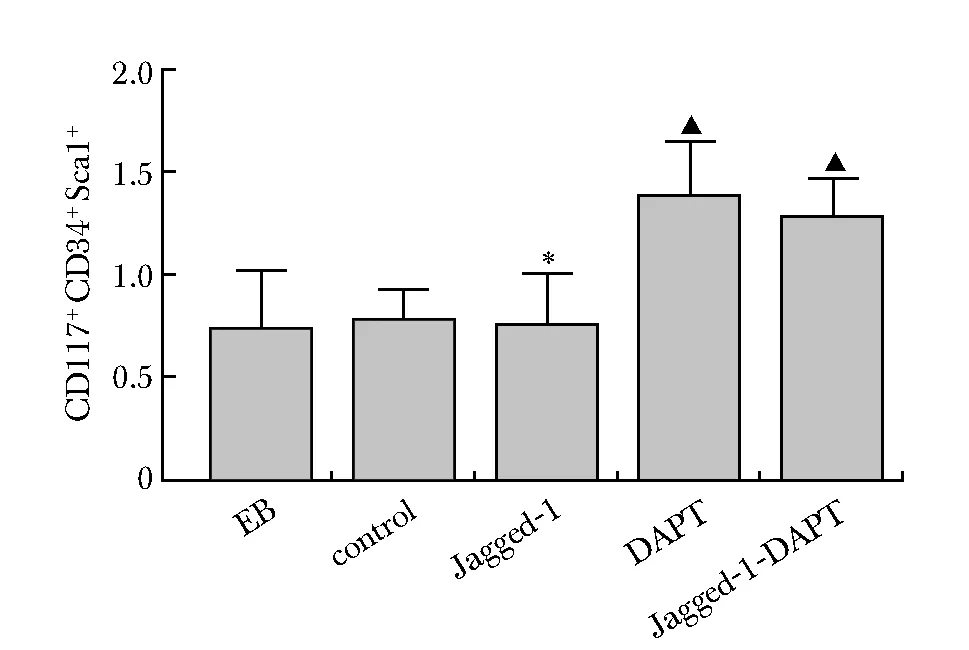
#P<0.05 compared with EB group;▲P<0.05 compared with concrol group; *P<0.05 compared with Jagged-1 group图6 CD117+CD34+Sca-1+造血干/祖细胞百分比Fig 6 Percentage of CD117+CD34+Sca-1+ in each
在造血干细胞中可以检测到Notch受体与配体的表达[8-9],现在已经确定胚胎干细胞在胚胎期间形成, 这个过程完全依赖于Notch信号的传导。研究表明,几个Notch功能突变体包括Notch1、RBPj、Mindbomb和Jagged-1丢失后可影响胚胎造血系统的发育[10]。
本实验研究观察到各组加药诱导分化阶段细胞与EB组细胞比较示,对照组中自然分化下细胞呈集落样,集落内可见少许形态不一致细胞,提示自然环境下胚胎干细胞已存在分化;DAPT-Jagged-1组及DAPT组已形成较大的集落, 与对照组及Jagged-1组比较有明显的差异,形态学上提示胚胎干细胞已分化的可能性极大, 而从形态学推断Jagged-1能激活Notch通路抑制了胚胎干细胞分化,DAPT阻断Notch通路能促进胚胎干细胞分化。
表3 各组细胞各基因mRNA相对表达量Table 3 mRNA expression of related genes in each group n=9)
Notch信号通路调控Hes和Hey家族转录,共同遏制下游信号传导。Hes1是Notch信号通路的直接靶基因,并被高度表达在胚胎干细胞中[11-12]。本实验研究发现加入Notch信号通路激活剂Jagged-1后,Hes1及SSEA1明显较加入Notch信号通路抑制剂DAPT明显增多,而造血干/祖细胞表型基因c-Kit较加入Notch信号通路抑制剂DAPT明显减少。结果提示在胚胎干细胞中持续激活Notch信号抑制了胚胎干细胞向造血干细胞分化,而抑制Notch信号通路促进了胚胎干细胞向造血干细胞分化。这与报道的[13]维持Notch活性低于特定的阈值后可促进胚胎干细胞向造血干细胞分化结果相似。最近研究也表明通过抑制miR126 / Notch1途径可促进体外小鼠胚体干细胞向造血干细胞分化[14]。
综合Notch受体、该通路下游基因Hes-1的变化及流式细胞测量术结果,说明DAPT阻断Notch信号通路后促进小鼠胚胎干细胞分化为造血干/祖细胞,而Jagged-1激活Notch受体可抑制胚胎干细胞的分化。提示 Notch信号通路在调控小鼠胚胎干细胞向造血干/祖细胞分化中起重要作用,而这种调控作用机制可能主要是激活的Notch信号通路使Hes-1表达,Hes-1作为转录因子,可通过抑制bHLH家族中某种分化诱导因子,使其构象发生变化,阻止其与靶基因结合,从而使各种前体细胞维持在未分化的增殖状态,维持一定的细胞数量,确保恰当的分化时间,但究竟为bHLH家族中何种分化诱导因子,有待下一步的研究。
综上所述,Jagged-1激活 Notch信号通路可抑制胚胎干细胞向造血干/祖细胞的分化,而DAPT阻断Notch信号通路后则促进胚胎干细胞向造血干/祖细胞的分化。从而推断:Notch信号通路在调控胚胎干细胞分化为造血干/祖细胞中起重要作用。
