羟基红花黄色素A抑制高糖诱导的小鼠肾足细胞损伤
2021-01-18周美兰
谢 飞,周美兰
(1.武警陕西省总队医院 内一科, 陕西 西安 710054; 2.空军军医大学第一附属医院 肾脏内科, 陕西 西安 710032)
糖尿病肾病(diabetic nephropathy,DN)是糖尿病患者常见的合并症之一,也是目前引起终末期肾病的重要原因[1];足细胞是肾小球过滤屏障的重要组成部分,在维持肾小球滤过膜正常通透性方面发挥着重要作用,其损伤与DN发生发展密切相关,而改善足细胞损伤可减缓或阻止DN发展[2]。羟基红花黄色素A(hydroxysafflower yellow A,HYSA)是从中药红花中提取的一种具有单查尔酮苷类结构的化合物,是红花黄色素的主要药理活性成分,具有抗肿瘤、抗氧化和抗感染等多种药理活性[3]。研究[4]显示,HYSA可通过减少高糖诱导的人脐静脉内皮细胞凋亡和活性氧的生成等发挥保护糖尿病血管损伤的作用。有研究[5]指出,HYSA具有保护慢性肾病肾脏功能的作用,但其对DN的影响并不完全清楚。本研究通过观察HYSA对高糖诱导的足细胞损伤的影响及其机制,旨在揭示HYSA是否具有保护足细胞损伤的作用,为DN的治疗提供新线索。
1 材料与方法
1.1 材料
1.1.1 细胞: 小鼠肾足细胞系MPC5(上海斯信生物公司)。
1.1.2 试剂及试剂盒: γ干扰素(Protech公司);HSYA标准品(纯度≥98%,上海源叶生物科技公司);RPMI1640培养基、0.25%胰蛋白酶和胎牛血清(Gibco公司);BCA蛋白定量试剂盒和全蛋白提取试剂盒(北京索莱宝生物技术公司);MDA、SOD和GSH-PX检测试剂盒(南京建成生物工程研究所);CCK-8试剂盒(日本同仁化学研究所);Anexin V-FITC/PI细胞凋亡检测试剂盒(上海贝博生物科技有限公司);caspase-3活性检测试剂盒(Cell Signal Technology公司);Nephrin、α-SMA、fibronectin、JNK和p-JNK抗体(Santa Cruz Biotechnology公司);GAPDH、VEGF抗体(Abcam公司);辣根过氧化酶标记的IgG二抗(北京中杉金桥生物公司)。
1.2 方法
1.2.1 细胞的培养、分组与处理: 先在温度为33 ℃、CO2体积分数为5%的细胞培养箱内,用含10 U/mL γ干扰素和10%胎牛血清的RPMI1640培养基培养小鼠肾足细胞。待细胞汇合度达80%左右时,转入温度为37 ℃、CO2体积分数为5%的条件下以无γ干扰素的培养基继续培养14 d左右,待分化成熟后进行实验。实验分为对照组(control)、高糖组(HG)及低、中、高剂量干预组。Control组给予5 mmol/L葡萄糖;HG组给予30 mmol/L葡萄糖;低、中、高剂量干预组给与30 mmol/L葡萄糖和终浓度分别为0.5、1、2 mg/L的HYSA。另设置一个不含细胞的空白对照组。其中每组设置3个复孔。
1.2.2 CCK-8法检测细胞活力: 将对数增殖期的足细胞以每孔5×104个接种至96孔细胞板上后,置于37 ℃、5% CO2条件下常规培养过夜。次日,根据1.2中的分组处理细胞;处理24 h后,每孔加入10 μL CCK-8溶液;孵育2 h后,用酶标仪检测足细胞在450 nm处的吸光度值,并计算出各组细胞存活率。实验重复3次。计算公式:细胞存活率(%)=(实验组吸光度值-空白组吸光度值)/(对照组吸光度值-空白组吸光度值)×100%。
1.2.3 流式细胞测量术检测细胞凋亡: 收集上述各组细胞,经磷酸缓冲液洗涤2次后,以1×结合缓冲液重悬细胞,取100 μL细胞悬液(浓度为109个/L)于离心管中,避光下加入annexin V和PI各5 μL,室温反应15 min后,流式细胞测量术检测各组细胞凋亡率。实验重复3次。
1.2.4 比色法检测细胞caspase-3活性:收集上述各组细胞,参照caspase-3活性检测试剂盒说明书步骤检测各组细胞caspase-3活性。实验重复3次。
1.2.5 检测细胞内MDA、SOD和GSH-PX含量:收集上述各组细胞,经磷酸缓冲液洗涤3次后,以匀浆器冰冻破碎,参照MDA、SOD和GSH-PX试剂盒说明书检测各组细胞内MDA、SOD和GSH-PX含量。实验重复3次。
1.2.6 Western blot检测细胞中nephrin、fibronectin、α-SMA、JNK、p-JNK和VEGF蛋白表达水平: 参照全蛋白提取试剂盒说明书提取足细胞总蛋白后,用BCA法检测总蛋白的浓度与纯度。将蛋白样品与上样缓冲液等体积混匀后,置于沸水浴中煮沸5 min。将变性后的蛋白样品行SDS-PAGE分离后,电转至PVDF膜上。经5%脱脂奶粉封膜2 h后,以一抗(nephrin 1∶800、fibronectin 1∶800、α-SMA 1∶1 000、JNK 1∶1 000、p-JNK 1∶1 000、VEGF 1∶1 000和GAPDH 1∶1 000)工作液4 ℃孵育过液;次日,再以二抗工作液(1∶5 000)室温孵育2 h后,暗室内加入化学发光剂显影曝光。以GAPDH为内参,采用凝胶成像分析系统扫描分析足细胞中nephrin、fibronectin、α-SMA、JNK、p-JNK和VEGF蛋白表达水平。实验重复3次。
1.3 统计学分析
2 结果
2.1 HYSA对高糖诱导的足细胞存活率的影响
高糖组细胞存活率较对照组明显降低(P<0.05);与高糖组比较,0.5、1和2 mg/L HYSA能够不同程度地升高足细胞存活率(P<0.05),且HYSA浓度越高足细胞存活率越高(表1)。
表1 各组细胞存活率的比较Table 1 Comparison of cell survival rates in each group
2.2 HYSA对高糖诱导的足细胞凋亡的影响
与对照组比较,HG组细胞凋亡率和caspase-3活性明显升高(P<0.05);给予HYSA(0.5、1和2 mg/L)作用后高糖对足细胞凋亡和caspase-3活性的促进作用明显受到抑制(P<0.05),且HYSA浓度越高,足细胞凋亡率和caspase-3活性越低(图1,表2)。
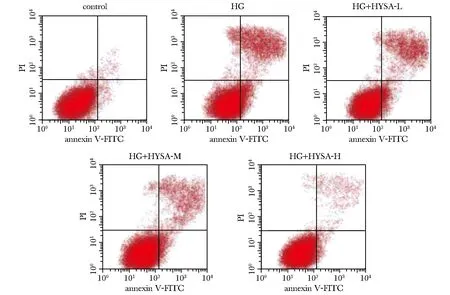
图1 流式细胞仪检测各组细胞凋亡情况Fig 1 Flow cytometry detected apoptosis of each group
表2 各组细胞凋亡率和caspase-3活性的比较Table 2 Comparison of cell apoptosis rate and caspase-3 activity in each
2.3 HYSA对高糖诱导的足细胞上皮间质转化的影响
与对照组比较,HG组细胞中nephrin蛋白表达水平明显下降,而fibronectin和α-SMA蛋白表达水平明显升高(P<0.05);给予0.5、1和2 mg/L HYSA作用后足细胞中nephrin蛋白表达水平逐渐升高,而fibronectin和α-SMA蛋白表达水平逐渐降低,且与HG组比较差异均明显(P<0.05)(图2)。
2.4 HYSA对高糖诱导的足细胞氧化应激的影响
与对照组比较,HG组细胞中SOD和GSH-PX含量明显降低,而MDA含量明显升高(P<0.05);与HG组比较,HYSA能够不同程度地升高足细胞内SOD和GSH-PX含量,降低足细胞内MDA含量(P<0.05),且呈浓度依赖性(图3)。
2.5 HYSA对高糖诱导的足细胞中JNK磷酸化和VEGF蛋白表达水平的影响
与对照组比较,HG组细胞中JNK磷酸化水平及VEGF蛋白表达水平均明显升高(P<0.05);与HG组比较,给予0.5、1和2 mg/L HYSA作用后足细胞中JNK磷酸化水平及VEGF蛋白表达水平逐渐降低(P<0.05)(图4)。
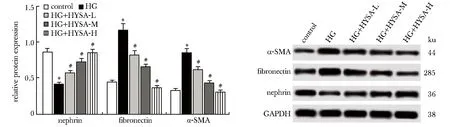
*P<0.05 compared with control group;#P<0.05 compared with HG group图2 各组细胞中nephrin、fibronectin和α-SMA蛋白表达水平的比较Fig 2 Comparison of nephrin, fibronectin and α-SMA protein expression levels in each
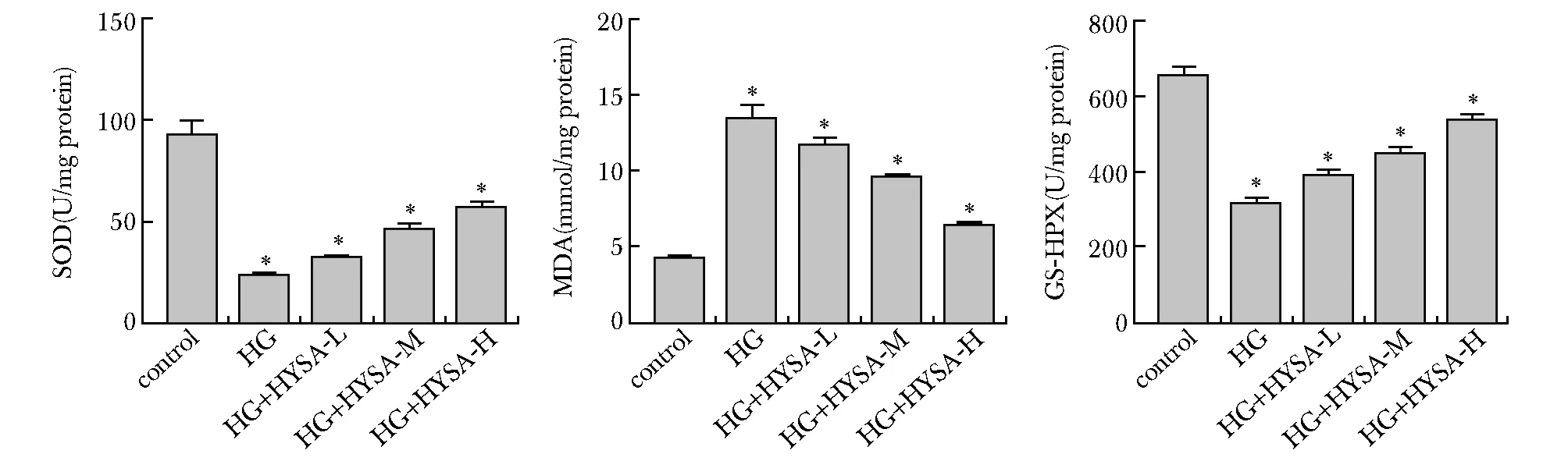
*P<0.05 compared with control group图3 各组细胞SOD、MDA和GSH-PX含量的比较Fig 3 Comparison of SOD, MDA and GSH-PX contents in each
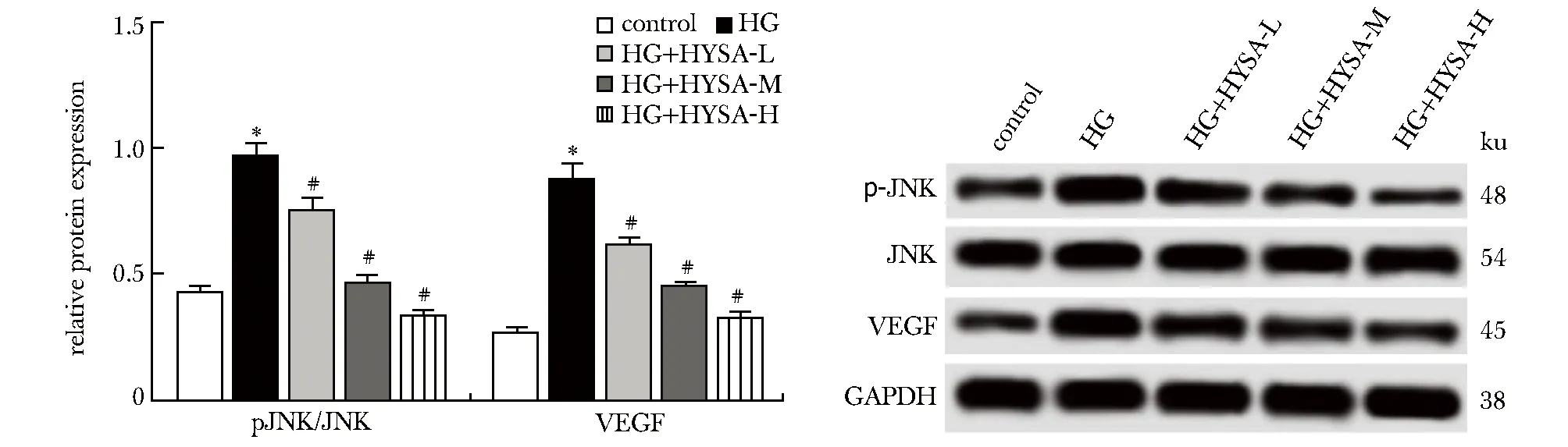
*P<0.05 compared with the control group;#P<0.05 compared with the HG group图4 各组细胞中JNK磷酸化水平和VEGF蛋白表达水平的比较Fig 4 Comparison of JNK phosphorylation level and VEGF protein expression level in each
3 讨论
高糖环境下,足细胞数量减少,上皮表型蛋白nephrin表达降低,而间质表型蛋白fibronectin、α-SMA表达升高,足细胞发生上皮间质转化,足细胞骨架出现紊乱、重组,引起足细胞形态和功能失调[6];另外,高糖还可引起足细胞氧化应激反应,加重足细胞损伤[7]。足细胞数量减少、转分化和氧化应激等是导致足细胞屏障功能减弱、促进DN发生发展的重要机制。因此,高糖诱导的足细胞损伤常被作为研究DN足细胞损伤的细胞模型[8]。本研究以高糖刺激后发现,足细胞存活率和nephrin蛋白表达水平明显降低,细胞凋亡率、凋亡执行因子caspase-3活性和fibronectin、α-SMA蛋白表达水平明显升高;同时,足细胞内SOD和GSH-PX含量降低,而MDA含量升高。表明高糖诱导的足细胞损伤模型构建成功。
HYSA是一种具有广泛生物学活性的查耳酮类化合物,可通过调控细胞凋亡、上皮间质转化和氧化应激等在肺、脑和心肌等组织中发挥保护作用[9-11]。HSYA还可通过调控JNK/c-Jun信号通路抑制高糖诱导的胰岛β细胞氧化应激反应,减轻细胞凋亡,在糖尿病防治中具有潜在的应用价值[12]。本研究发现HYSA作用后,足细胞活力、nephrin蛋白表达水平和SOD、GSH-PX含量呈浓度依赖性升高,而细胞凋亡率、caspase-3活性和fibronectin、α-SMA蛋白表达水平以及MDA含量呈浓度依赖性降低,高糖刺激引起的足细胞损伤明显改善。表明HSYA可通过抑制足细胞凋亡、上皮间质转化和氧化应激改善高糖诱导的足细胞损伤。这提示HSYA在DN防治中具有潜在的应用价值。JNK信号通路在DN中异常活化,可通过影响足细胞凋亡和氧化应激等参与DN的发生发展,抑制该通路的活化可减轻足细胞损伤,恢复足细胞功能[13]。VEGF是一种作用很强的促血管生长因子,其异常表达与DN足细胞氧化应激及微血管病变密切相关[14]。HYSA具有抑制JNK信号通路和VEGF表达的作用[15]。进一步检测发现,HYSA可呈浓度依赖性降低高糖引起的JNK磷酸化和VEGF蛋白表达。提示HYSA改善足细胞损伤的作用机制可能与抑制JNK信号通路活化和VEGF表达有关。
综上所述,HYSA可通过抑制高糖诱导的细胞凋亡、上皮间质转化和氧化应激保护足细胞损伤,该作用可能是通过抑制JNK信号通路活化和VEGF表达来实现的。
