过表达SHOX2对BMP9诱导的小鼠间充质干细胞系C3H10T1/2成骨分化的影响
2021-01-18袁晓慧黄华坤杨春梅张露露罗小辑罗进勇
张 平,袁晓慧,黄华坤,杨春梅,张露露,罗小辑,罗进勇*
(1.重庆医科大学 检验医学院 临床诊断教育部重点实验室,重庆 400016;2.重庆医科大学附属第一医院 骨科, 重庆 400016)
骨组织工程主要以种子细胞、诱导细胞因子、支架材料3者构建细胞生物材料复合体,是治疗由外伤、感染、肿瘤等因素导致骨缺损的理想手段[1]。间充质干细胞是一类多能祖细胞,来源于骨髓、脐带、滑膜等,可多向分化为骨及软骨、脂肪、肌肉等组织,是骨组织工程中重要的种子细胞[2]。骨形态发生蛋白(bone morphogenetic proteins, BMPs)则是骨再生中诱导成骨分化的关键细胞因子之一。BMPs属于转化生长因子超家族,现已知包含15个成员,但仅BMP-2、4、6、7、9能诱导软骨及骨形成。其中重组人BMP2及BMP7已作为骨诱导剂应用于临床治疗骨不连及骨缺损[3]。本课题组前期研究发现BMP9在体内外促成骨能力最强,但机制尚不明确[4]。矮小身材同源框基因(short stature homeobox 2,Shox2)是同源框家族一员,编码含有DNA结合结构域的60个氨基酸残基基序蛋白质。在骨发育中,Shox2突变小鼠模型表现出肱骨股骨缺失导致的肢体缩短,且与软骨形成密切相关[5],而SHOX2在成骨形成中的作用研究较少。此外,鼠科SHOX2蛋白与人同源性高达99%[6]。因此,本文通过体外实验在小鼠间充质干细胞C3H10T1/2细胞中过表达SHOX2,来探讨其对BMP9诱导的成骨分化影响。
1 材料与方法
1.1 材料
小鼠间充质干细胞系C3H10T1/2(美国典型菌种保藏中心, ATCC);人胚肾HEK293和结直肠癌HCT116细胞系(本实验室保存);高保真酶PrimeSTAR、碱性磷酸酶(alkaline phosphatase, ALP)定量底物(TaKaRa公司);限制性内切酶BamHⅠ、XbaⅠ、PmeⅠ、PacⅠ,DNA连接酶(New England BioLabs公司);胶回收试剂盒、质粒抽提试剂盒(Omega Bio-tek公司);LipofectamineTm2000转染试剂(Thermo Fisher Scientificals公司);BMP9过表达腺病毒(BMP9 recombinant adeno-viruse, Ad-BMP9,芝加哥大学分子肿瘤实验室何通川教授惠赠);结晶紫染液、蛋白提取试剂盒、碱性磷酸酶检测试剂盒(上海碧云天生物技术公司);细胞裂解液(Promega公司);抗坏血酸(Sangon Biotech公司);β-甘油磷酸二钠盐和茜素红S(Solarbio公司);PCR引物(GeneScript公司合成);DMEM高糖培养基和优质胎牛血清(Hyclone公司);兔抗人成骨相关转录因子(runt-related transcription factor 2, RUNX2)(Abcom公司);兔抗人增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)、兔抗T-EKR1/2、兔抗人p-EKR1/2(Cell Signaling Technology公司);鼠抗人β-actin(南京钟鼎生物公司);辣根过氧化物酶标记的山羊抗兔/鼠 IgG(北京中杉金桥有限公司)。
1.2 方法
1.2.1 细胞的分组及处理: 实验分为对照(normal control, NC)组,SHOX2过表达腺病毒(SHOX2 recombinant adenoviruse, Ad-SHOX2)组,BMP9组和BMP9+Ad-SHOX2组。将C3H10T1/2 细胞接种于含10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的DMEM高糖培养液。置于37 ℃、CO2体积分数为5%恒温培养箱。NC组不做处理。待细胞汇合度约40%,BMP9+Ad-SHOX2组加入Ad-SHOX2,8 h后换液,24 h后加入条件培养液,连续培养。Ad-SHOX2组及BMP9组于同上时间点作相应处理。
1.2.2 引物设计: 引物设计(表1),SHOX2 NCBI参考序列为NM_013665.1。

表1 PCR引物序列Table 1 Primer sequence of PCR
1.2.3 Ad-SHOX2的构建: 穿梭质粒pAdTrace-TO4-SHOX2和重组质粒构建以及腺病毒包装,参照文献[7]的方法。LipofectamineTm2000转染HEK293细胞,表达红色荧光且荧光量增加则构建成功。
1.2.4 BMP9条件培养液的制备: 将HCT116细胞接种于直径10 cm培养皿,待细胞增殖至汇合度约80%,加入Ad-BMP9,4 h后换液为5 mL双无抗培养液,分别于24 与48 h收取条件培养液,1 000 r/min离心3 min去除细胞及碎片。
1.2.5 ALP活性的测定: 将C3H10T1/2细胞接种于 24 孔板条件培养5 d,ALP定性按照ALP染色试剂盒参考方法进行检测。ALP定量测定,每孔加入100 μL 1×细胞裂解液,静置5 min,收集裂解液于1.5 mL 离心管,13 000 r/min,离心5 min,吸取10 μL上清液于工作液(5 μL ALP底物+10 μL缓冲液),测定荧光值。
1.2.6 钙盐沉积的测定: 将C3H10T1/2细胞接种于 24 孔板,10% FBS钙盐培养液(含有50 mg/L抗坏血酸,10 mmol/L β-甘油磷酸二钠盐)与条件培养液共培养21 d, 茜素红S染色(弃培养液,PBS 洗涤3次,0.05%戊二醛溶液固定10 min,弃固定液,ddH2O洗涤3次,每孔加入200 μL 0.05%茜素红S,显微镜观察,待出现红色颗粒物质堆积时,弃染液,加入ddH2O终止反应),记录钙盐沉积情况。
1.2.7 增殖能力的检测: 将C3H10T1/2细胞接种于 24 孔板条件培养24 h后,显微镜观察并记录细胞增殖情况。
1.2.8 Western blot检测RUNX2、PCNA、磷酸化及总ERK1/2蛋白表达: 将C3H10T1/2细胞接种于直径100 mm培养皿中,条件培养24 h后提取总蛋白。蛋白上样,10% SDS-PAGE电泳分离后,转膜,5% BSA封闭液封闭2 h,一抗置于4 ℃孵育过夜,洗膜3次,37 ℃孵育二抗1h,洗膜3次,化学发光显影。Image J软件分析电泳条带灰度值,以β-actin作为内参,得出蛋白相对表达水平。
1.3 统计学分析

2 结果
2.1 Ad-SHOX2成功构建
PCR筛选结果(图1A),片段大小符合,且无非特异性条带,测序穿梭质粒pAdTrace-TO4-SHOX2,对比序列正确。琼脂糖凝胶电泳初步鉴定重组质粒(图1B),PacⅠ酶切进一步鉴定(图1C),正确重组质粒酶切后出现4.5 kb或者3 kb片段。转染HEK293细胞,第5天观察到红色荧光量较高(图1D)。
2.2 SHOX2对BMP9诱导的C3H10T1/2细胞成骨分化影响
ALP染色及定量结果(图2A,B),Ad-SHOX2组与BMP9组较NC组ALP活性显著增加,且BMP9+Ad-SHOX2组较前两组ALP活性明显升高(P<0.05)。钙盐沉积结果(图2C),与NC组相比,Ad-SHOX2组与BMP9组增多。低感染率SHOX2处理后(图2Cb),BMP9+Ad-SHOX2组较前两组钙盐堆积减少。此外,高感染率SHOX2处理后(图2Ca),BMP9+Ad-SHOX2组较BMP9组钙盐结节增多,与Ad-SHOX2组无明显差异。
2.3 SHOX2促进C3H10T1/2细胞增殖
显微镜下观察显示(图3A),Ad-SHOX2组、BMP9组及BMP9+Ad-SHOX2组细胞密度均高于NC组。同时,Western blot检测结果表明(图3B),BMP9+Ad-SHOX2组PCNA蛋白表达显著高于BMP9组(P<0.05)。
2.4 MAPK/EKR信号通路可能参与SHOX2对C3H10T1/2细胞成骨分化调控
Western blot检测结果(图4),与NC组相比,Ad-SHOX2组和BMP9组RUNX2蛋白水平显著上调,但BMP9+Ad-SHOX2组RUNX2蛋白表达高于BMP9组,低于Ad-SHOX2组(P<0.05)。此外,Ad-SHOX2组及BMP9+Ad-SHOX2组较NC组T-ERK1/2和p-ERK1/2蛋白表达增高(P<0.05)。
3 讨论
有报道,在软骨发育中,Ⅱ型胶原α1链驱动的Cre条件性敲除Shox2小鼠表现出早熟的软骨细胞成熟和肥大引起的股骨及肱骨缩短,其标志物RUNX2、印度刺猬蛋白、X型胶原蛋白α1链表达水平上调[5]。而过氧化物还原酶1驱动的Shox2敲除小鼠则引起软骨成熟肥大滞后,以上标志物表达水平下调,并且指出SHOX2作为RUNX2上游调控子从而调节软骨分化过程[8]。以上研究表明SHOX2与RUNX2存在一定联系。成骨分化中,RUNX2是重要的转录因子,调控成骨相关基因如骨钙素,骨桥蛋白,Ⅰ型胶原等[9]。但SHOX2对BMP9诱导的间充质干细胞成骨分化的影响尚不清楚。本文通过C3H10T1/2细胞体外试验观察到在没有外源性成骨刺激因子条件下,钙盐沉积试验表明SHOX2过表达C3H10T1/2细胞自发成骨,RUNX2蛋白表达显著上调, 且SHOX2显著促进其增殖能力。而BMP9+Ad-SHOX2组RUNX2蛋白表达低于Ad-SHOX2处理组,表明BMP9可能抑制SHOX2的功能。同时,在低感染率Ad-SHOX2与BMP9处理后,钙盐沉积明显低于BMP9组,表明SHOX2可能抑制BMP9的作用。以上提示SHOX2与BMP9对成骨分化的调控作用是否可能互为拮抗,有待进一步研究。MAPK/EKR信号通路在细胞增殖分化中具有重要作用。据报道,EKR1/2缺陷的小鼠展现出严重的肢体畸形和骨骼缺损,提示EKR1/2对骨形成具有重要作用[10]。成骨早期分化中,EKR可与RUNX2结合, 磷酸化RUNX2脯氨酸/丝氨酸/苏氨酸结构域的 Ser301和Ser319位点,提高RUNX2转录活性[11-12]。同时,在晚期分化中,EKR可激活RSK2酶,后者进一步磷酸化并激活ATF4进而促进骨基质形成[13]。本文检测MAPK/EKR信号通路关键分子EKR1/2,发现其磷酸化及总蛋白水平均显著上调。以上结果提示在C3H10T1/2细胞中,过表达SHOX2可加速其增殖及成骨分化,这一过程可能与MAPK/EKR信号通路相关。

A.SHOX2 screening PCR potential pAdTrace-TO4-SHOX2 was indicated by red arrow; B.candidate recombinant; C.Pac Ⅰ restriction endoculease digestion of candidate recombinant in lane 3(size of bands indicated by red arrows was annotated); D.transfected HEK293 cells were examined in lane 2(size of the band indicated by red arrow was annotated) under fluorescence field 5 days after transfection图1 Ad-SHOX2的构建Fig 1 Construction of Ad-SHOX2
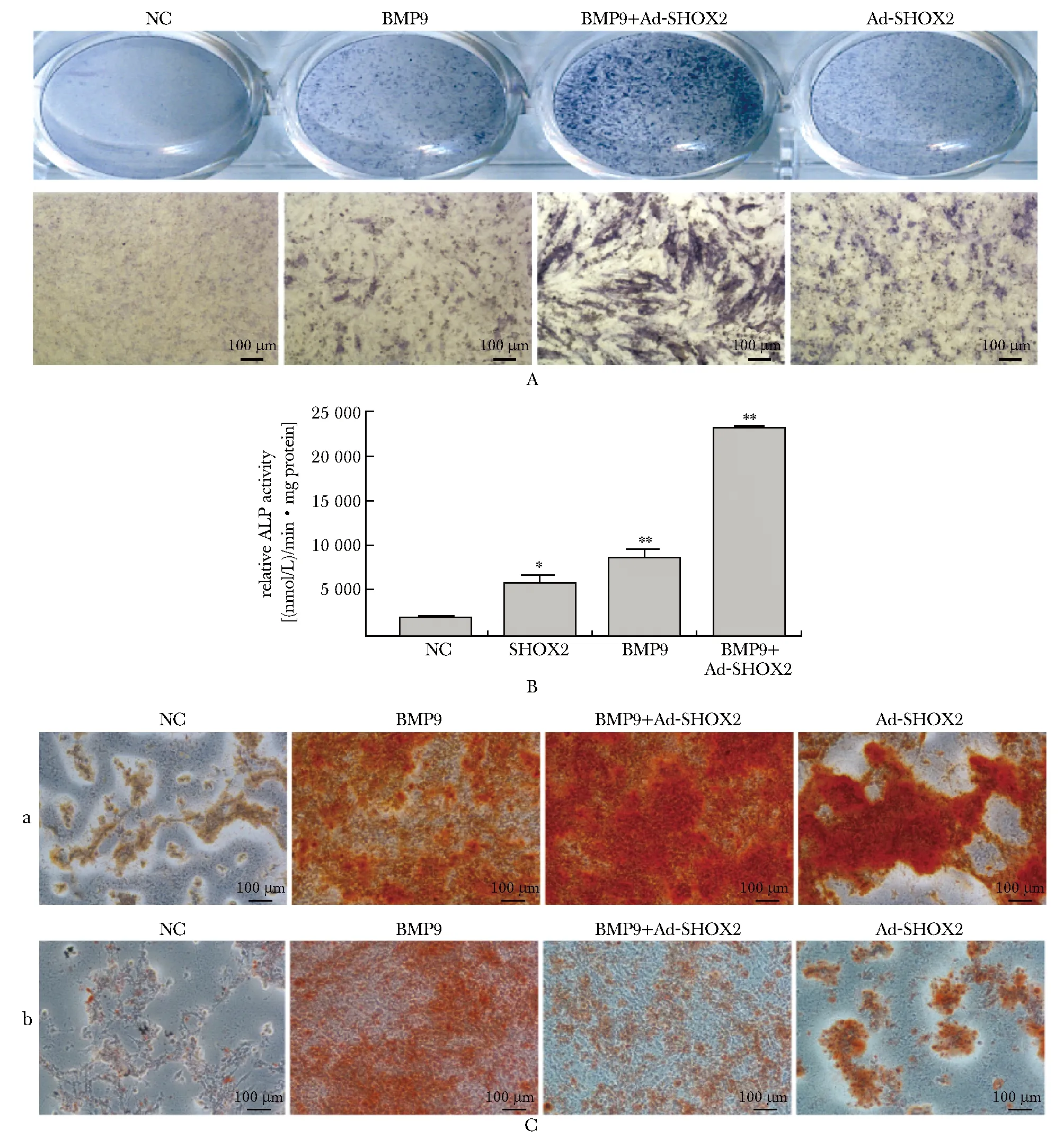
A:ALP staining asssay; B:ALP quantification assay; C:Ca2+ deposition assay, a.high infection of Ad-SHOX2, b.low infection of Ad-SHOX2; *P<0.05, **P<0.001 compared with NC group图2 SHOX2对BMP9诱导的C3H10T1/2细胞早晚期成骨分化影响Fig 2 Effects of SHOX2 on BMP9-induced early and late osteogenic differentiation in C3H10T1/2 n=3)
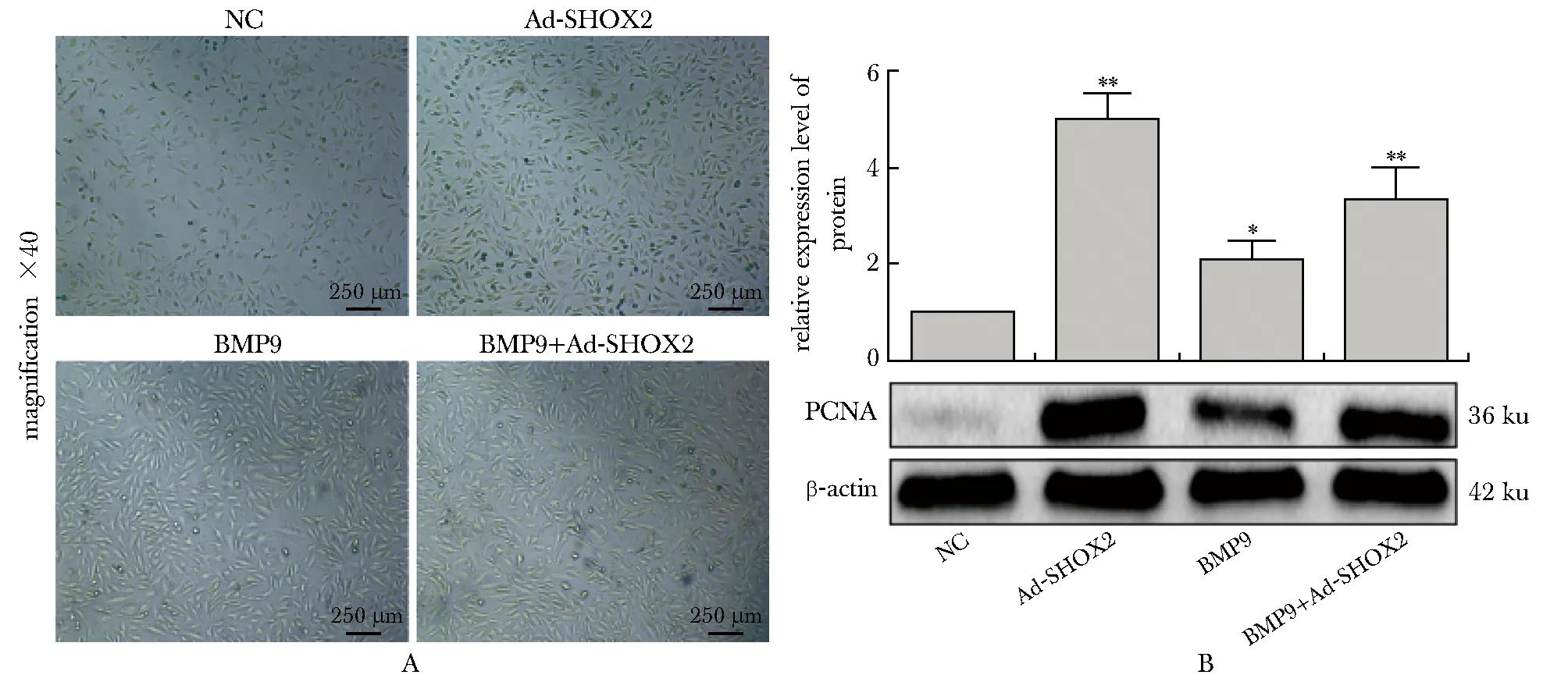
A.cell proliferation was observed using microscope(×40); B.PCNA protein expression was detected by Western blot;(scale bar=250 μm; *P<0.05, **P<0.001 compared with NC group图3 SHOX2对C3H10T1/2细胞增殖能力的影响Fig 3 Effects of SHOX2 on cell proliferation ability of C3H10T1/2 n=3)
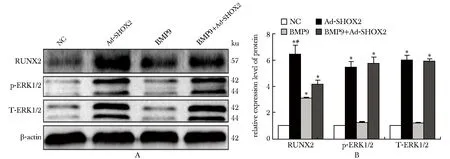
A.Western blot was used to evaluate protein expressions of RUNX2, p-ERK1/2, T-ERK1/2; B.statistical results of A; *P<0.001 compared with NC group; #P<0.001 compared with BMP9+Ad-SHOX2 group图4 SHOX2对MAPK/ERK信号通路的影响Fig 4 Effects of SHOX2 on MAPK/ERK signaling n=3)
综上所述,本研究发现在小鼠间充质干细胞C3H10T1/2中,SHOX2与BMP9对成骨分化的调控作用可能互为拮抗。而SHOX2可能通过调控RUNX2及MAPK/EKR信号通路从而促进细胞增殖及成骨分化,这为骨再生提供一定参考资料,但还需深入研究其机制。
