丛枝菌根真菌对镉胁迫下芦竹生长、光合特性和矿质营养的影响①
2021-01-11滕秋梅张中峰李红艳徐广平周龙武黄玉清
滕秋梅,张中峰*,李红艳,徐广平,周龙武,黄玉清
丛枝菌根真菌对镉胁迫下芦竹生长、光合特性和矿质营养的影响①
滕秋梅1,张中峰1*,李红艳2,徐广平1,周龙武1,黄玉清3
(1广西喀斯特植物保育与恢复生态学重点实验室,广西壮族自治区中国科学院广西植物研究所,广西桂林 541006;2长江大学园艺园林学院,湖北荆州 434025;3 南宁师范大学,南宁 530001)
为揭示丛枝菌根真菌(Arbuscular mycorrhizal fungi,AMF)对芦竹耐镉(Cd)胁迫的作用及其机理,采用大棚盆栽试验,利用丛枝菌根真菌(AMF)摩西管柄囊霉(,FM)、根内根孢囊霉(,RI)、地表球囊霉(,GV)进行接种试验,研究了在Cd胁迫下接种AMF对芦竹生长、光合特性、矿质营养的影响。结果表明:AMF能够显著改善Cd胁迫下芦竹的生长状况,与对照相比,接种处理芦竹的株高增加19.09% ~ 27.98%,叶长增加12.18% ~ 31.06%,叶绿素相对含量SPAD值增加8.55% ~ 9.36%,地上和根系生物量分别增加20.08% ~ 31.41%、12.24% ~ 24.12%,最大净光合速率增加7.08% ~ 32.12%,芦竹根系全磷含量增加30.26% ~ 46.05%。接种处理后芦竹地上Cd含量介于68 ~ 105.97 mg/kg,显著高于对照处理(42.20 mg/kg),根系Cd含量介于110.67 ~ 221.47 mg/kg,显著高于对照处理(46.47 mg/kg),且根系Cd含量显著高于地上部。Cd胁迫下不同AMF菌种对芦竹产生的效应有差异,其中,RI处理对芦竹株高、叶长促进效应最好,经GV处理的芦竹全氮、全磷、全钾含量以及Cd含量最高。Cd胁迫下接种AMF能促进芦竹的生长,增强其光合作用,提高全氮、全磷、全钾吸收量,同时增强了芦竹对Cd的吸收。该研究表明芦竹–丛枝菌根共生体对重金属Cd具有较强的固持作用,在Cd污染土壤修复中具有潜在应用价值。
丛枝菌根真菌;芦竹;镉;污染;土壤修复
随着我国工业和农业的迅速发展,土壤重金属污染越来越严重。其中镉(Cd)是生物毒性最强的重金属元素[1],被列为全球关注的重金属污染物之一[2]。具有移动性大、毒性持久、不可降解和不可逆转等特点。调查显示,全国土壤总的重金属超标率达到16.1%,耕地污染超标率达19.4%,Cd的点位超标率最大,达到7.0%[3]。目前,对Cd污染土壤进行修复已成为社会关注的热点,许多学者对此进行了大量研究。对Cd污染土壤的修复通常有直流电场与植物修复的联合修复[4],以及用生物质材料对污染土壤进行淋洗等方法进行化学修复[5],然而这些修复措施不仅修复成本较高,而且常造成土壤的二次污染。运用动物、植物、微生物等生物方法进行生物修复是目前较为环保和经济的措施[6]。丛枝菌根真菌(Arbuscular mycorrhizal fungi,AMF)是一类广泛分布于自然界的真菌,可侵染陆地生态系统90% 的高等植物根系,形成互利共生体[5]。研究表明,在重金属污染土壤中,接种AMF不仅能显著促进植物对氮、磷、钾等矿质元素的吸收,而且可以增强植物的抗逆性[5, 7]。AMF侵染植物根系后,减轻了重金属对植物体的毒害,植物在重金属污染土壤中的耐受能力显著提高[7]。接种AMF通过调节植物对重金属的吸收和转运,使重金属从土壤中高效移出,从而实现生物修复[8]。为筛选用于土壤Cd污染修复的菌根共生体,国内外学者研究了丛枝菌根真菌对Cd污染地区适生植物龙葵()、洋车前子()、黑麦草()、东南景天()、蜈蚣草()、蕹菜()等的促生和吸附效果[9-14],研究表明,这些植物接种丛枝菌根真菌促进了植物对土壤Cd的吸附作用。虽然这些植物对土壤Cd具有较强吸附性能,但是生物量小,修复速度慢。因此,筛选和研究生长速度快、生物量大、吸附性能好的植物菌根共生体对目前土壤重金属修复具有重要意义。
芦竹()别名“荻芦竹”,禾本科芦竹属,是一种多年生、丛生、常绿的植物,可生长于贫瘠土壤或受污染的地区,具有生物量大、根系发达、适应性强等特点[15]。研究表明,芦竹对重金属Cd、Hg具有较大富集量和较好的耐受性,在重金属污染较严重的地区,通过种植芦竹可吸收和积累一定种类的重金属离子,对修复土壤起到有效作用[16-17]。芦竹在修复土壤Cd污染的同时,其生长发育也受重金属影响,生物量降低,为探明Cd污染条件下芦竹菌根共生体适应性,本研究以芦竹为研究对象,采用大棚盆栽试验,接种丛枝菌根真菌和模拟土壤Cd污染环境,探讨在Cd胁迫下接种AMF对芦竹生长发育、光合特性、矿质营养,以及对Cd 吸收的影响,并从光合过程、营养水平角度研究其生理机制,以期为土壤Cd污染修复治理提供参考。
1 材料与方法
1.1 试验材料
试验所用芦竹为芦竹组培苗。供试菌种为摩西管柄囊霉(,FM)、根内根孢囊霉(,RI)、地表球囊霉(,GV),菌剂从北京市农林科学院植物营养与资源研究所购买。在人工温室内,利用高粱对菌剂分别进行扩繁培养(基质为灭菌的沸沙培养基质)4个月,培养后用于接种的菌根菌剂含有孢子、菌丝和菌根根段,其中每克菌剂中含有20 ~ 30个孢子。试验土壤采自广西植物研究所试验区红壤,过筛后去除大块石砾,用甲醛溶液灭菌 48 h,晾晒 2 周后备用。土壤pH为4.84,有机质含量 43.1 g/kg,全氮 2.1 g/kg,全磷0.54 g/kg,全钾5.15 g/kg。试验所用容器为塑料花盆( 30.5 cm × 30 cm × 25 cm) 。
1.2 试验设计
试验包括 4个接种水平和2个Cd胁迫水平(4×2),接种处理分别为摩西管柄囊霉(FM)、根内根孢囊霉(RI)、地表球囊霉(GV)和未接种(CK);Cd胁迫处理为0 mg/kg 和50 mg/kg两种水平,试验采用完全随机区组设计,每种处理4个重复,每盆种植1株芦竹苗。试验在广西植物研究所试验大棚内进行,年平均相对湿度、日照、温度分别为 73% ~ 79%、1 670 h、19.3 ℃。试验时间2016年6月至2017年7月。
将规格为30 cm × 32 cm × 27 cm 塑料花盆置于0.5% KMnO4溶液浸泡过后清洗干净,晾干,装入约1/3体积的灭菌土壤备用。接种时,称取 20 g 含有孢子( 孢子密度20 ~ 30个/g)、菌丝片段和侵染根段的菌剂平铺于灭菌土上,同时种植一株芦竹苗,然后覆盖灭菌土壤至花盆3/4处。对照处理中,将用微孔滤膜过滤的菌液和20 g高温灭菌的菌剂加入盆内,以保证除目的菌外和其他处理微生物组成一致。
对上述4种接种处理分别设置2个Cd 水平处理:0 mg/kg 和50 mg/kg,分别以-Cd和+Cd表示。将含Cd试剂(CdSO4·8H2O)配制成一定浓度溶液加入培养基质,使土壤Cd2+含量达到50 mg/kg,以无菌水作为0 mg/kg Cd2+含量处理。每个处理重复4次。
1.3 测定指标及方法
在接菌处理8个月后,用钢卷尺和游标卡尺测定芦竹株高、叶长和叶宽。收获芦竹时从茎基部将芦竹分为地上部分和根系部分,去除植物周围泥土及杂物,先用自来水冲洗干净,再用去离子水洗净后晾干,将根系部分和地上部分放入烘箱在120 ℃ 下杀青30 min,85 ℃ 下烘干至恒重后称重,计算生物量。
叶绿素相对含量的测定:采用SPAD-502叶绿素测定仪(日本Konica公司)测定相对叶绿素含量(SPAD值);在上午9:00测定,测定时选择生长良好、位置相同、中等成熟度的同龄向阳植物叶片,并避开叶片的主脉[18]。每个处理测2株,每株测定4片叶,每片叶测4个点取平均值。
植物N、P、K和Cd含量测定:将烘干的植物样用不锈钢粉碎机粉碎,用NaOH碱熔-钼锑抗比色法、H2SO4-HClO4消化-凯氏定氮法、NaOH碱熔-火焰光度法分别测定芦竹全磷、全氮、全钾含量[19]。称取0.3 g粉碎的植物样品于120 ℃ 下以“HNO3- HF”消化体系和密封高压消解罐法进行消解,利用电感耦合等离子体发射光谱仪(ICP-OES,Optima 8000,Perkin Elmer,USA) 测定消化液中 Cd 浓度并计算样品中Cd含量[20]。
光合-光响应曲线的测定:采用LI-6400xt便携式光合仪(LI-COR, USA)对芦竹进行光响应曲线测定,测量时选取叶位及长势基本一致且无病虫害的叶片,并保持叶片自然生长角度,每处理测定3株。测定时选择红蓝光源(LI-6400-02B),设定诱导光强为2 500 μmol/(m2·s),光合有效辐射梯度为2 500、2 000、1 600、1 200、800、600、400,250、150、100、50、20、10、0 μmol/(m2·s),叶温25 ℃,相对湿度70%,外界CO2浓度为380 μmol/(m2·s)。最大净光合速率、饱和光强、光补偿点、暗呼吸速率等光合指标根据直角双曲线修正模型进行拟合计算[21]。
1.4 数据处理
用Excel 2016记录和初步处理数据以及作图;SPSS 22.0统计软件对株高、叶长、叶宽、叶绿素含量、生物量、矿质营养含量(全氮、全磷、全钾)以及Cd吸收量进行方差分析;5% 水平下LSD多重比较检验各处理平均值之间的差异显著性。
2 结果与分析
2.1 丛枝菌根真菌和Cd胁迫对芦竹生长的影响
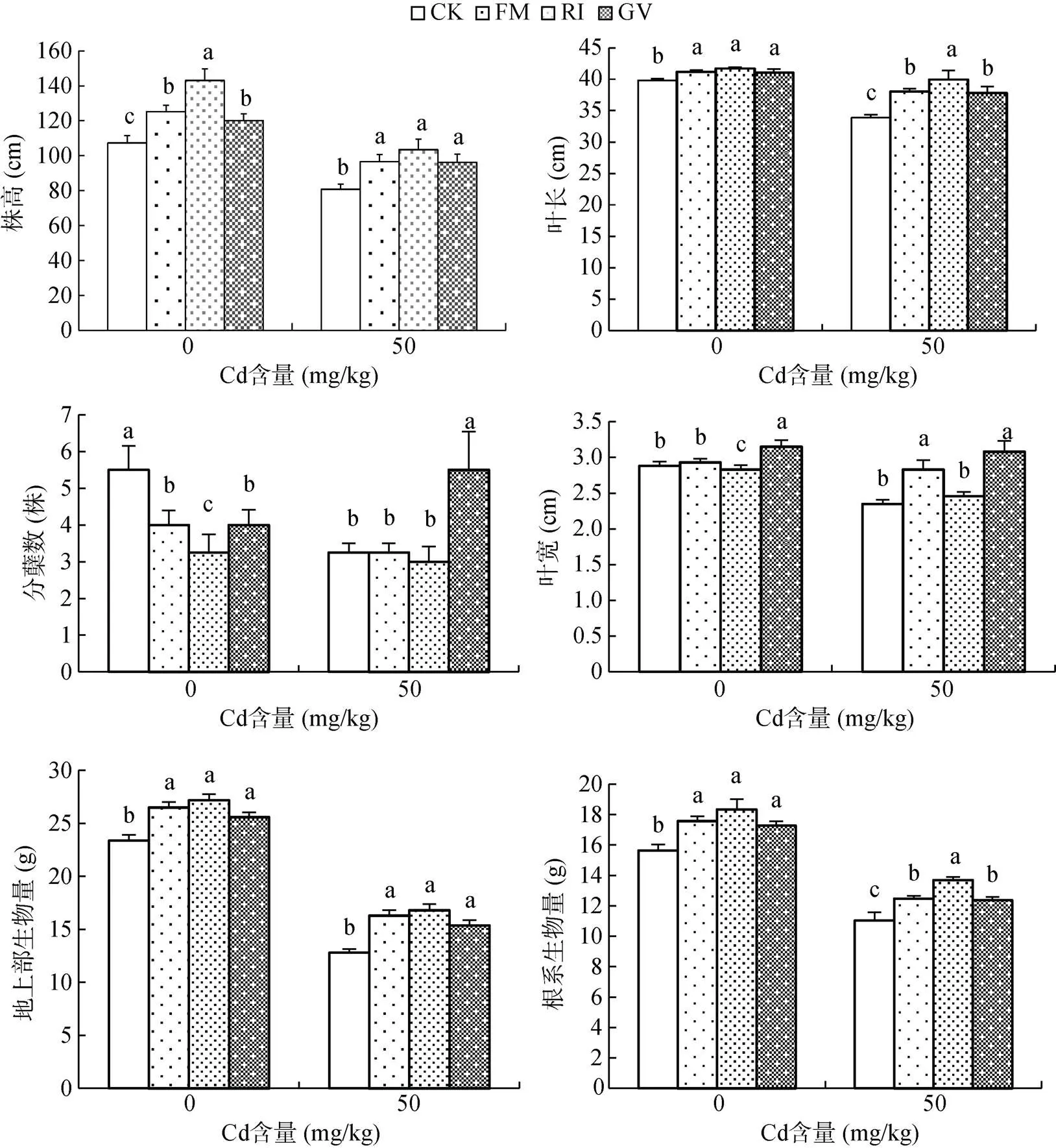
图1为AMF和Cd胁迫对芦竹株高、叶长、叶宽、分蘖数和生物量的影响。接种AMF对芦竹株高和叶长均具有显著促进作用。无论有Cd(50 mg/kg)还是无Cd(0 mg/kg)胁迫,接种处理芦竹的株高、叶长均显著高于对照处理。当无Cd胁迫时,接种处理芦竹株高升高范围介于11.95% ~ 33.29%,叶长增加范围介于3.14% ~ 4.77%;不同菌种处理株高和叶长表现不同,如RI处理与FM和GV处理间株高的差异性均显著(<0.05),叶长在RI处理下效果最好,FM处理次之。有Cd胁迫时,RI处理芦竹的株高最高,比对照处理高27.98%,GV处理最低,比对照处理高19.09%,RI、FM、GV处理间的差异性不显著;3个菌种处理叶长增加范围介于12.18% ~ 31.06%。
不同Cd含量处理下,接种AMF对芦竹的叶宽和分蘖数影响不同。当Cd含量为0 mg/kg时,仅GV处理芦竹叶宽显著高于未接种处理,RI处理显著低于未接种处理;而接种处理芦竹的分蘖数显著降低,RI处理下降幅度达到40.91%。当Cd含量为50 mg/kg时,芦竹叶宽在FM和GV处理下均显著高于未接种处理,芦竹分蘖数仅在GV处理与对照处理具有显著差异。可见,AMF对芦竹的影响因菌种和芦竹器官的不同有差异。
无Cd胁迫下,接种AMF处理芦竹地上部和根系生物量均显著高于未接种处理(<0.05)。有Cd胁迫时,各菌种处理地上部生物量与未接种处理间均具有显著差异(<0.05),升高幅度表现为RI(31.41%)> FM(27.27%)>GV(20.08%);根系生物量在3个菌种处理下均显著高于对照处理,各菌种处理间增加范围为12.24% ~ 24.12%。
2.2 丛枝菌根真菌和Cd胁迫对芦竹叶绿素含量的影响
图2为Cd胁迫下接种AMF对芦竹叶片叶绿素相对含量(SPAD值)的影响。结果显示,未添加Cd土壤接种AMF芦竹叶片SPAD值显著高于未接种处理(<0.05),表现为GV(52.98 mg/g)>RI(52.38 mg/g)> FM(52.05 mg/g)>CK(49.48 mg/g),说明接种AMF可以增加芦竹叶绿素含量。当土壤Cd含量为50 mg/kg时,无论接种与否,芦竹叶片SPAD值显著低于未添加Cd土壤;与对照处理相比,Cd胁迫下接种AMF处理叶片SPAD值均显著高于未接种处理(<0.05),不同菌种处理间表现为RI(50.40 mg/g)>FM(50.30 mg/g)> GV(50.02 mg/g)>CK(46.08 mg/g)。
(CK:未接种处理,FM:摩西管柄囊霉,RI:根内根孢囊霉,GV:地表球囊霉;图中小写字母不同表示同一Cd含量处理下不同接种处理间差异达P<0.05显著水平;下同)
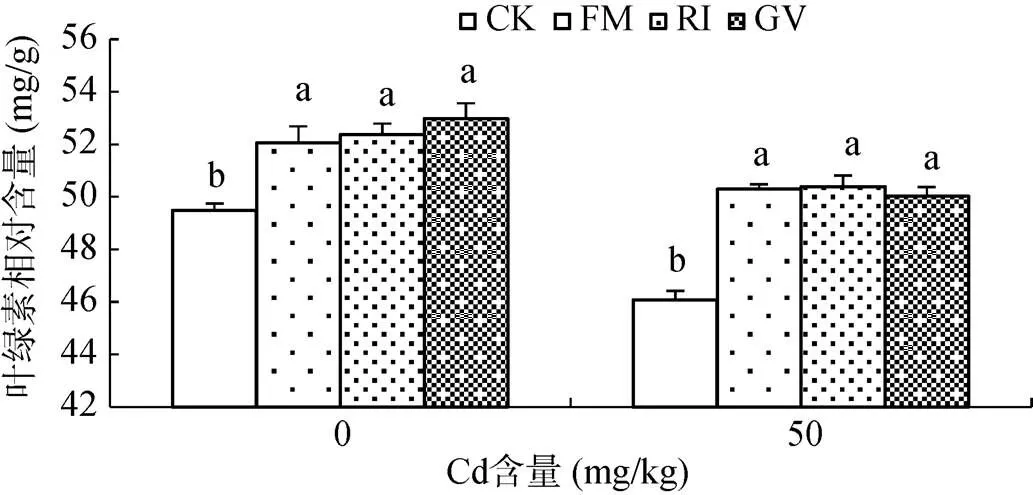
图2 丛枝菌根真菌和Cd胁迫对芦竹叶绿素相对含量的影响
2.3 丛枝菌根真菌和Cd胁迫对芦竹光合特性的影响
由表1可得,无Cd胁迫下,接种AMF处理芦竹的表观量子效率在0.042 6 ~ 0.060 0,GV处理芦竹的表观量子效率最高(0.060 0),与未接种处理相比差异显著(<0.05),RI和FM处理与未接种处理无显著差异;接种AMF处理芦竹的最大净光合速率均显著高于未接种处理(<0.05),GV、RI和FM处理比未接种处理分别增加44.96%、25.50%、17.40%;接种AMF处理芦竹暗呼吸速率与未接种处理差异不显著(>0.05);而接种AMF处理芦竹的光补偿点显著低于未接种处理,FM、RI和GV处理降低幅度分别为19%、35% 和23%。Cd胁迫条件下,接种AMF处理芦竹的表观量子效率显著高于对照处理(<0.05),3个菌种处理增加幅度范围在16.06% ~ 37.59%,其中FM处理效应最好;最大净光合速率在各菌种处理下与对照处理差异性显著(<0.05),增加幅度在7.08% ~ 32.12%,GV处理和FM、RI处理间均具有显著差异(<0.05);FM、GV处理下,芦竹的光补偿点与对照处理相比无显著差异,而暗呼吸速率显著高于对照处理(<0.05),RI处理光补偿点和暗呼吸速率均显著低于对照处理(<0.05)。

表1 AMF和Cd胁迫对芦竹光合特征参数的影响
注:表中同列小写字母不同表示同一Cd含量处理下不同接种处理间差异达<0.05显著水平。
2.4 丛枝菌根真菌和Cd胁迫对芦竹矿质营养的影响
由图3可得,无Cd胁迫下,接种AMF对芦竹全氮含量的影响无明显的规律,接种后芦竹地上部全氮含量与未接种处理相比均有所增加,增加范围在4.78% ~ 11.30%,其中RI处理与未接种处理差异显著(<0.05);与之相反,FM和RI处理芦竹根系全氮含量显著低于未接种处理,可见,根系全氮含量因菌种不同而有差异。Cd胁迫下,接种AMF芦竹地上部全氮含量高于对照处理,升高范围为6.96% ~ 25.22%,仅GV处理与对照处理具有显著差异(<0.05);各菌种处理根系全氮含量均显著高于对照处理(<0.05),升高范围在12.74% ~ 18.47%。无Cd胁迫时,接种AMF对芦竹全磷含量具有较大影响,地上部和根系全磷含量均高于未接种处理(<0.05);与未接种处理相比,接种AMF处理地上部全磷含量增加范围为4.24% ~ 23.03%,除FM外,其他接种处理芦竹地上部全磷含量与未接种处理具有显著差异;根系全磷含量仅GV处理与未接种处理有显著差异。Cd污染条件下,RI和FM处理地上部全磷含量与对照处理间均无显著差异,3个菌种处理比对照处理增加范围在8.86% ~ 28.48%;根系全磷含量接种AMF处理均显著高于对照处理,升高幅度在30.26% ~ 46.05%。
无Cd胁迫时,芦竹地上部全钾含量在RI和GV处理下与未接种处理均具有显著差异,比未接种处理分别增加8.23% 和12.35%;芦竹根系全钾含量仅GV处理高于未接种处理,其他接种处理均显著低于未接种处理。在50 mg/kg Cd含量处理下,RI和GV处理地上部和根系全钾含量均高于对照处理,而FM处理根系全钾含量显著降低。
总的来看,3个菌种处理中GV处理对芦竹全氮、全磷、全钾含量产生的效应最好,均显著高于对照处理。Cd胁迫下接种AMF芦竹地上部全氮、全磷、全钾含量均显著高于根系部分。
2.5 Cd胁迫下接种丛枝菌根真菌对芦竹Cd含量的影响
从图4可得,接种AMF后,芦竹地上、根系Cd含量与对照处理相比均具有显著差异(<0.05),地上部分表现为FM (105.97 mg/kg)>GV(71.28 mg/kg)> RI(68 .00 mg/kg)>CK(42.20 mg/kg);根系表现为GV (221.47 mg/kg)>FM(113.07 mg/kg)>RI(110.67 mg/kg)> CK(46.47 mg/kg),GV、FM、RI处理分别比CK处理高376.59%、143.32% 和138.15%;且接种处理芦竹根系Cd含量远高于地上部分。可见,接种AMF后芦竹对土壤Cd的吸收和固持能力均较强。
3 讨论
自然土壤中的Cd 主要来源于成土母质,全世界土壤中Cd 含量的范围为0.010 ~ 2.000 mg/kg,中值为0.35 mg/kg。由于我国不同区域地球化学条件差异显著,在我国各区域土壤中Cd 背景值差异较大,范围为0.001 ~ 13.400 mg/kg,中值为0.079 mg/kg[22]。据吴燕玉等[23]研究讨论以及现行的标准GB 15618—1995《土壤环境质量标准》规定:当土壤Cd 含量>0.3 mg/kg时,可用于宏观判断土壤是否污染以及监测农牧业用地;当土壤Cd含量>0.5 mg/kg(警戒值),开始对土壤生态环境产生影响;当土壤Cd含量≥1.00 mg/kg,已严重影响其生态系统,此值为环境标准的上限值。本研究所选择的Cd 含量为50 mg/kg,远远大于三级标准限量值(1.00 mg/kg),理论上对植物具有毒害作用。然而,有研究表明,低含量的Cd可促进植物的生长发育,高含量则会抑制植株的正常生长。刘大林等[24]的研究得出,Cd 含量为0 ~ 50 mg/kg时,早熟禾幼苗的各项指标均应激达到最大值,随后开始下降。曹德菊等[25]的研究表明,Cd 含量介于50 ~ 200 mg/kg时,苎麻长势较好,当含量达到 300 mg/kg 时植株出现毒害现象。蒋先军等[26]的研究表明,Cd 对印度芥菜的毒害作用因其生长期不同有差异,如幼苗期与营养生长前期是在Cd含量70 ~ 110 mg/kg 左右,成熟期是在150 mg/kg 左右。Papazoglou等[27]的研究表明,芦竹可在 Cd含量为100 mg/kg 的污染土壤中正常生长,且植株鲜重、干重、株高均与对照无显著差异。本研究中,在Cd含量为50 mg/kg时,芦竹的生物量、叶长和叶宽等虽小于未添加 Cd 土壤,但芦竹仍能正常生长、因此,Cd 含量为50 mg/kg时,对环境所产生的影响因植物不同有所不同。另外,本研究所设置的Cd含量(50 mg/kg),也是根据当地(桂林市阳朔县)铅锌矿污染区土壤Cd污染水平设计,当地土壤Cd污染在20 ~ 50 mg/kg,所以设置50 mg/kg的污染水平,使试验更符合实际情况,以便为治理当地Cd污染提供科学依据。

图3 AMF和Cd胁迫对芦竹矿质营养的影响

图4 Cd胁迫下接种AMF对芦竹Cd含量的影响
研究表明,AMF能够显著促进寄主植物的营养生长,有助于增加植物叶片叶绿素含量,显著提高植物株高、根系和地上部的生物量,促进植株的生长和发育[28-29]。本研究中芦竹接种AMF后,芦竹株高、叶长、地上和根系生物量均显著提高,表明接种AMF对芦竹生长发育具有显著促进作用。AMF侵染芦竹根系后,导致芦竹体内生长素、细胞分裂素、赤霉素等内源激素含量发生变化[30],改善了芦竹的营养生长。据报道,AMF物种丰富,已分离鉴定报道有200多种,AMF侵染植株产生的效应因菌种不同而有差异,导致这一现象的原因有两方面,一是因为菌种本身的生物学特性或者菌种与宿主植物之间的亲和性不一致,也可能与土壤环境、植株本身的生理生化特征不同有关[31]。本研究中,对于株高、叶长、地上部和根系生物量,各接种处理均起到了促进作用,菌种(FM、RI、GV)间效应为 RI最好,FM次之,说明AMF改善植物生长因菌种不同表现不一,同时反映了不同AMF菌种功能的多样性[32]。然而,同一菌种对同种植物不同器官的影响也不尽相同。本研究中,无Cd胁迫下,FM、RI、GV处理的分蘖数显著低于未接种处理,原因可能是主导分蘖数的基因(MOC1)在起作用,MOC1突变后,导致芦竹分蘖数减少[33];也可能是芦竹在接种处理后,在某种生长调节机制的作用下,光合作用制造的有机物和从根部吸收的矿质营养分配给分蘖的量不足以使其分蘖数增加[34],或是光、温度、土壤、水分、植物的密度、矿质营养、植物生长激素等因素的互作对分蘖的复杂特性产生影响[35],导致芦竹的分蘖数低于对照处理。当植物组织中Cd含量达到1.00 mg/kg时,植物就会出现不良反应,使植物表现出叶色减褪、植物矮化、物候期延迟等症状[36]。Cd含量越多,胁迫效应越明显,而接种AMF能显著改善植物的生长状况,这是由于AMF侵染植物根系后,AMF菌丝通过根的皮层细胞获取植物提供的碳源,同时将矿质营养和水从土壤转运到皮层细胞,从而增强植物抗逆性、增加植物生物量;其次是土壤中的根外菌丝增加植物根部与土壤直接的接触面积,从而促进根部对重金属的吸收和固定[6]。本研究中,在50 mg/kg的Cd胁迫下接种AMF菌剂,芦竹的株高、叶长、叶宽、分蘖数、地上以及根系生物量显著高于对照处理。由此可进一步说明在Cd胁迫下接种AMF能促进芦竹的生长,这与李明亮等[28]、田野等[11]的研究结果一致。
光合作用可以为植物生存提供有机物、能量和氧气,是植物赖以生长和生物量递增所需的生理过程。研究证明,Cd是一种有效的光合抑制剂,可以增强植物体内叶绿素酶的活性,导致分解叶绿素的速度加快,从而使叶绿素含量低于正常值[37]。Cd胁迫下AMF对植物光合特性的影响已有报道,一般而言,接种AMF可以提高宿主植物的光合作用。叶绿素是高等植物和其他所有能进行光合作用的生物体含有的一类绿色色素,是叶片进行光合作用时捕获光能的一种关键物质。其含量的高低在某种程度上体现出植株光合作用的能力。研究表明,植株叶片叶绿素相对含量(SPAD)和叶片叶绿素含量有良好的一致性,可以间接反映叶片叶绿素的含量[38]。本研究中,Cd胁迫下接种AMF可以显著提高叶绿素SPAD值,进一步说明AMF侵染芦竹可以提高叶片叶绿素含量,进而促进光合速率。表观量子效率是弱光阶段的光响应曲线的斜率,反映了植物光能利用情况,特别是对弱光的利用能力[39]。本研究中,芦竹的正常(未接种处理)表观量子效率为0.041 0,处于自然条件下一般植物的表观量子效率值(0.03 ~ 0.05)[40];接种AMF后的值在0.042 6 ~ 0.060 0,略高于自然条件下的值;Cd胁迫下接种AMF后表观量子效率的范围在0.031 8 ~ 0.037 7,对照处理值为0.027 4。可见,Cd胁迫下芦竹的表观量子效率有所下降,接种AMF后有所提高,表明菌根真菌的添加,提高了植物对弱光的利用效率,利于芦竹在弱光下存活。最大净光合速率和饱和光强是反映植物在强光下对光能的利用效率。本研究中,Cd胁迫下接种AMF,最大净光合速率和饱和光强显著高于对照处理,说明在强光下AMF对芦竹起到一定的保护作用。无论接种AMF与否,Cd胁迫下芦竹的光合作用明显弱于非Cd胁迫,由此可见,Cd对植物光合作用表现出抑制现象。张晓松等[41]、李明亮等[28]、田野等[11]人的研究表明,Cd胁迫下接种菌根真菌可以明显改善植物叶片的气孔限制,增加其蒸腾速率和最大净光合速率。通过本研究进一步证明了接种AMF可以缓解Cd对植株光合的抑制作用。Cd胁迫下接种AMF对芦竹光补偿点和暗呼吸速率的影响有差别,这可能与AMF对光能的利用率、植物的呼吸作用或植物叶龄有关,也可能是植物适应Cd胁迫的一种自我保护机制。
大量研究已证实,AMF与植物形成共生体后,能显著提高宿主植物吸收矿质元素的能力,特别是促进磷元素的吸收[42]。本研究中,接种 AMF后,各接种处理植株地上部和地下部全磷含量均高于未接种处理,说明接种AMF后可提高磷元素的吸收量,其一可能是因为接种AMF后,AMF分泌的有机酸和磷酸酶活化了土壤中的难溶性磷,从而使土壤中的有效磷含量增加;其二可能是菌根的形成扩大了芦竹根系的吸收范围,从而使磷的吸收量有所提高。此结果与李明亮等[28]、张中峰等[30]和Liu等[9]的研究结果相似。菌根的功能不仅是促进养分的吸收,也可能会通过一定的机制调节养分在植物体内的分配比例,调节作用可能会因菌种的不同而不同,如FM处理根系的全氮、全钾含量均低于未接种处理,此结果与贺学礼等[42]的研究结果相似,但与张中峰等[30]、宋福强等[7]和Grunwald等[43]不完全相同。Cd是植物生长的非必需元素,当其在植物体内累积到一定程度,会与营养元素竞争植物根系吸收部位,干扰植物对养分的吸收等[44]。本研究中,Cd胁迫下全磷、全氮、全钾显著低于无Cd胁迫;除FM处理全钾含量低于对照外,接种AMF后,芦竹地上部和根系全磷、全氮、全钾含量均显著高于对照处理,表明接种AMF能帮助芦竹降低重金属Cd对养分吸收的干扰。重金属污染条件下,由于应对环境胁迫的需要,AMF能更多地促进植物吸收生存所需的矿质元素,改善宿主植物矿质营养状况,提高营养元素与重金属元素含量之比,所以接种AMF被认为有助于增强宿主植物耐受重金属的能力,提高植物对重金属的累积量[8]。
研究表明,AMF能够以其庞大的菌丝体网络和丛枝状结构,通过螯合作用、过滤机制、固持作用等吸附固持重金属,将相当一部分重金属滞留于菌根真菌体内,抑制过量的重金属向植物根系细胞转移,从而减少重金属向植物地上部分的运输和分配,降低其对植物组织的伤害,利于植物在重金属污染地生存;也有研究发现,在重金属污染条件下给芦竹接种AMF不会减少植物对重金属的吸收,但能在一定程度上提高宿主植物对重金属的耐受性,利于植株存活;还有一部分研究得出,在重金属污染下AMF侵染植物对植株的生长发育以及对重金属的吸收没有显著促进作用[6]。刘灵芝等[45]以玉米为研究对象,得出在高浓度Cd处理下接种AMF,显著提高了玉米根系的Cd浓度和吸收量,而地上部分的Cd浓度和吸收量有所下降。黄晶等[46]的研究表明,接种AMF后增加了紫花苜蓿地下部分的Cd含量和积累量,而地上部分Cd含量和积累量表现出降低的现象。与这些结果不同的是,本研究表明,Cd胁迫下,接种AMF能够同时促进芦竹地上部和根系对Cd的吸收,并且芦竹根系部分Cd含量远高于地上部。这些结果说明接种AMF可以增强芦竹对重金属Cd的固持作用。
根据Brooks等[47]和Baker等[48]提出的衡量植物是否为超富集植物的标准,植物叶片或地上部(干重)中含Cd 达到 100 mg/kg,同时满足转运系数 >1 的条件,即植物地上部分重金属含量大于地下部分的含量(一般植物的转运系数≤1)。本研究中芦竹地上部和根系对Cd 的吸收量范围分别为68.00 ~ 105.97 mg/kg、110.67 ~ 221.47 mg/kg,转运系数<1,表明芦竹并未达到Cd 超富集植物要求,但其对Cd 的累积能力较普通植物还是比较有潜力,作为重金属污染的生物修复仍具有较好的开发前景。
4 结论
近年来,土壤重金属污染日益严重,菌根技术作为新型的修复手段已被广泛应用。本文通过在Cd胁迫下对芦竹接种AMF,研究了在Cd胁迫下接种 AMF 对芦竹生长发育、光合特性、矿质营养,以及对 Cd 吸收的影响。接种处理芦竹的株高、叶长的升高范围分别介于11.95% ~ 33.29% 和 3.14% ~ 4.77%,均显著高于对照处理;在Cd胁迫下对芦竹进行接种处理,叶片 SPAD 值、地上部和根系生物量、最大净光合速率、根系全磷含量等均显著高于未接种处理;接种 AMF 后,芦竹地上部分Cd 含量范围为68.00 ~ 105.97 mg/kg,根系 Cd 含量范围为110.67 ~ 221.47 mg/kg,与对照处理相比均具有显著差异。可见,接种处理芦竹根系Cd远高于地上部分,且接种 AMF 后芦竹对土壤 Cd 的吸收和固持能力均较强,证明接种AMF能有效缓解Cd对芦竹的毒害作用,促进芦竹的正常生长,提高了芦竹的矿质营养含量,保障了芦竹的光合作用,并且能促进对重金属Cd的固持作用。该研究进一步证明,利用AMF自身特性与芦竹结合对土壤Cd污染进行联合修复具有潜在的应用价值。
[1] Moreno-Caselles J, Moral R, Pérez-Espinosa A, et al. Cadmium accumulation and distribution in cucumber plant[J]. Journal of Plant Nutrition, 2000, 23(2): 243–250.
[2] 章海波, 骆永明, 李远, 等. 中国土壤环境质量标准中重金属指标的筛选研究[J]. 土壤学报, 2014, 51(3): 429– 438.
[3] 陈良华, 赖娟, 胡相伟, 等. 接种丛枝菌根真菌对受镉胁迫美洲黑杨雌、雄株光合生理的影响[J]. 植物生态学报, 2017, 41(4): 480–488.
[4] 肖文丹, 叶雪珠, 徐海舟, 等. 直流电场与添加剂强化东南景天修复镉污染土壤[J]. 土壤学报, 2017, 54(4): 927–937.
[5] 余春瑰, 张世熔, 姚苹, 等. 四种生物质材料水浸提液淋洗镉污染土壤及其废水处理研究[J]. 土壤, 2015, 47(6): 1132–1138.
[6] 罗巧玉, 王晓娟, 林双双, 等. AM真菌对重金属污染土壤生物修复的应用与机理[J]. 生态学报, 2013, 33(13): 3898–3906.
[7] 宋福强, 王立, 马放. 丛枝菌根真菌-紫穗槐共生体系的研究[M]. 北京: 科学出版社, 2013.
[8] 陈保冬, 于萌, 郝志鹏, 等. 丛枝菌根真菌应用技术研究进展[J]. 应用生态学报, 2019, 30(3): 1035–1046.
[9] Liu H, Yuan M, Tan S Y, et al. Enhancement of arbuscular mycorrhizal fungus (Glomus versiforme) on the growth and Cd uptake by Cd-hyperaccumulator Solanum nigrum[J]. Applied Soil Ecology, 2015, 89: 44–49.
[10] Haneef I, Faizan S, Perveen R, et al. Impact of bio-fertilizers and different levels of cadmium on the growth, biochemical contents and lipid peroxidation of Plantago ovata Forsk[J]. Saudi Journal of Biological Sciences, 2014, 21(4): 305–310.
[11] 田野, 张会慧, 孟祥英, 等. 镉(Cd)污染土壤接种丛枝菌根真菌(Glomus mosseae)对黑麦草生长和光合的影响[J]. 草地学报, 2013, 21(1): 135–141.
[12] Hu J L, Chan P T, Wu F Y, et al. Arbuscular mycorrhizal fungi induce differential Cd and P acquisition by Alfred stonecrop (Sedum alfredii Hance) and upland Kangkong (Ipomoea aquatica Forsk.) in an intercropping system[J]. Applied Soil Ecology, 2013, 63: 29–35.
[13] Leung H M, Leung A O W, Ye Z H, et al. Mixed arbuscular mycorrhizal (AM) fungal application to improve growth and arsenic accumulation of Pteris vittata (As hyperaccumulator) grown in As-contaminated soil[J]. Chemosphere, 2013, 92(10): 1367–1374.
[14] Bhaduri A M, Fulekar M H. Assessment of arbuscular mycorrhizal fungi on the phytoremediation potential of Ipomoea aquatica on cadmium uptake[J]. 3 Biotech, 2012, 2(3): 193–198.
[15] 韩志萍, 胡晓斌, 胡正海. 芦竹修复镉汞污染湿地的研究[J]. 应用生态学报, 2005, 16(5): 945–950.
[16] 韩志萍, 胡正海. 芦竹对不同重金属耐性的研究[J]. 应用生态学报, 2005, 16(1): 161–165.
[17] 朱志国, 周守标. 铜锌复合胁迫对芦竹生理生化特性、重金属富集和土壤酶活性的影响[J]. 水土保持学报, 2014, 28(1): 276–280, 288.
[18] 李昌明, 周艳丽, 龙光强, 等. 镉污染水稻土中水稻氮素营养的SPAD诊断[J]. 土壤, 2017, 49(5): 941–950.
[19] 李泽, 谭晓风, 卢锟, 等. 干旱胁迫对两种油桐幼苗生长、气体交换及叶绿素荧光参数的影响[J]. 生态学报, 2017, 37(5): 1515–1524.
[20] 卢鑫,胡文友,黄标,等. 丛枝菌根真菌对玉米和续断菊间作镉吸收和累积的影响[J]. 土壤, 2017, 49(11): 111–117.
[21] 张中峰, 尤业明, 黄玉清, 等. 模拟岩溶水分供应分层的干旱胁迫对青冈栎光合特性和生长的影响[J]. 生态学杂志, 2012, 31(9): 2197–2202.
[22] 魏复盛, 陈静生, 吴燕玉, 等. 中国土壤环境背景值研究[J]. 环境科学, 1991, 12(4): 12–19, 94.
[23] 吴燕玉, 周启星, 田均良. 制定我国土壤环境标准(汞、镉、铅和砷)的探讨[J]. 应用生态学报, 1991, 2(4): 344–349.
[24] 刘大林, 杨俊俏, 王奎, 等. 土壤镉铅污染对草地早熟禾幼苗生长的影响[J]. 中国草地学报, 2014, 36(5): 113– 118.
[25] 曹德菊, 周世杯, 项剑. 苎麻对土壤中镉的耐受和积累效应研究[J]. 中国麻业, 2004(6): 272–274.
[26] 蒋先军, 骆永明, 赵其国. 镉污染土壤的植物修复及其EDTA调控研究 I.镉对富集植物印度芥菜的毒性[J]. 土壤, 2001, 33(4): 197–201.
[27] Papazoglou E G. Arundo donax L. stress tolerance under irrigation with heavy metal aqueous solutions[J]. Desalination, 2007, 211(1/2/3): 304–313.
[28] 李明亮, 李欢, 王凯荣, 等. Cd胁迫下丛枝菌根对花生生长、光合生理及Cd吸收的影响[J]. 环境化学, 2016, 35(11): 2344–2352.
[29] 贺学礼, 高露, 赵丽莉. 水分胁迫下丛枝菌根AM真菌对民勤绢蒿生长与抗旱性的影响[J]. 生态学报, 2011, 31(4): 1029–1037.
[30] 张中峰, 张金池, 黄玉清, 等. 接种菌根真菌对青冈栎幼苗耐旱性的影响[J]. 生态学报, 2016, 36(11): 3402– 3410.
[31] 向丹, 徐天乐, 李欢, 等. 丛枝菌根真菌的生态分布及其影响因子研究进展[J]. 生态学报, 2017, 37(11): 3597– 3606.
[32] 彭思利, 申鸿, 张宇亭, 等. 不同丛枝菌根真菌侵染对土壤结构的影响[J]. 生态学报, 2012, 32(3): 863–870.
[33] Zhou F, Lin Q B, Zhu L H, et al. D14–SCF D3 -dependent degradation of D53 regulates strigolactone signalling[J]. Nature, 2013, 504(7480): 406.
[34] 王凯荣, 周建林, 龚惠群. 土壤镉污染对苎麻的生长毒害效应[J]. 应用生态学报, 2000, 11(5): 773–776.
[35] 张荣华, 桂意云, 韦金菊, 等. 作物分蘖特性研究进展[J]. 园艺与种苗, 2017, 37(7): 71–75.
[36] Seregin I V, Ivanov V B. Physiological aspects of cadmium and lead toxic effects on higher plants[J]. Russian Journal of Plant Physiology, 2001, 48(4): 523–544.
[37] VAN ASSCHE F, Clijsters H. Effects of metals on enzyme activity in plants[J]. Plant, Cell & Environment, 1990, 13(3): 195–206.
[38] 杨虎, 戈长水, 应武, 等. 遮荫对水稻冠层叶片SPAD值及光合、形态特性参数的影响[J]. 植物营养与肥料学报, 2014, 20(3): 580–587.
[39] 蹇洪英, 邹寿青. 地毯草的光合特性研究[J]. 广西植物, 2003, 23(2): 181–184.
[40] 邱国雄. 植物光合作用的效率[M]. 北京: 科学出版社, 1992.
[41] 张晓松, 孟祥英, 王薇, 等. 丛枝菌根真菌对镉污染土壤中黑麦草幼苗生长的影响[J]. 中国土壤与肥料, 2015(6): 122–127.
[42] 贺学礼, 马丽, 孟静静, 等. 不同水肥条件下AM真菌对丹参幼苗生长和营养成分的影响[J]. 生态学报, 2012, 32(18): 5721–5728.
[43] Grunwald U, Guo W B, Fischer K, et al. Overlapping expression patterns and differential transcript levels of phosphate transporter genes in arbuscular mycorrhizal, Pi-fertilised and phytohormone-treated Medicago truncatula roots[J]. Planta, 2009, 229(5): 1023–1034.
[44] 李婧, 周艳文, 陈森, 等. 我国土壤镉污染现状、危害及其治理方法综述[J]. 安徽农学通报, 2015, 21(24): 104– 107.
[45] 刘灵芝, 张玉龙, 李培军, 等. 丛枝菌根真菌(Glomus mosseae)对玉米吸镉的影响[J]. 土壤通报, 2011, 42(3): 568–572.
[46] 黄晶, 凌婉婷, 孙艳娣, 等. 丛枝菌根真菌对紫花苜蓿吸收土壤中镉和锌的影响[J]. 农业环境科学学报, 2012, 31(1): 99–105.
[47] Brooks R R, Lee J, Reeves R D, et al. Detection of nickeliferous rocks by analysis of herbarium specimens of indicator plants[J]. Journal of Geochemical Exploration, 1977, 7: 49–57.
[48] Baker A J M, Brooks R R, Pease A J, et al. Studies on copper and cobalt tolerance in three closely related taxa within the Genus Silene L. (Caryophyllaceae) from Zaïre[J]. Plant and Soil, 1983, 73(3): 377–385.
Effects of Arbuscular Mycorrhizal Fungi on Growth, Photosynthesis Characteristics and Mineral Nutrition ofUnder Cd Stress
TENG Qiumei1, ZHANG Zhongfeng1*, LI Hongyan2, XU Guangping1, ZHOU Longwu1, HUANG Yuqing3
(1 Guangxi Key Laboratory of Plant Conservation and Restoration Ecology in Karst Terrain, Guangxi Institute of Botany, Guangxi Zhuangzu Autonomous Region and Chinese Academy of Sciences, Guilin, Guangxi 541006, China; 2 College of Horticulture and Gardening, Yangtze University, Jinzhou, Hubei 434025, China; 3 Nanning Normal University, Nanning 530001, China)
A greenhouse pot experiment was conducted using(FM),(RI), and(GV) of arbuscular mycorrhizal fungi (AMF) to reveal the effect and mechanism of AMF inoculation on Cd stress tolerant of. The results showed that under Cd stress, AMF inoculation significantly improved the plant growth, compared with the control, plant height increased by 19.09% - 27.98%, leaf length increased by 12.18% - 31.06%, chlorophyll content SPAD value increased by 8.55% - 9.36%, biomass of aboveground and belowground increased by 20.08% - 31.41% and 12.24% - 24.12%, maximum net photosynthetic rate increased by 7.08% - 32.12%, and P content in roots increased by 30.26% - 46.05%. After AMF inoculation, Cd content inwas between 68 - 105.97 mg/kg, significantly higher than that of the control (42.20 mg/kg). Cd content in roots ranged from 110.67 to 221.47 mg/kg, significantly higher than the control (46.47 mg/kg). The effects of different AMF strains on plant under Cd stress were different, for example, RI treatment had the best effect on plant height and leaf length, while total N, total P, total K and Cd contents were the highest under GV treatment. This study showed that AMF inoculation under Cd stress can promote the plant growth, enhance plant photosynthesis, increase the absorption of N and P and K, and enhance plant absorption to Cd. The-arbuscular mycorrhizal symbiont has a potential application in remediating Cd contaminated soil.
Arbuscular mycorrhizal fungi;; Cd; Pollution; Soil remediation
S154.4; Q945.79
A
10.13758/j.cnki.tr.2020.06.016
滕秋梅, 张中峰, 李红艳, 等. 丛枝菌根真菌对镉胁迫下芦竹生长、光合特性和矿质营养的影响. 土壤, 2020, 52(6): 1212–1221.
国家自然科学基金项目(31960272,41603079,31760162)、广西重点研发计划项目(桂科AB18126065)和广西科技公关计划项目(桂科攻1598016-12)资助。
(78228546@qq.com)
滕秋梅(1991—),女,广西灵山人,硕士,研究实习员,主要从事森林生态与土壤修复研究。E-mail: 1037014105@qq.com
