高耐铝红酵母RS1的红外光谱和拉曼光谱研究①
2021-01-11沈仁芳
程 思,王 超,沈仁芳*
高耐铝红酵母RS1的红外光谱和拉曼光谱研究①
程 思1,2,王 超1,沈仁芳1,2*
(1土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所),南京 210008;2中国科学院大学,北京 100049)
微生物菌株RS1是从江西鹰潭油茶酸性土壤中筛选获得的一株高耐铝红酵母,能够忍耐高达200 mmol/L以上的铝浓度。前期研究表明RS1可以把铝固定在细胞表面,阻挡其进入细胞内部,但是细胞表面何种基团参与铝的固定并不清楚。本文综合采用傅里叶红外光谱和拉曼光谱技术研究了铝胁迫下红酵母RS1细胞表面官能团变化,以期从光谱学角度来探索RS1的高耐铝机制。研究发现,70 mmol/L铝处理24 h后RS1红外光谱中1 403 cm–1处的吸收峰红移到1 397 cm–1处,这可能是羧基峰;在1 706 cm–1处出现新的吸收峰,这可能是羰基峰;酰胺I带吸收峰强度显著上升,且甘露聚糖的吸收峰消失。拉曼光谱在779、856 cm–1处和1 270 cm–1处出现新的吸收峰,可能分别为核糖核酸、酪氨酸和酰胺Ш带的吸收峰。综合结果表明,RS1细胞表面与铝吸附相关的物质主要是细胞壁多糖和蛋白质,主要涉及的官能团包括羧基、羰基和酰胺基。这些细胞表面官能团对铝的固定作用可能是红酵母RS1高耐铝的一个重要机制。
红酵母;铝毒;傅里叶红外光谱;拉曼光谱
全球酸性土壤面积约为39.5×108hm2,占可耕地土壤面积的40% 左右[1]。我国酸性土壤主要分布在南方各省,在热带和亚热带地区土壤酸化问题尤为严重,酸性土壤总面积约为218 km2,约占我国陆地面积的22.7%,而且面积不断在扩大[2]。当土壤pH<5时,土壤中的铝会从固相释放进入土壤溶液或以交换性铝吸附于土壤表面的阳离子交换位上,使土壤铝活性增加,进而产生毒害[3]。铝毒被认为是酸性土壤生物生长的主要限制因子之一[4]。植物忍耐铝的浓度一般小于0.1 mmol/L。近年来,一些土壤高耐铝微生物被发现,它们能够在几十甚至几百毫摩尔的铝浓度下生长[5-9]。这些微生物菌株对铝的忍耐程度远大于植物,其中必然存在有别于植物的耐铝机制。由于微生物具有生长快、周期短、易变异等优点[10],因此可以作为研究生物高耐铝机制的良好试验材料。对其高耐铝机制的阐明一方面可很好地补充生物的耐铝机制,另一方面有助于酸性土壤生产力及生态系统的维持,改善生态环境[11]。
本实验室前期从江西鹰潭油茶土壤中筛选获得一株高耐铝红酵母RS1,在200 mmol/L的铝浓度中仍可以生长[12]。前期研究表明,RS1可有效阻挡胞外高浓度铝进入细胞内部,与细胞壁表面含有较少负电荷和结构修饰密切相关[13]。细胞壁表面较少的负电荷可降低铝在细胞表面的吸附能力,进而减少铝进入细胞内部的机会,降低毒害作用。酵母细胞壁主要由β-葡聚糖、甘露聚糖、蛋白质,以及少量几丁质组成[14]。这些细胞壁表面结构存在多种官能团,通过去质子化作用,使得菌体带负电[15],带负电的官能团可以参与对铝的吸附固定。但是,何种官能团的存在或含量差异使得RS1细胞壁表面具有较少的负电荷尚不清楚。
光谱检测技术是一种确定官能团存在和化合物类别的技术手段,常见的光谱检测技术包括红外光谱和拉曼光谱。这两种光谱技术均为测量分子振动光谱的方法,但机理不同且能相互补充[16],结合采用两种技术能更全面地研究分子振动状态,提供更多分子结构信息。红外光谱技术已广泛用于研究酵母对金属离子的吸附试验中[17-18],而拉曼光谱技术多用于对酵母发酵、凋亡等生理过程中生物大分子变化情况进行监测。孙素琴等[19]运用这两种光谱技术对中药材真伪进行鉴别,发现拉曼光谱可提供对红外光谱表现弱吸收或无吸收的官能团信息;黄皓等[20]运用红外和拉曼光谱技术研究发现,酿酒酵母细胞表面的羟基、羧基参与铅和镉的吸附过程。可见,综合运用这两种技术能够对分子结构有更加完整的分析。
在本实验室前期研究的基础上,本文综合利用红外和拉曼光谱技术以探究红酵母RS1高耐铝过程中,细胞表面官能团及相应生物大分子的光谱信息变化,期望对酵母铝吸附基团具有更加全面准确的认识,以进一步探索红酵母RS1的高耐铝机制。
1 材料与方法
1.1 主要仪器和试剂
ZWY-2102C恒温培养振荡器,上海智城分析仪器制造公司;D-8PC分光光度计,南京菲勒仪器有限公司;HVE-50灭菌锅,日本株式会社平山制作所;SIGMA 4-16K离心机,美国默克公司;LABCONCO 2.5L冻干机,美国Labconco公司;Nicolet 8700红外光谱仪,美国尼高利仪器公司;DXP 780拉曼光谱仪,美国尼高利仪器公司;六水合氯化铝(分析纯),国药集团试剂有限公司;酵母提取物(IVD),OXOID;蛋白胨(生物试剂),北京奥博星生物技术有限公司;葡萄糖(分析纯),国药集团试剂有限公司;琼脂(IVD),OXOID。
1.2 试验材料
采用高耐铝红酵母RS1(RS1)(中国普通微生物菌种保藏管理中心,编号2.4753)为试验材料。
1.3 培养条件
试验采用低pH低磷低镁培养基(LPM),其中镁、磷浓度均为 0.1 mmol/L,pH为3.5,具体组分参照文献[21]。采用 50 mmol/L 琥珀酸作为 pH 缓冲液。将1 mol/L的铝母液抽滤灭菌后加入高温灭菌后的LPM培养基,获得不同铝浓度的LPM培养基。液体培养在 30℃、200 r/min下进行。固体培养基采用酵母浸提粉胨葡萄糖培养基(YPD),包含1% 酵母提取物、2% 葡萄糖、2% 蛋白胨和1% 的琼脂粉,pH为自然pH。固体培养在30℃倒置静止进行。
1.4 酵母菌RS1的培养过程
从YPD平板上挑取单个RS1菌落,活化至对数期后接种到LPM液体培养基中。前期研究表明,在LPM培养基中70 mmol/L的铝浓度对RS1产生显著抑制作用[13]。故将RS1菌体分别接入铝浓度为0和70 mmol/L的LPM培养中。培养24 h后取样,通过检测OD600确定菌株的生长状况。然后,3 000离心 5 min收集菌体,除去上清液,用灭菌的去离子水清洗3次后,对菌体进行冷冻干燥处理。冷冻干燥后的菌体样品进行光谱分析。
1.5 光谱测定及光谱数据处理
傅里叶红外光谱(FTIR)测定:称取2 mg菌体与200 mg溴化钾混匀、压片,制备好后,用Nicolet 8700红外光谱仪测定,测量范围为4 000 ~ 400 cm–1,每次试验对信号进行32次扫描累加,仪器分辨率为 4 cm–1。
拉曼光谱(Raman)测定:称取适量菌体放于平板式通用样品架上,置于样品室内,采用DXP 780拉曼光谱仪检测,用波长为780 nm的激光激发,积分时间5.0 s,测量范围为3 500 ~ 160 cm–1。
每个样品设置5个重复,谱图均采用OMNIC 9.0软件进行处理,自动基线校正、自动平滑后取平均光谱进行分析,绘图采用Origin 8.0软件。所得数据采用WPS 2019和SPSS 19.0软件进行处理和统计分析,用独立样本t检验(unpaired Student's t-test)来检测不同处理在<0.05条件下的显著差异性。
2 结果与分析
2.1 红酵母RS1对铝的耐性
在LPM培养基中培养24 h后,对照组的OD600值为1.599,而70 mmol/L 铝处理组的OD600值为1.001(图1)。可见,相应浓度的铝处理显著抑制了RS1菌体的生长量,约抑制了RS1菌体37% 的生长量。
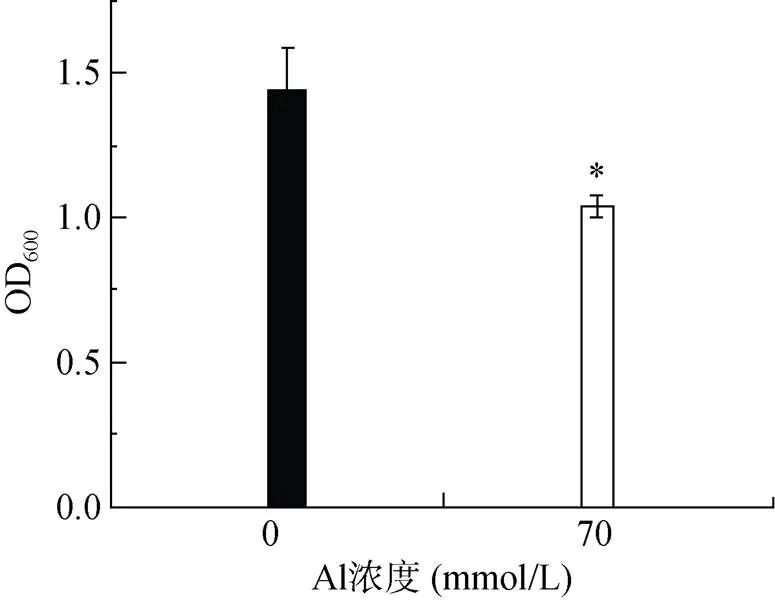
(图中*表示处理间差异在P<0.05水平显著,下图同)
2.2 红酵母RS1菌体的傅里叶红外光谱
图2为红酵母RS1在无铝和70 mmol/L铝处理下的傅里叶红外光谱图。可以看出,红酵母RS1的傅里叶红外光谱吸收峰种类较多,在整个波数范围内均有吸收。表1列举了RS1酵母细胞主要红外光谱信号峰可能对应的生物大分子。由表1可见,RS1的光谱图主要包括几丁质的O–H和仲胺的N–H的伸缩振动峰(3 283 cm–1)、蛋白质特征峰(1 645、1 543、1 240 cm–1)、甲基和亚甲基的吸收峰(2 923、1 455 cm–1),2 853 cm–1处的峰可能为脂肪酸C–H骨架的吸收峰,1 076 cm–1处的峰可能是细胞壁中碳水化合物的C–O伸缩振动峰,1 403 cm–1处的峰可能是羧基的对称伸缩振动峰,1 744 cm–1处的峰可能是酯羰基峰[22]。此外,还有1 377 cm–1和2 923 cm–1处的吸收峰,表明RS1细胞表面含有β-1,3葡聚糖,804 cm–1处的吸收峰可能为甘露聚糖峰[23]。
图2和表1结果还显示,在铝处理后,804 cm–1处的吸收峰消失,推测甘露聚糖与铝结合使得结构发生变化以致吸收峰消失;1 403 cm–1处的吸收峰移至1 397 cm–1,表明羧基的C–O键发生位移,且吸收峰强度降低至对照的44.3%(图3)。铝处理后在1 706 cm–1处出现了一个新的吸收峰,这可能来自羰基基团。为了描述红酵母RS1铝处理后细胞中生物大分子的变化规律,本文总结了铝处理后主要特征峰的强度变化(图3)。统计结果显示,铝处理后多糖类吸收峰强度无显著变化(1 076 cm–1),酰胺I带吸收峰(1 645 cm–1)强度显著上升,这个蛋白质特征峰强度的增加,暗示RS1在铝胁迫下蛋白质合成增强。
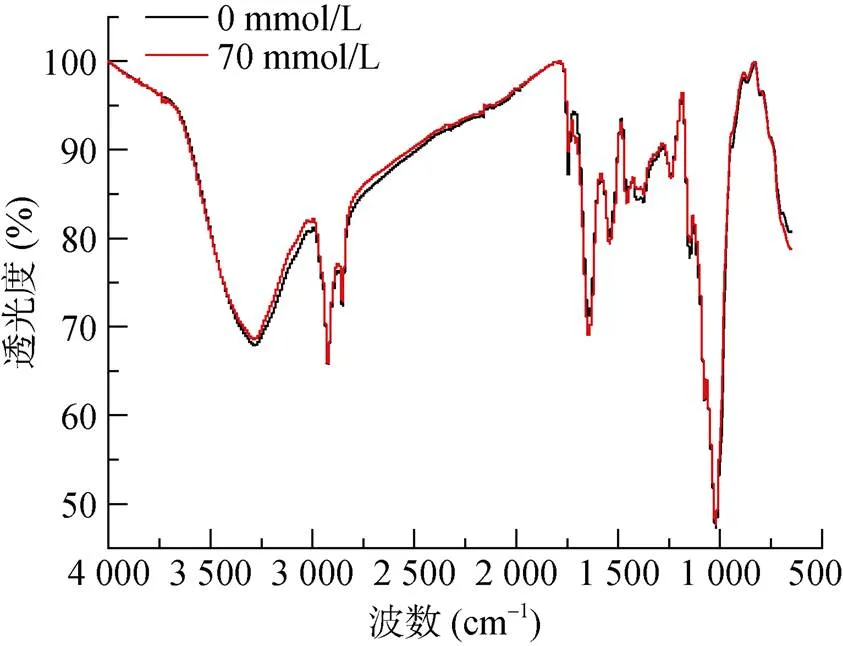
图2 RS1傅里叶红外光谱图
2.3 红酵母RS1菌体的拉曼光谱
图4为红酵母RS1在无铝和70 mmol/L铝处理下的拉曼光谱图。表2列举了RS1酵母细胞主要拉曼光谱信号峰可能对应的生物大分子。如图4和表2所示,红酵母RS1拉曼谱光图中1 002 cm–1处的峰来源于苯丙氨酸单基取代苯基环,1 083 cm–1处的峰属于核酸和脂类,1 153 cm–1处的峰属于蛋白质,1 289 cm–1处的峰属于脂类,1 450 cm–1处的峰属于脂类和蛋白质,1 656 cm–1处的峰主要来自蛋白酰胺I的C=O伸缩振动,属于蛋白质二级结构的α-螺旋结构[24-26]。
图4和表2还显示,铝处理后RS1出现了3个新的特征峰,分别是779 cm–1核糖核酸(RNA)峰、856 cm–1的酪氨酸峰和1 270 cm–1酰胺Ш带峰。然而,检测到的特征峰并无明显漂移现象,也无显著强度变化(图5)。
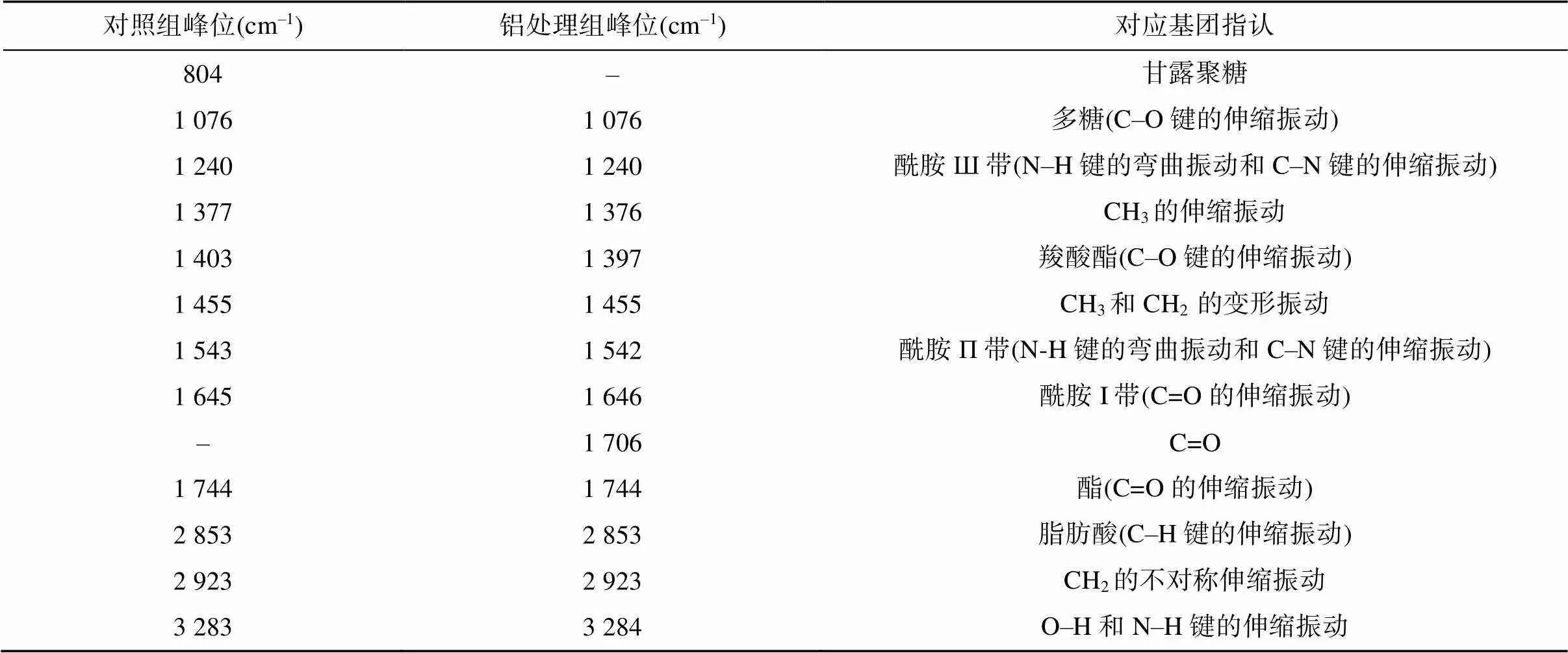
表1 RS1酵母细胞傅里叶红外光谱主要信号峰可能对应的生物大分子(基团)[22-23]
注:–表示未检测到此峰,下表同。
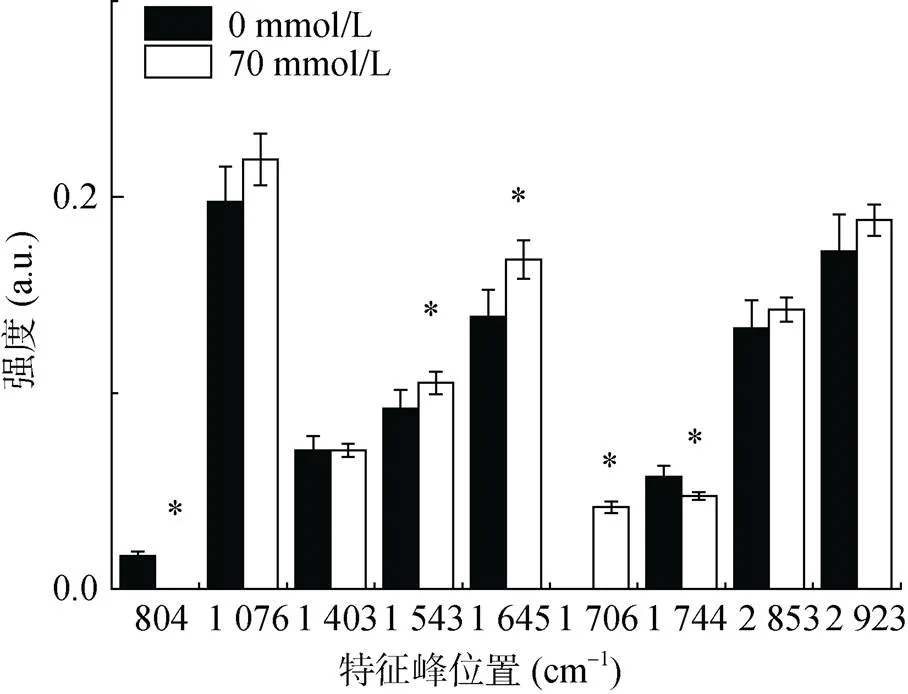
(图中显示的峰位置为对照组峰位置,下图同)

图4 RS1拉曼光谱图
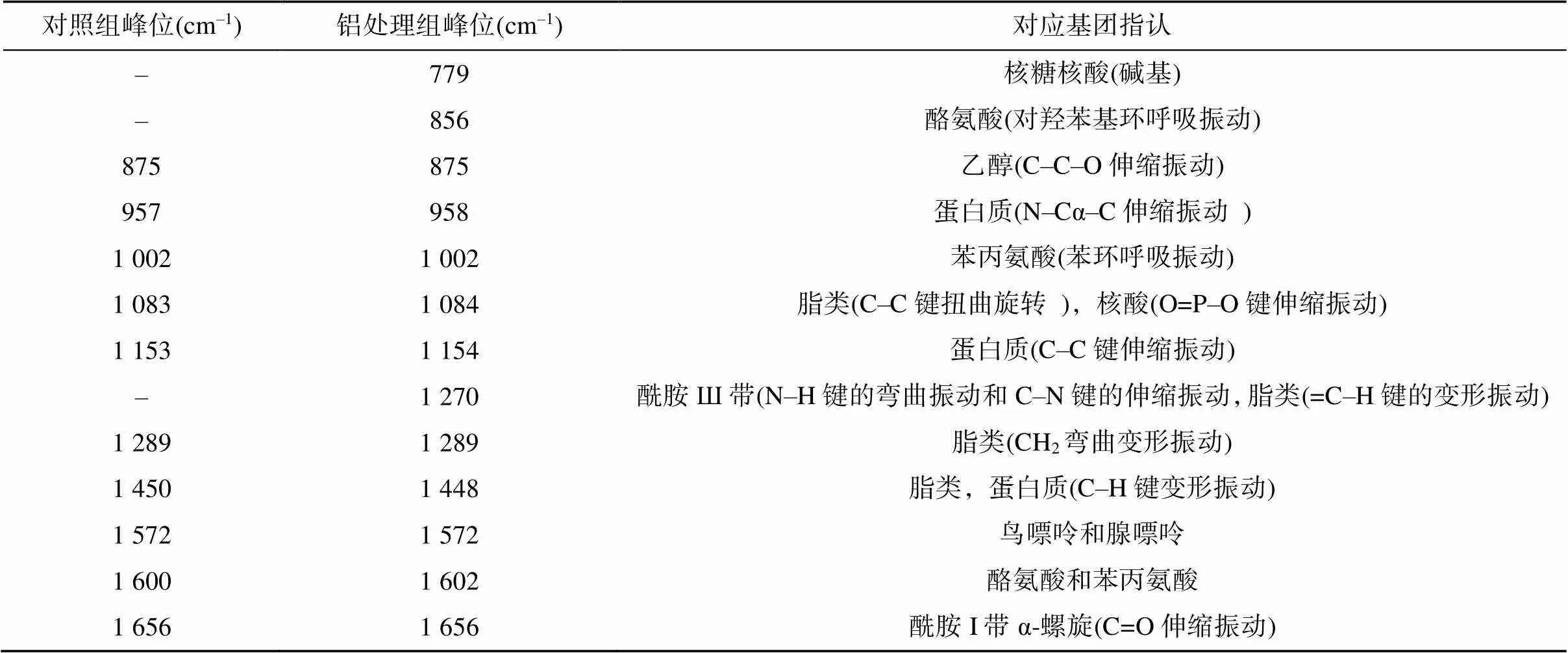
表2 RS1酵母细胞拉曼光谱主要信号峰可能对应的生物大分子(基团)[24-26]
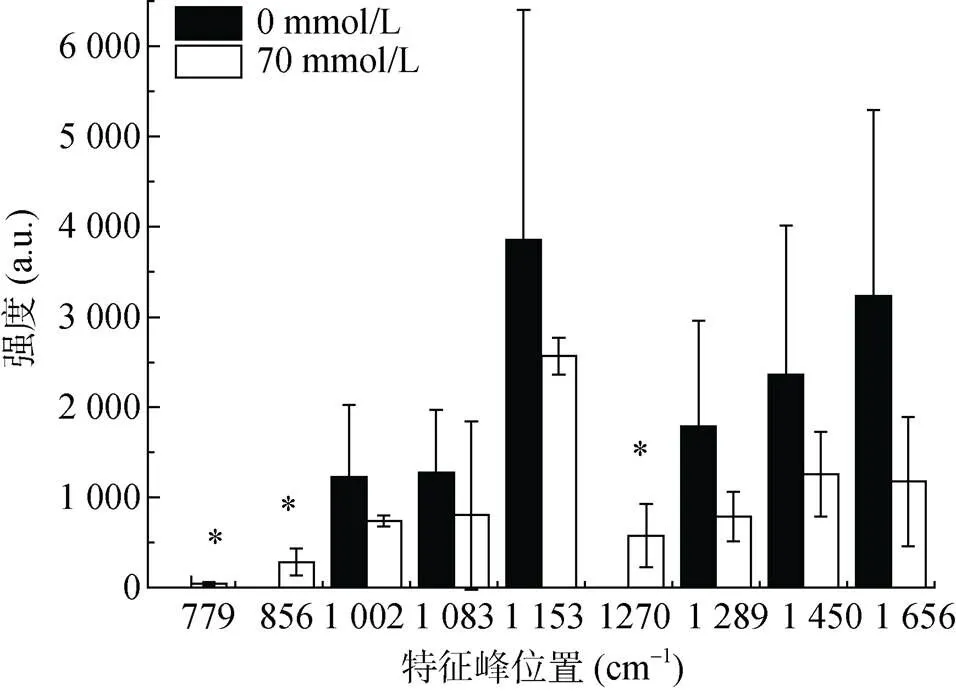
图5 RS1铝处理及对照的拉曼光谱特征峰强度
3 讨论
傅里叶红外光谱结果显示,红酵母RS1的无铝对照组在804 cm–1处检测出甘露聚糖吸收特征峰,但铝处理后此峰消失,推测甘露聚糖参与对铝的固定过程使其结构发生变化。Kapoor和Viraraghavan[27]研究发现,细胞壁甘露聚糖对金属离子表现出很强的吸附能力。铝处理下RS1羧基的C-O键发生位移,由1 403 cm–1移至1 397 cm–1,红移6 cm–1,同时峰强度减弱。这种位移归属于羧基阴离子与阳离子的结合,说明羧基基团可能参与了对铝的吸附作用。已有研究报道,酿酒酵母细胞表面羧基基团在对铜离子和铅离子等金属离子吸附中起重要作用[28-29],表明羧基对酵母抵御金属离子胁迫的贡献可能具有广泛性。同时在1 706 cm–1处出现了一个新的吸收峰,可能来自羰基基团,说明羰基也是RS1对铝的吸附位点。而拉曼光谱中RS1铝处理组在1 270 cm–1新出现的酰胺Ш带吸收峰,在856 cm–1处出现酪氨酸吸收峰,表明酰胺基和酪氨酸也是铝离子吸附位点。任铮宇等[30]也发现,嗜重金属菌菌体表面的羰基和酰胺基等官能团在对金属离子的吸附中起关键作用。前人大量研究表明,细胞表面羟基是酵母吸附金属离子的一个重要位点[17-18, 28-29],但在本研究中并未发现RS1的羟基峰对铝处理有明显响应,这可能与吸附的金属离子不同,或与不同菌株之间的差异相关。
铝处理后的RS1红外光谱特征峰酰胺I带吸收峰(1 645 cm–1)和酰胺Π带吸收峰(1 543 cm–1)吸收强度均显著增加,这两个蛋白质特征峰强度的变化表明铝处理后RS1细胞的部分蛋白质合成增加。李金金等[31]采用拉曼光谱对铝处理后土生隐球酵母检测发现蛋白质类峰强度下降,这是铝毒诱导土生隐球酵母细胞发生凋亡引起的。鲍改玲等[32]用ZnSO4处理啤酒酵母时,发现处理后蛋白质特征峰的吸光度下降,认为是蛋白质参与结合Zn2+所致。铝胁迫下RS1蛋白质增加或许与RS1高耐铝性相关。
傅里叶红外光谱和拉曼光谱研究结果发现了可能参与铝吸附的不同官能团,傅里叶红外光谱主要有羧基和羰基,拉曼光谱主要是酰胺基。因此,傅里叶红外光谱和拉曼光谱技术结合运用,能够更加全面地揭示RS1细胞表面与铝吸附相关的官能团,充分发掘其耐铝机制。黄皓等[20]曾将红外和拉曼光谱技术结合用于对酿酒酵母吸附Pb2+、Cd2+的相互作用机理研究,通过红外光谱发现酿酒酵母对Pb2+、Cd2+的吸附主要与羟基和羧基官能团有关,然后通过这两个基团对应的拉曼光谱峰强度的增加进一步确定其参与酿酒酵母的吸附过程。由此可见,两种光谱技术所得结果既可以相互验证,也可以相互补充,结合起来使用增强了研究结果的可信度,也使得研究结果更加全面。综上所述,红酵母RS1细胞表面对铝有吸附固定作用的生物大分子主要是细胞壁多糖以及蛋白质,羧基、羰基、酰胺基对铝的吸附固定作用可能是RS1具有高耐铝性的重要机理之一。这些基团或许也参与了其他耐铝微生物对铝的吸附过程,对研究其他耐铝微生物对铝吸附基团有一定借鉴和参考作用,并为微生物的耐铝性研究提供了一定的理论依据。对于高耐铝微生物耐铝机制的研究,不仅补充了生物的耐铝机制,为植物耐铝毒机制的研究提供一种新视角,而且高耐铝特征有助于筛选和通过遗传改良获得抗铝毒害能力较强的植物品种,这是解决酸性土壤中铝毒害的高效途径之一。因此,高耐铝微生物的特性研究对酸性土壤的改良与修复、生产潜力提升有重大意义。
4 结论
红酵母RS1细胞表面与铝吸附相关的物质主要是细胞壁葡聚糖,主要涉及的官能团包括羧基、羰基和酰胺基。这些细胞表面官能团对铝的固定作用可能是红酵母RS1高耐铝的一个重要机制。
[1] Kochian L V. Cellular mechanisms of aluminum toxicity and resistance in plants[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1995, 46(1): 237–260.
[2] 徐仁扣, 李九玉, 周世伟, 等. 我国农田土壤酸化调控的科学问题与技术措施[J]. 中国科学院院刊, 2018, 33(2): 160–167.
[3] 沈仁芳. 铝在土壤-植物中的行为及植物的适应机制[M]. 北京: 科学出版社, 2008.
[4] Kochian L V, Piñeros M A, Hoekenga O A. The physiology, genetics and molecular biology of plant aluminum resistance and toxicity[M]// Lambers H, Colmer T D. Root Physiology: From Gene to Function. Plant Ecophysiology, vol. 4. Dordrecht: Springer, 2005.
[5] 邱金奎, 张磊, 年洪娟, 等. 一株耐铝隐球酵母菌株5-2的分离鉴定及耐铝特性分析[J]. 中国微生态学杂志, 2015, 27(5): 497–500.
[6] 肖春玲, 王安萍, 贺根和, 等. 油茶根际土壤耐酸铝微生物的筛选[J]. 贵州农业科学, 2012, 40(1): 90–92.
[7] Ji B, Chen W, Zhu L, et al. Isolation of aluminum-tolerant bacteria capable of nitrogen removal in activated sludge[J]. Marine Pollution Bulletin, 2016, 106(1/2): 31–34.
[8] Kimoto K I, Aizawa T, Urai M, et al.sp. nov., an aluminium-tolerant bacterium isolated from Panicum repens grown in a highly acidic swamp in actual acid sulfate soil area of Vietnam[J]. International Journal of Systematic and Evolutionary Microbiology, 2010, 60(4): 764–768.
[9] Zhang D M, Duine J A, Kawai F. The extremely high Al resistance ofF-13 is not caused by internal or external sequestration of Al[J]. Biometals, 2002, 15(2): 167–174.
[10] 王阁奇, 年洪娟, 陈丽梅. 微生物耐铝机制的研究进展[J].生物技术通报, 2010(4): 59–62.
[11] Ryan P R, Tyerman S D, Sasaki T, et al. The identification of aluminium-resistance genes provides opportunities for enhancing crop production on acid soils[J]. Journal of Experimental Botany, 2011, 62(1): 9–20.
[12] Wang C, Zhao X Q, Aizawa T, et al. High aluminum tolerance ofsp. RS1 is associated with thickening of the cell wall rather than chelation of aluminum ions[J]. Pedosphere, 2013, 23(1): 29–38.
[13] 胡振民, 赵学强, 王超, 等. 细胞壁组分在红酵母RS1高耐铝中的作用研究[J]. 土壤, 2017, 49(2): 256–260.
[14] Kollár R, Petráková E, Ashwell G, et al. Architecture of the yeast cell wall[J]. Journal of Biological Chemistry, 1995, 270(3): 1170–1178.
[15] Fein J B, Daughney C J, Yee N, et al. A chemical equilibrium model for metal adsorption onto bacterial surfaces[J]. Geochimica et Cosmochimica Acta, 1997, 61(16): 3319–3328.
[16] 张菊华, 朱向荣, 尚雪波, 等. 近红外光谱、中红外光谱、拉曼光谱无损检测技术在食用油脂分析中的研究进展[J]. 食品工业科技, 2010, 31(10): 421–425.
[17] 丽丽. 粘质红酵母菌WT6-5对水中Pb2+的耐受性及吸附作用研究[D]. 沈阳: 东北大学, 2013.
[18] 王晓彧, 郑新艳, 沈扬皓, 等. 酵母菌对低浓度铀的吸附机理及动力学研究[J]. 环境科学学报, 2017, 37(1): 169–177
[19] 孙素琴, 刘军, 周群. 傅里叶变换红外光谱和傅里叶变换拉曼光谱法无损鉴别药材的真伪[J]. 分析化学, 2002, 30(2): 140–143.
[20] 黄皓, 杨忠华, 王光辉, 等. 酿酒酵母吸附Pb2+、Cd2+的相互作用机理研究[C]. 中国能源科学家论坛, 2011
[21] Sherman F. Getting started with yeast[J]. Methods in Enzymology, 1991, 194: 3–21.
[22] Han R P, Bao G L, Lu Z. Comparison of infrared spectra of native and esterified beer yeast[J]. Guang Pu Xue Yu Guang Pu Fen Xi, 2004, 24(7): 820–822.
[23] 王战勇, 杨双春, 苏婷婷. 啤酒废酵母制备碱不溶性葡聚糖[J]. 氨基酸和生物资源, 2006, 28(1): 37–39.
[24] Huang Y S, Karashima T, Yamamoto M, et al. Molecular- level investigation of the structure, transformation, and bioactivity of single living fission yeast cells by time-and space-resolved Raman spectroscopy[J]. Biochemistry, 2005, 44(30): 10009–10019.
[25] Puppels G J, de Mul F F M, Otto C, et al. Studying single living cells and chromosomes by confocal Raman microspectroscopy[J]. Nature, 1990, 347(6290): 301.
[26] Notingher I, Verrier S, Haque S, et al. Spectroscopic study of human lung epithelial cells (A549) in culture: Living cells versus dead cells[J]. Biopolymers, 2003, 72(4): 230–240.
[27] Kapoor A, Viraraghavan T. Heavy metal biosorption sites in[J]. Bioresource Technology, 1997, 61(3): 221–227.
[28] 韩润平, 杨贯羽, 张敬华, 等. 光谱法研究酵母菌对铜离子的吸附机理[J]. 光谱学与光谱分析, 2006, 26(12): 2334–2337.
[29] 张敬华, 邹卫华, 戴盈盈, 等. 丙酮处理酵母菌吸附铅前后红外光谱分析比较[J]. 河南科学, 2004, 22(6): 777–779.
[30] 任铮宇. 嗜重金属菌对金属离子的吸附研究[D]. 大连: 大连工业大学, 2013.
[31] 李金金, 卢明倩, 张晶晶, 等. 拉曼光谱技术研究铝胁迫下的土生隐球酵母细胞凋亡[J]. 中国激光, 2014, 41(11): 276–284.
[32] 鲍改玲, 张宗培, 韩润平. 啤酒酵母的红外光谱研究[J]. 河南科学, 2002, 20(1): 33–35.
Infrared Spectroscopy and Raman Spectroscopy Study on High Resistant AluminumRS1
CHENG Si1,2,WANG Chao1,SHEN Renfang1,2*
(1 State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China; 2 University of Chinese Academy of Sciences, Beijing 100049, China)
RS1 is a high aluminum resistantstrain selected from acid soil of oil tea in Yingtan of Jiangxi Province, which can tolerate aluminum concentration up to 200 mmol/L. Previous studies have showed that RS1 can immobilize aluminum on the cell surface and block it from entering the cell. However, it is unclear what kind of group on the cell surface is involved in aluminum fixation. In this paper, Fourier transform infrared spectroscopy and Raman spectroscopy were used to study the surface functional group changes of RS1 cells under aluminum stress in order to explore the high aluminum resistance mechanism of RS1 from the perspective of spectroscopy. It was found that the absorption peak at 1 403 cm–1in the IR spectrum of RS1 was red shifted to 1 397 cm–1after treatment with 70 mmol/L aluminum for 24 h, which may be a carboxyl group. A new absorption peak appeared at 1 706 cm–1, which may be a carbonyl peak. The absorption peak intensities of amide I band in the IR spectrum with aluminum treatment were significantly increased and the mannan peak disappeared. The new absorption peaks of the Raman spectrum at 779 cm–1, 856 cm–1and 1 270 cm–1may be the absorption peaks of RNA, tyrosine and amide Ш band, respectively. The results of IR and Raman spectroscopy show that the substances related to aluminum adsorption on the surface of RS1 cells are mainly polysaccharides and proteins of cell wall, and the main functional groups include carboxyl groups, carbonyl groups and amide groups. The immobilization of aluminum by these functional groups on cell surface may be an important mechanism for the high aluminum tolerance ofRS1.
; Aluminum toxicity; Fourier transform infrared spectrum; Raman spectroscopy
S154.3
A
10.13758/j.cnki.tr.2020.06.009
程思, 王超, 沈仁芳. 高耐铝红酵母RS1的红外光谱和拉曼光谱研究. 土壤, 2020, 52(6): 1158–1163.
国家自然科学基金项目(41501328)和中国科学院战略性先导科技专项重点研究计划项目(XDB15030302)资助。
(rfshen@issas.ac.cn)
程思(1994—),女,安徽滁州人,硕士研究生,主要从事生物逆境机制研究。E-mail:chengsi@issas.ac.cn
