分级富含氧空位BiOCl微球的制备及其电化学性能
2020-12-26程荣荣田华东徐晴晴林默涵吕耀辉
朱 婷,程荣荣,田华东,徐晴晴,林默涵,李 培,吕耀辉
(1.皖江工学院基础教学部,安徽马鞍山243031;2.安徽工业大学材料科学与工程学院,安徽马鞍山243032)
便携式电子设备和混合动力电动汽车的迅猛发展,加速了市场对高能量和高功率存储器件的迫切需求。超级电容器因具高功率密度、良好的循环性和较宽的温度限制等特性而被广泛应用于消费电子、存储器备用系统、工业电源和能源管理等领域[1-6]。赝电容材料(以MnO2,RuO2为代表)可在电极材料表面产生快速可逆的氧化还原反应,表现出优异的比电容和能量密度。其中:RuO2在水电解质中的电容超过600 F·g-1,电化学性能优异[7],但其成本高、毒性大,没有得到广泛应用;MnO2材料因具较低成本和较大电势窗口而受到极大关注,但MnO2碱性电池比表面积低、电导率差,MnO2超级电容器在强酸和强碱电解质中性能不稳定。因此,有必要探寻低成本、环保的赝电容材料。
新兴材料BiOCl成本低、半导体特性优异和晶体结构特殊,由此成为最有前景的电极材料。BiOCl材料为层状的四方晶体结构,[Bi2O2]2+层在两层Cl-中间,其独特的晶体结构利于电解质离子沿c轴传输,从而提高其电化学性能[8-9]。Hong 等[10]制备出山茶花形BiOCl 材料,结果显示:电流密度为1 A·g-1时,比电容达1 243 F·g-1;电流密度为5 A·g-1时,循环3 000次后电容保持率仍为90.3%,循环稳定性优异。
对于过渡金属氧化物,氧空位是普遍存在的缺陷之一。研究表明[11-15],氧空位能够改善金属氧化物材料的电化学性能,主要原因在于氧空位可作为反应的活性位点,参与表面吸附和氧化还原反应过程;氧空位可改变材料的电子结构,增强电子/离子的扩散能力,进而增强材料的电导率;氧空位能提供离子存储所需的物理空间,利于提高材料的比容量。基于此,近年来许多研究集中于通过调控氧空位来改善材料的电化学性能。Kim等[16]研究表明,氧缺失的α-MoO3-x具优异的赝电容存储性能,引入氧空位能产生更大的层间距,利于快速存储电荷;Zhai等[17]通过氢化处理的手段制备了含氧空位的MnO2,与未处理的MnO2相比,经氢化处理的MnO2具高的比电容(449 F·g-1)、优异的速率性能和循环稳定性。然而,氧空位缺失的BiOCl微球电化学性能至今少见报道。鉴于此,文中以Bi(NO3)3·5H2O为铋源、盐酸为氯源,采用沉淀法制备分级BiOCl微球,研究氧空位对分级BiOCl微球微观形貌、表面化学态和电化学性能的影响。
1 实验
1.1 BiOCl微球的制备
将一定量的Bi(NO3)3·5H2O(1 mol/L)溶液缓慢滴加至盐酸(1 mol/L)溶液中,至Bi 与Cl 的摩尔比为1∶1时,磁力搅拌30 min。随后将1 mol/L的NH4OH溶液逐滴滴加至上述溶液,当pH值为6时停止滴加,磁力搅拌30 min,用蒸馏水洗涤数次并真空抽滤得到白色固体产物。将产物在100 ℃下真空干燥24 h,得到BiOCl原始样品,其离子反应方程式如式(1),(2)。取一定量的样品放入自制的高压反应釜中,在氢气气氛下进行氢化退火处理,反应温度为100,150,200 ℃,升温速率为10 ℃/min,反应时间为2 h,反应釜压力保持为4 MPa。将不同温度下氢化处理的样品分别标记为BiOCl100,BiOCl150,BiOCl200。

1.2 电极的制备
将制备的活性物质BiOClθ(θ为反应温度,分别为100,150,200 ℃)和乙炔黑以质量比8∶1混合研磨,加入适量的无水乙醇,超声10 min 后滴加一定量的PTFE 乳液(2 mol/L)(乙炔黑∶PTFE(质量比)=1∶1),超声1 h。随后将上述浆料均匀涂抹在泡沫镍上,80 ℃真空干燥12 h后,在压片机上采用10 MPa压力压制成电极片。
1.3 电化学性能的测试
将BiOClθ电极片放入6 mol/L的KOH溶液中浸泡1 h,采用三电极测试方法对其进行电化学性能测试。BiOClθ为工作电极,铂电极为对电极,Hg/HgO电极为参比电极。采用CHI600E电化学工作站对BiOClθ电极片进行循环伏安(CV)和电化学阻抗谱(EIS)测试,电化学阻抗谱在开路电压下测试,振幅为5 mV,频率范围为102~104kHz。采用Neware电池测试仪对BiOClθ电极片进行恒电流充放电和循环性能测试,电压窗口0~1 V。由式(3)计算得到BiOClθ电极片质量比电容CBiOCl。

式中:C为电极材料的比电容;I为放电电流;m为BiOClθ的质量;ΔV为电势窗口。
1.4 物化性质的表征
采用德国布鲁克公司生产的型号为AXS D8 的X 射线衍射仪(X ray diffraction,XRD)(Cu 靶Kα 辐射,测试角度为10°~60°)测试样品的晶体结构。采用型号为S-4200 的场发射扫描电子显微镜(field-emission scanning electron microscope,FESEM)和型号为JEM-2100F 的高分辨透射电子显微镜(high-resolution transmission electron microscope,HRTEM)观察样品的微观形貌。采用型号为Thermo ESCALAB 250 XI 的X射线光电子能谱(X ray photoelectron spectroscopy,XPS)检测材料表面元素组分(Al靶Kα辐射)。采用英国雷尼绍Renishaw公司的inVia激光共聚焦拉曼光谱仪测试材料的拉曼光谱(Raman spectroscopy),激发波长为425 nm。
2 实验结果与讨论
2.1 X射线衍射分析
图1 为BiOCl 样品不同温度下氢化处理的XRD 图谱。从图1 可观察到:没有氢化处理的样品在12.0°,24.1°,25.9°,32.5°和33.5°处出现衍射峰,分别对应于BiOCl的(001),(002),(101),(110)和(102)晶面(JCPDS卡片号为85-0861)(图1(a));氢化处理样品的衍射峰向着低角度方向偏移(图1(b));随着氢化温度的升高,BiOCl晶格间距增大。晶格中氧原子缺失导致原子层厚度减小,从而造成表面张力增加,晶格间距加大,致使衍射峰的位置向左偏移[18]。
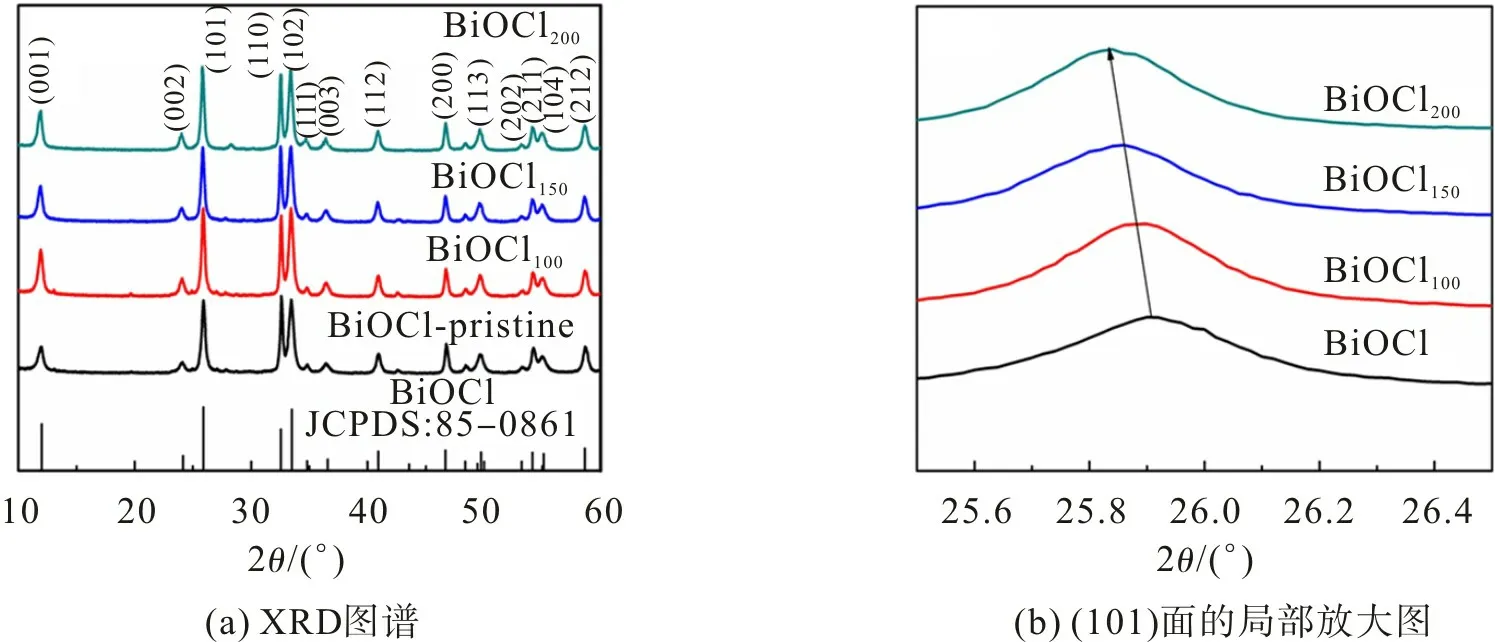
图1 BiOCl,BiOCl100,BiOCl150,BiOCl200的XRD图谱Fig.1 XRD patterns of BiOCl,BiOCl100,BiOCl150,BiOCl200
2.2 拉曼光谱和X射线光电子能谱分析
图2 为氢化处理前后BiOCl 和BiOCl150样品的拉曼光谱。从图2可观察到:BiOCl有3个明显的特征峰,分别位于62.79,148.34,202.35 cm-1处,位于62.79 cm-1处的峰是由于外部Bi—Cl 产生,148.34 cm-1处的强峰是由于A1g内部Bi—Cl拉伸模式产生,存在于202.35 cm-1处的峰为Eg内部Bi—Cl拉伸模式[19-21];与BiOCl样品相比,BiOCl150样品的特征峰出现可视的移动和展宽,主要是由于氧空位引起BiOCl表面电子结构发生变化造成的[22]。

图2 BiOCl和BiOCl150的拉曼图谱Fig.2 Raman spectrum of BiOCl and BiOCl150
采用XPS 分析进一步研究样品的表面组成和化学状态,图3为BiOCl和BiOCl150样品的O 1s高分辨图谱。由图3可以看出:对于BiOCl和BiOCl150样品的O 1s图谱,OL特征峰对应于晶格氧(Bi—O键),位于530.0 eV处;OW特征峰对应于Bi—O层间的游离氧,位于532.0 eV 处;位于531.2 eV 处的OV特征峰与氧空位有关。表面氧空位的存在增加了氧气的潜在吸附[22-24]。表1为BiOCl和BiOCl150样品中不同氧物种的含量。从表1 可看出,与BiOCl 相比,BiOCl150中的OV含量显著增加,质量分数达6.7%,这主要是氧缺陷的存在增加氧气吸附所致。

表1 O 1s高分辨谱中不同氧物种的含量Tab.1 Content of different oxygen species in the decomposed O 1s
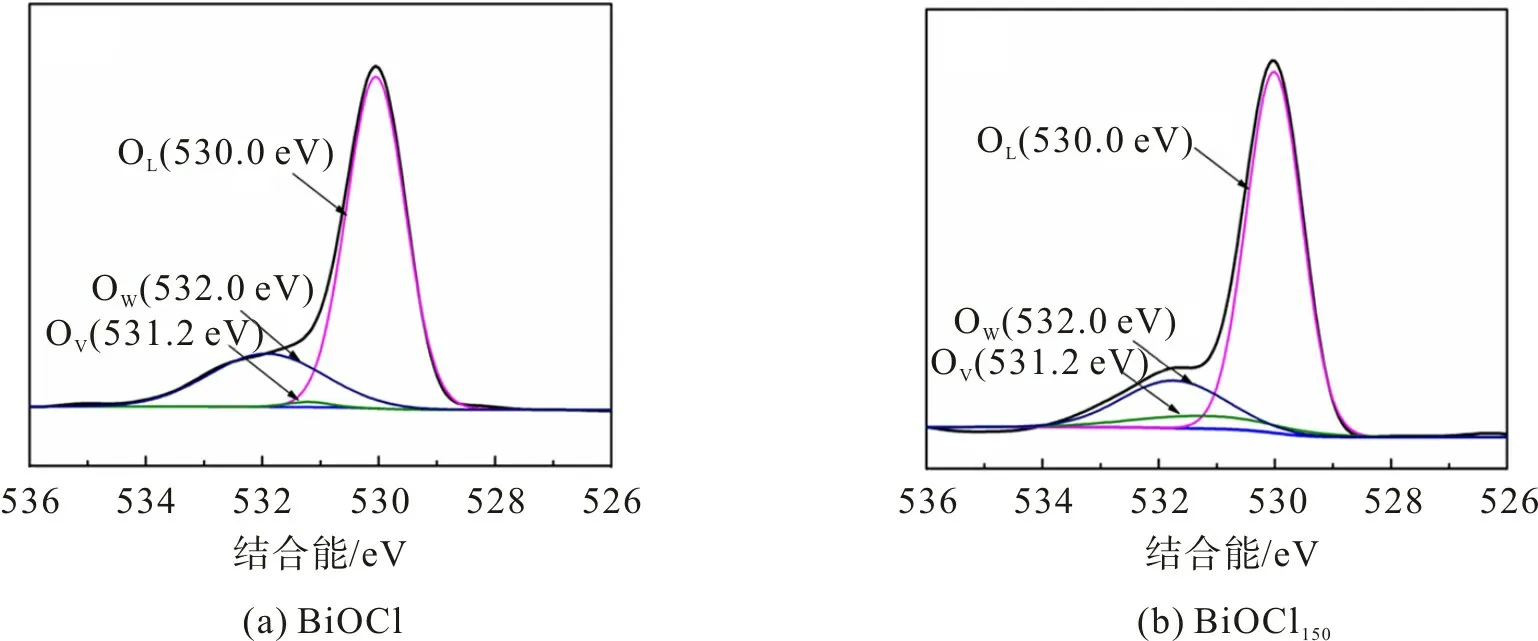
图3 BiOCl和BiOCl150的O 1s高分辨图谱Fig.3 O 1s high resolution spectrum of BiOCl and BiOCl150
2.3 扫描电镜和透射电镜分析
图4为BiOCl原始样品以及不同温度下氢化处理样品的FESEM图。由图4可观察到:BiOCl原始样品呈片状组成的分级球状形貌,尺寸为2~3 μm;随着氢化处理温度的升高,样品球状结构的塌陷程度逐渐增大,这是晶格中氧原子缺失所致;BiOCl150为大量叠加的片状形貌,这与SEM图片结果吻合;BiOCl150样品的晶格条纹为0.267 nm,对应于BiOCl相的(102)晶面;值得注意的是,BiOCl150样品边缘模糊,这与BiOCl晶格中氧空位引起的晶格畸变有关[22,25]。

图4 BiOCl,BiOClθ的FESEM图像及BiOCl150的TEM和HRTEM图像Fig.4 FESEM images of BiOCl,BiOClθ and TEM and HRTEM images of BiOCl150
2.4 电化学测试结果分析
图5 为BiOCl,BiOClθ循环伏安曲线、充放电曲线及循环稳定性。图5(a)为BiOCl 和BiOClθ样品在0.5 mV·s-1扫描速率下的循环伏安曲线。由图5(a)可观察到,样品在-0.4,-0.7 V 左右均出现一对氧化还原峰,表现为赝电容行为。BiOCl的还原反应机理如下:

氧化反应机理如下:


图5(b)为电流密度为0.5 A·g-1时,BiOCl和BiOClθ样品的充放电曲线。从图5(b)可观察到,在充电过程中,BiOClθ电极电位迅速下降,降至-0.6 V左右时到达平台,然后放电至-1 V,进一步说明BiOCl材料具有赝电容特性。根据式(1)可计算出BiOClθ样品电极的比电容,结果如图5(c)。由图5(c)可看出:电流密度为0.5 A·g-1时,BiOCl150的比电容为983 F·g-1,而BiOCl的比电容仅500 F·g-1,这主要是由于氧空位增加了载流子浓度,便于离子/电子的传输,从而提高了电子/离子的迁移速率[26];值得注意的是,BiOCl200样品的比电容稍微下降,这主要是过多的氧空位造成部分区域晶格结构塌陷,从而导致电容损失。
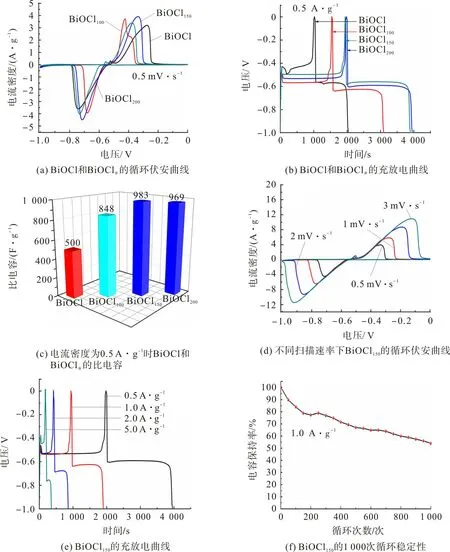
图5 BiOCl,BiOClθ循环伏安曲线、充放电曲线及循环稳定性Fig.5 Cyclic voltammetry,charge and discharge curves and cycle stability of BiOCl and BiOClθ
图5(d)为BiOCl150在不同扫描速率下的循环伏安曲线。从图5(d)可观察到:BiOCl150的赝电容行为是由Bi 和Bi2O22+的氧化还原反应引起的,主要表现为在-0.336,-0.714 V 处的氧化还原峰;值得注意的是,在-0.523 V附近产生小峰,这是由于未转化的BiOCl基质氧化所致[27];随着扫描速率的增加,CV曲线的形状保持不变,进一步说明BiOCl150材料具良好的电容性能和优异的速率能,电流密度在0.5,1,2,5 A·g-1下的比电容分别为983,465,205,77 F·g-1,说明BiOCl150样品具良好的倍率性能。
为进一步评估BiOCl150电极材料的循环稳定性,在电流密度为1 A·g-1下对BiOCl150进行1 000次的充放电循环性能测试,结果如图5(f)。由图5(f)可看出,BiOCl150电极材料1 000次循环后,电容保持率约55%,循环稳定性较好。
图6 为BiOCl 样品的奈奎斯特图。从图6 可观察到:BiOClθ样品在高频区呈半圆特征,低频区呈直线特征;BiOCl,BiOCl100,BiOCl150,BiOCl200的内阻Rs分别为1.26,1.17,1.14,1.16 Ω,说明氧空位增强了材料的电导率。高频区半圆直径表示电解质/电极界面的电荷转移电阻Rct,低频区直线斜率为扩散电阻。从图6 还可观察到,BiOClθ样品的Rct几乎一致,但随着氢化温度的升高,扩散电阻逐渐减小,BiOCl150表现出最小的扩散电阻。这是氧空位能有效改变材料的电子结构,减小电子/离子扩散阻力所致[28]。
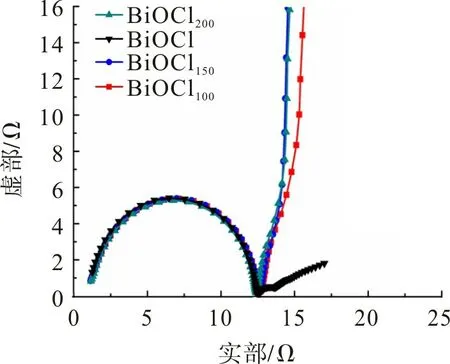
图6 BiOClθ样品的奈奎斯特图Fig.6 Nyquist plot of BiOClθ samples
3 结 论
采用共沉淀法制备系列富含氧空位的分级BiOCl微球,研究氧空位对BiOCl微球的表面状态、微观形貌及电化学性能的影响,得到如下主要结论:
1)BiOCl微球为由片状组成的分级结构,尺寸为2~3 μm;氢化温度为150 ℃时,氧空位质量分数达6.7%;随着氢化温度的增加,样品球状结构塌陷程度逐渐增大,这主要是由于晶格中氧原子缺失所致。
2)电流密度为0.5 A·g-1时,BiOCl150样品的质量比电容为983 F·g-1,相比于未氢化处理的样品,比电容提高了483 F·g-1,这主要是由于氧空位增加载流子浓度,便于电子/离子的传输,从而提高电导率所致。
本研究不仅提出了提高BiOCl电化学性能的简单路线,而且为发展绿色和高性能超级电容器指明了新的方向。
