肾素-血管紧张素系统双轴对股骨头缺血性坏死的影响
2020-12-14帅波陈升浩沈霖
帅波 陈升浩 沈霖

[摘要] 目的 探討肾素-血管紧张素系统(RAS)双轴对非创伤性股骨头缺血性坏死(INFH)的影响。 方法 收集2015年10月—2017年6月于华中科技大学同济医学院附属协和医院及湖北省随州市中心医院骨科行股骨头置换术的90例患者,其中45例INFH患者作为INFH组,45例创伤性股骨颈骨折术后患者作为对照组。术前检测两组患者循环血中的血管紧张素转换酶(ACE)、血管紧张素Ⅱ(AngⅡ)、血管紧张素Ⅱ-1受体(AT1R)、ACE2、Ang(1-7)、Mas受体(Mas-R)的表达情况,术后检测股骨头局部骨组织中的ACE、AngⅡ、AT1R、ACE2、Mas-R、破骨细胞分化因子(RANKL)及骨保护素(OPG)mRNA的表达情况,并进行免疫组化分析。 结果 两组循环血中ACE、AngⅡ、AT1R、ACE2、Ang(1-7)及Mas-R表达情况比较,差异均无统计学意义(P > 0.05)。INFH组股骨头局部骨组织ACE2、Mas-R、OPG mRNA表达水平均低于对照组(P < 0.05),而ACE、AngⅡ、AT1R、RANKL mRNA表达水平及RANKL mRNA/OPG mRNA均高于对照组(P < 0.05)。与对照组比较,INFH组骨组织HE染色显示组织内脂肪细胞增生,骨小梁变细,骨细胞核固缩、深染,骨陷窝空虚明显增多;INFH组骨组织Masson染色显示深蓝色变浅,较为杂乱,显示胶原结构减少、纤维结构明显增生。免疫组化结果提示INFH组骨组织中ACE及AT1R表达高于对照组,而ACE2及Mas-R表达低于对照组。两组ACE、AT1R、ACE2及Mas-R四组分阳性表达面积百分比比较,差异有统计学意义(P < 0.05)。 结论 RAS双轴[ACE/AngⅡ/AT1R轴和ACE2/Ang(1-7)/MAS轴]在正常与INFH患者骨组织局部中表达差异,可能参与调节局部骨转换及骨坏死的进程,为后续研究及诊疗提供新的思路。
[关键词] 股骨头缺血性坏死;非创伤性;肾素-血管紧张素系统;骨转换
[中图分类号] R681 [文献标识码] A [文章编号] 1673-7210(2020)10(b)-0004-06
[Abstract] Objective To investigate the influence of renin angiotensin (RAS) biaxial on patients with ischemic necrosis of the femoral head (INFH). Methods From October 2015 to June 2017, 90 patients underwent femoral head replacement in the Department of Orthopedics in Union Hospital Affiliated to Tongji Medical College of Huazhong University of Science and Technology and Suizhou Central Hospital in Hubei Province were selected. Among them, 45 patients with INFH were served as INFH group, and 45 patients with postoperative traumatic femoral neck fracture were served as control group. The expressions of angiotensin converting enzyme (ACE), angiotensin Ⅱ (Ang Ⅱ), angiotensin Ⅱ-1 receptor (AT1R), ACE2, Ang (1-7), Mas receptor (Mas-R) in the circulating blood of two groups were detected before operation, and the expressions of ACE, AngⅡ, AT1R, ACE2, Mas-R, receptor activator of NF-κB ligand (RANKL) and osteoprotegerin (OPG) mRNA in local bone tissue of femoral head were detected after operation, and immunohistochemical analysis was performed. Results There were no significant differences in the expressions of ACE, AngⅡ, AT1R, ACE2, Ang(1-7) and Mas-R between two groups (P > 0.05). The mRNA expression levels of ACE2, Mas-R and OPG in local bone tissue of femoral head in INFH group were lower than those in control group (P < 0.05), while the mRNA expression levels of ACE, AngⅡ, AT1R, RANKL and RANKL mRNA/OPG mRNA were higher in INFH group than those in control group (P < 0.05). Compared with control group, HE staining of bone tissue in INFH group showed hyperplasia of adipocytes, thinning of bone trabeculae, pyknosis and deep staining of bone nucleus, and obvious increase of empty bone lacunae; Masson staining of bone tissue in INFH group showed that dark blue became lighter and more disordered, showing the decrease of collagen structure and obvious hyperplasia of fibrous structure. The results of immunohistochemistry showed that the expressions of ACE and AT1R were higher in INFH group than those in control group, while the expressions of ACE2 and Mas-R were lower than those of control group. There were significant differences in the percentage of positive expression area of ACE, AT1R, ACE2 and Mas-R between two groups (P < 0.05). Conclusion Some components of RAS biaxial in local bone tissue of INFH patients are abnormally expressed, which may be involved in the process of local bone turnover and osteonecrosis, providing new ideas for the follow-up study and diagnosis and treatment.
[Key words] Femoral head ischemic necrosis; Nontraumatic; Renin angiotensin system; Bone turnover
非创伤性股骨头缺血性坏死(INFH)的发病机制可能与局部微循环障碍、局部无菌性炎症反应、局部氧化应激反应、局部骨代谢异常等有关[1-4]。因此,医学界对股骨头局部微循环及骨代谢具有级联效应的调节因子探讨是寻求诊治的关键点。有研究显示,骨组织局部肾素-血管紧张素系统(RAS)经典轴血管紧张素转换酶(ACE)/血管紧张素Ⅱ(AngⅡ)/血管紧张素Ⅱ-1受体(AT1R)可对局部微循环[5]、局部炎症反应[6]、局部氧化应激反应[7]及局部骨转换的调节作用[8]产生影响。随着研究的深入,ACE2/Ang(1-7)/Mas轴作为反向调节RAS的新支路成为研究热点,Ang(1-7)与Mas受体(Mas-R)结合后可发挥血管舒张,并具有抗炎、抗氧化应激、抑制粥样斑块形成、抗血栓形成等作用。循环血及骨组织局部RAS双轴[ACE/AngⅡ/AT1R轴和ACE2/Ang(1-7)/MAS轴]在INFH发生、发展中扮演的角色如何不得而知。故本研究欲初步探讨RAS双轴在正常与INFH患者循环血及股骨头局部骨组织中的表达情况,推测RAS双轴对INFH的影响,为后续研究及临床诊治提供新的思路。
1 资料与方法
1.1 一般资料
选取2015年10月—2017年6月于华中科技大学同济医学院附属协和医院及湖北省随州市中心医院骨科行股骨头置换术的90例患者,其中45例INFH患者作为INFH组,45例创伤性股骨颈骨折术后患者作为对照组。记录所有患者的一般情况,包括性别、年龄、体重指数(BMI)、血压等资料。INFH组诊断标准及排除标准参照笔者前期临床试验[9]。本研究已经武汉协和医院研究中心伦理委员会批准,所有参加本研究的受试者均表示同意并签署知情同意书。
1.2 方法
1.2.1 患者血清RAS双轴各组分表达情况的检测 所有受试者均空腹抽取肘正中静脉血,将采集的标本离心15 min(4℃,4000 r/min,离心半径13.5 cm),并将分开的一部分标本保存于-70℃冰箱内备用,统一采用酶联免疫吸附法测定患者血清ACE、AngⅡ、AT1R、ACE2、Ang(1-7)及Mas-R的表达情况。
1.2.2 骨组织局部RAS双轴各组分及骨保护素(OPG)、破骨细胞分化因子(RANKL)mRNA的检测 总RNA抽提参考文献[7]。反转录及定量PCR严格按试剂盒(FastStart Universal SYBR Green Master,Rox,Roche,Cat.No.04913914001)说明书操作,引物由Invitrogen Biotechnology Co., LTD中国公司合成[10-11],相关信息见表1。
1.2.3 骨组织HE、Masson染色及免疫组织化学检测 HE、Masson染色参照试剂盒(美伦生物技术有限公司,MB9898、MA0123)说明书操作。ACE、AT1R、ACE2及Mas-R四个抗体一抗均属于抗兔或鼠及抗人通用型抗体,均购于Abcam公司,编号分别为ab28311、ab18801、ab15348、ab236754。步骤依次为抗原修复、阻断内源性过氧化物酶、血清封闭、加一抗、加酶标二抗、加显色剂、复染、脱水、封片及镜检拍照:晾干的切片可以在显微镜下采集图像并分析。数据分析:每组每次取8张切片,每张切片拍一张照片,MIQAS医学图象定量分析系统进行分析,以棕黄色染色为阳性表达,将10倍视野均分为3个区,记录3个区内的阳性产物数目及总面积,分别算出3个区的阳性细胞数目比率(阳性细胞数/总面积),取其平均值为此标本的阳性细胞数的百分比。
1.3 统计学方法
采用SPSS 16.0软件进行数据统计分析,计量资料用均数±标准差(x±s)表示,组间比较采用独立样本t检验;计数资料采用χ2检验。以P < 0.05为差异有统计学意义。
2 结果
2.1 兩组患者一般情况比较
两组性别、年龄、BMI、血压比较,差异均无统计学意义(P > 0.05)。见表2。
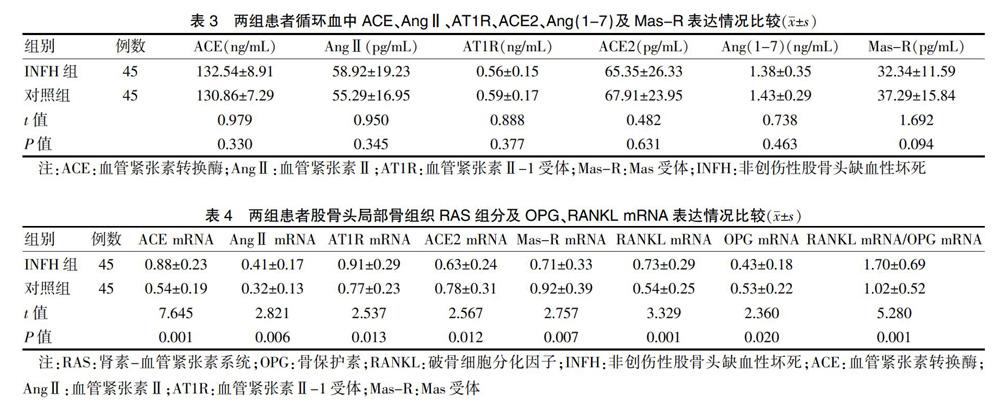
2.2 两组患者循环血中ACE、AngⅡ、AT1R、ACE2、Ang(1-7)及Mas-R表达情况比较
两组循环血中ACE、AngⅡ、AT1R、ACE2、Ang(1-7)及Mas-R表达情况比较,差异均无统计学意义(P > 0.05)。见表3。
2.3 两组患者股骨头局部骨组织RAS组分及OPG、RANKL mRNA表达情况比较
INFH组股骨头局部骨组织ACE2、Mas-R、OPG mRNA表达水平均低于对照组(P < 0.05),而ACE、AngⅡ、AT1R、RANKL mRNA及RANKL mRNA/OPG mRNA表达水平均高于对照组(P < 0.05)。见表4。
2.4 两组患者股骨头局部骨组织HE、Masson染色情况比较
两组股骨头局部骨组织HE、Masson染色分析:与对照组比较,INFH组骨组织HE染色显示组织内脂肪细胞增生,骨小梁变细,骨细胞核固缩、深染,骨陷窝空虚明显增多;INFH组骨组织Masson染色显示深蓝色变浅,较为杂乱,显示胶原结构减少、纤维结构明显增生。见图1(封三)。
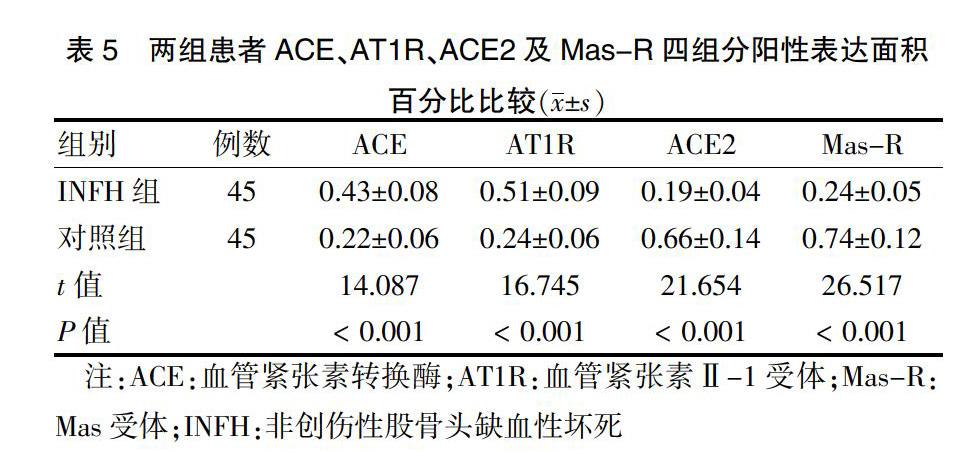
2.5 两组患者股骨头局部骨组织免疫组织化学检测结果比较
两组股骨头局部骨组织免疫组织化学检测结果:RAS双轴相关组分和INFH密切相关,免疫组化结果提示INFH组骨组织中ACE及AT1R表达较对照组高,而ACE2及Mas-R表达水平低于较对照组。见图2。两组ACE、AT1R、ACE2及Mas-R四组分阳性表达面积百分比比较,差异有统计学意义(P < 0.05)。见表5。
3 讨论
经典的RAS是调控和维持机体内环境稳定的重要体液调节系统,包括肾素、肾素受体、ACE、血管紧张素原(AGT)、AngⅡ及其受体等。RAS双轴对INFH的影响有待进一步证实。①RAS经典轴可能对INFH局部骨组织微循环的影响:组织细胞中的RAS激活产生的AngⅡ与其受体结合后产生强烈的缩血管作用[12],可使骨组织局部微血管持续痉挛,使骨组织处于缺血、缺氧状态,导致骨组织微循环障碍,进一步激活RAS,造成恶性循环。②促进炎症反应:AngⅡ上调血管渗透因子基因表达,诱导巨噬细胞分泌TNF-α、IL-6等致炎细胞因子,导致炎症的级联扩增,导致骨组织水肿、炎症细胞浸润和血管通透性增加[13-15],可能加重INFH的进展。③介导氧化应激反应:AngⅡ与其AT1R结合,在细胞信息传递中激活烟酰胺腺嘌呤二核苷酸磷酸氧化酶产生活性氧,促进细胞因子的活化并产生大量氧自由基,引起细胞坏死或凋亡[16],可造成局部骨组织功能障碍甚至坏死。④调节骨代谢作用:AngⅡ可通过ERK信号通路诱导成骨细胞表达、分泌RANKL,上调RANKL/OPG比值,并促进其与表达于破骨前体细胞表面的RANK结合,同时,促使其分化为成熟有活性的破骨细胞,发挥骨吸收的作用,AngⅡ的作用可被其Ⅰ型受体拮抗剂奥美沙坦所阻断[17]。体内外实验证实AngⅡ还能提高成骨细胞分泌血管内皮生长因子(VEGF),从而促进破骨细胞的成熟、分化以及破骨细胞介导的骨吸收作用[18]。ACE2/Ang(1-7)/Mas新轴是近年来研究较热的RAS另一重要分支,ACE2是新轴中的关键酶,主要催化AngⅡ转化为Ang(1-7),ACE2的作用与ACE截然相反,是RAS中的负性调节因子,具有舒张血管、抗炎、保护血管内皮等作用[19-23]。
本研究结果显示,循环血中RAS各组分水平在正常及INFH患者中无明显差异,但INFH组患者股骨头局部ACE2及Mas-R mRNA的表达水平明显低于对照组(P < 0.05),而ACE、AngⅡ及AT1R mRNA的表達水平明显高于对照组(P < 0.05)。究其原因可能为组织中的RAS的基因转录和表达,并不依赖于循环血中的肾素、ACE和AGT,而是一个自我调控的独立系统,并且通过自分泌和旁分泌的方式对局部组织产生生物学作用[24],故本研究得出骨组织局部RAS组分的差异表达。本研究还得出INFH患者股骨头局部OPG mRNA的表达水平明显低于对照组(P < 0.05),而RANKL mRNA的表达水平及RANKL mRNA/OPG mRNA比值明显高于对照组(P < 0.05),且研究还发现,INFH患者股骨头局部ACE2及Mas-R mRNA的表达水平明显低于对照组(P < 0.05),而ACE、AngⅡ及AT1R mRNA的表达水平明显高于对照组(P < 0.05)。RAS双轴各组分的差异性表达与OPG mRNA、RANKL mRNA及RANKL mRNA/OPG mRNA比值是否存在一定的关联仍不得而知。究其原因,主要是由于本临床研究样本量偏少及实验难度较大(如未使用阻断剂干预研究)等因素影响,尚不足以分析明确此问题,这也是本研究存在的缺陷之一。但结合前期及其他学者近期骨组织局部RAS与骨代谢的调控相关性的热点研究,推测两者之间可能存在一定的关系。如有学者的研究显示,AngⅡ可通过上调成骨细胞表面的RANKL从而间接增强破骨细胞前体细胞的分化成熟并活化其破骨作用[25]。一项研究显示,OP小鼠经服ACEI药物后,可通过调控骨组织局部RANKL、OPG mRNA表达,从而改善骨组织负骨转换状态[10]。另一项临床研究显示,在骨组织局部部分RAS组分与BMD有一定的相关性,可能通过RANKL/OPG信号传导通路调节骨代谢[16],据此,骨组织RAS组分是调控骨代谢的一个重要局部调节系统。本研究还存在一个缺陷,由于样本量较少,故INFH患者没有根据其病因区分为酒精性、激素性及特发性INFH进行研究,后期可再此基础上进一步深入进行研究。
综上所述,本研究初步探讨了RAS双轴与骨转换标志物RANKL、OPG及RANKL/OPG在INFH及正常股骨头局部骨组织中的差异表达,研究显示,INFH患者骨组织局部RAS双轴各组分的异常表达,可能影响骨转换相关调控因子OPG mRNA、RANKL mRNA及RANKL mRNA/OPG mRNA比值,从而影响INFH的病理进展,至于RAS双轴是否对局部炎症因子产生影响,是否影响氧化应激反应,是否对局部微循环产生影响等不得而知,此初步结论为后续研究及临床诊治提供基础及新的思路。
[参考文献]
[1] 于冬冬,杨关林,侯德才.骨头缺血性坏死的病因及分期辨证论治[J].辽宁中医杂志,2019,46(11):2338-2340.
[2] 邓爽,彭昊.激素性股骨头坏死发生机制的新认识[J].中国医药导报,2017,14(34):29-32.
[3] 陈俊名,岳辰,范亚楠,等.股骨头坏死动物造模研究进展[J].中国医药导报,2020,17(9):25-28.
[4] 于长岁,张晓峰,徐西林,等.microRNA在股骨头坏死防治中的研究进展[J].中国医药导报,2017,14(27):48-51.
[5] Metta S,Uppala S,Basalingappa DR,et al. Association of Angiotensin converting enzyme gene insertion / deletion polymorphism with risk of ischemic heart disease in a population of smokers in southern India [J]. J Clin Diagn Res,2015,9(4):1-4.
[6] Li Y,Zeng Z,Cao Y,et al. Angiotensin-converting enzyme 2 prevents lipopolysaccharide induced rat acute lung injury via suppressing the ERK1/2 and NF-κB signaling pathways [J]. Sci Rep,2016,6:27911.
[7] Li Y,Cao Y,Zeng Z,et al. Angiotensin-converting enzyme 2/angiotensin-(1-7)/Mas axis prevents lipopolysaccharide-induced apoptosis of pulmonary microvascular endothelial cells by inhibiting JNK/NF-κB pathways [J]. Sci Rep,2015,5:8209.
[8] Abuohashish HM,Ahmed MM,Sabry D,et al. Angiotensin (1-7) ameliorates the structural and biochemical alterations of ovariectomy-induced osteoporosis in rats via activation of ACE-2/Mas receptor axis [J]. Sci Rep,2017,7(1):2293.
[9] 沈霖,馬陈,帅波,等.加味青娥丸对非创伤性股骨头坏死患者脂联素信号转导通路相关受体和饥饿素表达的影响[J].中国中医骨伤科杂志,2016,24(8):5-10.
[10] 帅波,沈霖,杨艳萍,等.血管紧张素转换酶抑制剂对去卵巢骨质疏松小鼠骨组织结构的影响[J].中华骨质疏松和骨矿盐疾病杂志,2015,8(3):229-235.
[11] Zhang Y,Wang L,Song Y,et al. Renin inhibitor aliskiren exerts beneficial effect on trabecular bone by regulating skeletal renin-angiotensin system and kallikrein-kinin system in ovariectomized mice [J]. Osteoporos Int,2016, 27(3):1083-1092.
[12] Zhang Z,Xu G,Liu D,et al. Angiotensin-converting enzyme insertion/deletion polymorphism contributes to ischemic stroke risk: a meta-analysis of 50 case-control studies [J]. PLoS One,2012,7(10):e46495.
[13] Gaddam RR,Chambers S,Bhatia M. ACE and ACE2 in inflammation:a tale of two enzymes [J]. Inflamm Allergy Drug Targets,2014,13(4):224-234.
[14] Tao L,Qiu Y,Fu X,et al. Angiotensin-converting enzyme 2 activator diminazene aceturate prevents lipopolysaccharide-induced inflammation by inhibiting MAPK and NF-κB pathways in human retinal pigment epithelium [J]. J Neuroinflammation,2016,13(1):35.
[15] Jin HY,Song B,Oudit GY,et al. ACE2 deficiency enhances angiotensin Ⅱ-mediated aortic profilin-1 expression, inflammation and peroxynitrite production [J]. PLoS One,2012,7(6):e38502.
[16] Shuai B,Yang YP,Shen L,et al. Local renin-angiotensin system is associated with bone mineral density of glucocorticoid-induced osteoporosis patients [J]. Osteoporos Int,2015,26(3):1063-1071.
[17] Oz H,Gavish D,Hass A,et al. Effect of angiotensin Ⅱ receptor blockers,candesartan,on osteoprotegerin level in hypertensive patients:link between bone and RAAS [J]. J Renin Angiotensin Aldosterone Syst,2015,16(3):547-552.
[18] Shen L,Ma C,Shuai B,et al. Effects of 1,25 dihydroxyvitamin D3 on the local bone renin angiotensin system in a murine model of glucocorticoid induced osteoporosis [J]. Exp Ther Med,2017,13(6):3297-3304.
[19] Krishnan B,Smith TL,Dubey P,et al. Angiotensin-(1-7) attenuates metastatic prostate cancer and reduces osteoclastogenesis [J]. Prostate,2013,73(1):71-82.
[20] Pernomian L,Pernomian L,Baraldi Araújo Restini C. Counter-regulatory effects played by the ACE-Ang Ⅱ-AT1 and ACE2-Ang-(1-7)-Mas axes on the reactive oxygen species-mediated control of vascular function:perspectives to pharmacological approaches in controlling vascular complications [J]. Vasa,2014,43(6):404-414.
[21] Iwai M,Horiuchi M. Devil and angel in the renin–angiotensin system:ACE-angiotensin Ⅱ-AT1 receptor axis vs. ACE2-angiotensin-(1-7)-Mas receptor axis [J]. Hypertens Res,2009,32(7):533-536.
[22] Lu CL,Wang Y,Yuan L,et al. The angiotensin-converting enzyme 2/angiotensin (1-7)/ Mas axis protects the function of pancreatic β cells by improving the function of islet microvascular endothelial cells [J]. Int J Mol Med,2014,34(5):1293.
[23] Pantzaris ND,Karanikolas E,Tsiotsios K,et al. Renin inhibition with aliskiren:a decade of clinical experience [J]. J Clin Med,2017,6(6):61.
[24] Culver S,Li C,Siragy HM. Intrarenal angiotensin-converting enzyme:the old and the new [J]. Curr Hypertens Rep,2017,19(10):80.
[25] Zhang FY,Yang FJ,Yang JL,et al. Renin inhibition improves ovariectomy-induced osteoporosis of lumbar vertebra in mice [J]. Biol Pharm Bull,2014,37(12):1994-1997.
(收稿日期:2020-03-14)
