蓝刺头多糖提取工艺优化及其抗氧化活性
2020-12-09史晓宇高珍珍
史晓宇,高珍珍,张 超,杨 英
(内蒙古农业大学兽医学院,内蒙古呼和浩特 010018)
蓝刺头(EchinopslatifoliusTausch,ET)为菊科蓝刺头属植物,主要分布在中国、蒙古、西伯利亚等地区。根和花序皆可入药,干燥根为中药“禹州漏芦”,可清热解毒、舒筋通脉、消痈、下乳;干燥花序为蒙药“蓝刺头”,蒙古语名“扎日阿-乌拉”,可愈伤、固骨质、清热止痛[1]。研究发现,蓝刺头中含有生物碱、噻吩类、挥发油类、黄酮类等多种化合物,具有保肝、抗炎、杀虫、抗肿瘤等多种药理活性[2],具有良好应用开发前景。蓝刺头多糖(EchinopslatifoliusTausch polysaccharide,ETP)为蓝刺头所含有的高分子化合物。研究表明,具有多种生物活性,如降血糖、抗氧化、改善脂代谢[3-5]等,可作为功能性食品的潜在原料。
大量研究表明,机体衰老、慢性疾病及癌症均与自由基有密切关系[6],自由基参与的氧化反应会损伤核酸、碳水化合物、脂类及蛋白质,从而对机体产生影响[7-8]。自由基具有极强的氧化反应能力[9],能通过氧化作用来攻击机体内的大分子物质,产生过氧化反应,对机体造成不可逆损伤[10-12]。因此多糖的清除自由基能力常作为评价其抗氧化活性的重要指标[13]。相关研究表明,蓝刺头粗多糖具有较强还原能力及一定的清除有机自由基能力[14]。多糖的提取方法众多,其中溶剂提取法简单、成本低、应用最为广泛[15],但对于提取工艺研究,目前主要集中在蓝刺头总黄酮的提取,多糖未有系统的提取条件研究。因此,本研究选用溶剂提取法,通过响应面实验筛选出最佳提取条件。
本实验选取干燥的蓝刺头花序为原料,通过响应面法对蓝刺头多糖提取工艺进行优化,旨在提高多糖得率,为工业化生产提供参考;对蓝刺头多糖抗氧化活性进行初步探究,为开发与利用蓝刺头多糖类食品奠定良好基础。
1 材料与方法
1.1 材料与仪器
蓝刺头 采自内蒙古呼和浩特市,由内蒙古农业大学中兽医教研室鉴定;无水乙醇、无水葡萄糖、苯酚、浓硫酸、冰乙酸、抗坏血酸(VC) 均为分析纯;抗超氧阴离子试剂盒、羟自由基测试盒 南京建成生物工程研究所;1,1-二苯基-2-三硝基苯肼(DPPH) 上海麦克林生化科技有限公司。
CU-600型电热恒温水槽 上海一恒科学仪器有限公司;RE-52AA旋转蒸发器、SHZ-Ⅲ型循环水真空泵 上海亚荣生化仪器厂;GZX-9146 MBE数显鼓风干燥箱 上海博迅实业有限公司医疗设备厂;CP213电子天平 奥豪斯仪器有限公司;热电冷冻干燥机 美国Thermo Fisher Scientific;全功能酶标仪 美国Synergy H4 Hybrid。
1.2 实验方法
1.2.1 ETP的提取 将采摘后的蓝刺头花序放于60 ℃烘干至恒重,采用水提醇沉法提取蓝刺头多糖。步骤为在一定温度和时间下水提,三层纱布对水提液进行过滤,旋转蒸发仪进行浓缩(温度55 ℃,转速50 r/min),用95%乙醇进行醇沉,静置过夜,弃掉上清液,真空冷冻干燥,收集,称重。
1.2.2 标准曲线的制作和多糖含量的测定 采用苯酚-硫酸法测定多糖含量。精密称取105 ℃干燥至恒重的葡萄糖100 mg,加蒸馏水溶解并定容至100 mL,作为标准品溶液。精密量取标准品溶液0.5、1.0、2.0、3.0、4.0、5.0 mL,分别置于50 mL容量瓶中,加蒸馏水定容。精密量取上述各溶液80 μL置96孔微量反应板中,分别加5%苯酚溶液40 μL,迅速滴加浓硫酸200 μL,吹打摇匀,冷却至室温后,用酶标仪测定490 nm处的OD值。以标准品浓度(x,%)为横坐标、吸光度(y)为纵坐标,绘制标准曲线如,得回归方程为y=9.6115x+0.1204(R2=0.9937)。精密称取蓝刺头多糖10 mg,加蒸馏水10 mL溶解成1 mg/mL,取80 μL置96孔微量反应板中,加5%苯酚溶液40 μL,迅速滴加浓硫酸200 μL,吹打摇匀,冷却至室温后,用酶标仪测定490 nm处的吸光度y值,将平均y值代入回归方程,计算样品多糖含量。
多糖得率计算公式为:
多糖得率(%)=粗多糖质量(g)/原料质量(g)×100
1.2.3 单因素实验 采用水提醇沉法提取蓝刺头多糖,测定多糖得率。选取料液比(1∶15、1∶20、1∶25、1∶30、1∶35 g/mL)、提取时间(1.0、1.5、2.0、2.5、3.0 h)、提取温度(60、70、80、90、100 ℃)、提取次数(1、2、3、4次)、醇沉浓度(70%、75%、80%、85%、90%)做单因素试验,对蓝刺头多糖提取工艺进行优化,其中固定因素水平为料液比1∶25 g/mL、提取时间2.0 h、提取温度80 ℃、提取次数2次、醇沉浓度80%。
1.2.4 响应面试验 在单因素实验的基础上,选择影响较显著的三个因素料液比、提取温度和提取时间为自变量,以多糖得率为响应值,使用响应面软件 Design-Expert8.0.6.1中Box-Behnken的设计方法,进行三因素三水平试验设计,优化蓝刺头多糖提取工艺。各组试验的编码水平与取值见表1。当P<0.05,该模型和回归系数被认为差异性显著。

表1 响应面分析因素水平

1.2.5.1 ETP对二苯代苦味酰基自由基(DPPH·)清除能力的测定 通过酶标仪在517 nm波长处检测吸光度值,计算样品清除DPPH·自由基的能力。取0.001953~0.125 mg/mL多糖溶液100和100 μL DPPH溶液加入96孔微量反应板,于室温避光反应30 min。相应浓度的抗坏血酸(VC)作为阳性对照,蒸馏水代替多糖溶液的反应体系为空白,并设置本底对照,使用酶标仪检测517 nm波长处的吸光值,根据公式(1)计算ETP对DPPH·的清除率。(A0为空白吸光值,Ax为样品吸光值,Am为本底对照吸光值。)
清除率(%)=[A0-(Ax-Am)]/A0×100
式(1)
1.2.5.2 ETP对羟自由基(·OH)清除能力的测定 根据试剂盒说明书操作,取0.0625~1.0 mg/mL多糖溶液100和300 μL反应体系于37 ℃反应1 min,迅速加入1000 μL显色剂,室温放置20 min,取200 μL加入96孔微量反应板。相应浓度的抗坏血酸(VC)作为阳性对照,蒸馏水代替多糖溶液的反应体系为空白,并设置本底对照,使用酶标仪检测550 nm波长处的吸光值,根据公式(1)计算ETP对·OH的清除率。
1.3 数据处理
2 结果与分析
2.1 单因素实验
2.1.1 料液比对多糖得率的影响 料液比对多糖得率的影响见图1。由图1可知,在料液比为1∶20时,得率达到顶峰0.86%,随后下降。可能的原因是料液比较小时,短时间内多糖的溶出达到平衡,不利于多糖进一步溶出;而料液比太大时,受溶解度的约束作用变小,且溶剂用量过多导致后续蒸发困难,使得提取得率呈现下降趋势[16-17]。该因素对多糖得率影响显著(P<0.05),且料液比为1∶20时提取效果最好,故选择料液比1∶15、1∶20、1∶25做后续响应面试验。

图1 料液比对多糖得率的影响
2.1.2 提取时间对多糖得率的影响 提取时间对多糖得率的影响见图2。由图2可知,随着提取时间增加,多糖得率有所上升,在提取时间为2 h时达到顶峰0.78%,随后有所下降。可能的原因是初期多糖在溶剂中的浓度低,主要成分在蓝刺头组织中,内外浓度梯度大,导致多糖溶出的速率较快;随着时间增加,多糖浓度梯度持续减小,从而使得溶出率减缓至不再增加[18];也可能是由于细胞内的蛋白质等其他大分子穿透细胞膜,对多糖的溶出产生阻力[19]。该因素对多糖得率影响显著(P<0.05),且提取时间为2 h时提取效果最好,故选择提取时间2.0、2.5、3.0 h做后续响应面试验。
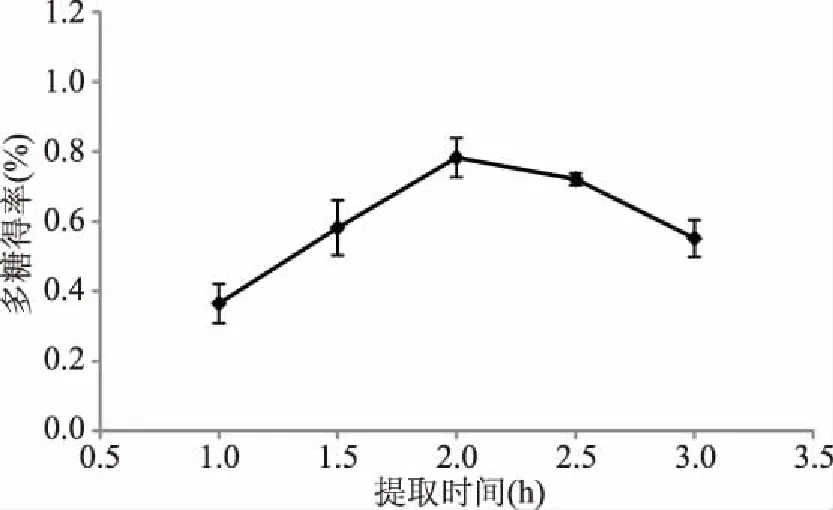
图2 提取时间对多糖得率的影响
2.1.3 提取温度对多糖得率的影响 提取温度对多糖得率的影响见图3。由图3可知,随着提取温度上升,多糖得率有所上升,在提取温度为90 ℃时达到顶峰0.82%,随后趋于平缓。可能的原因是过高的温度对多糖的提取影响不明显[20]。一定范围内,该因素对多糖得率影响显著(P<0.05),且提取温度为90 ℃时提取效果最好,故选择提取温度80、90、100 ℃做后续响应面试验。
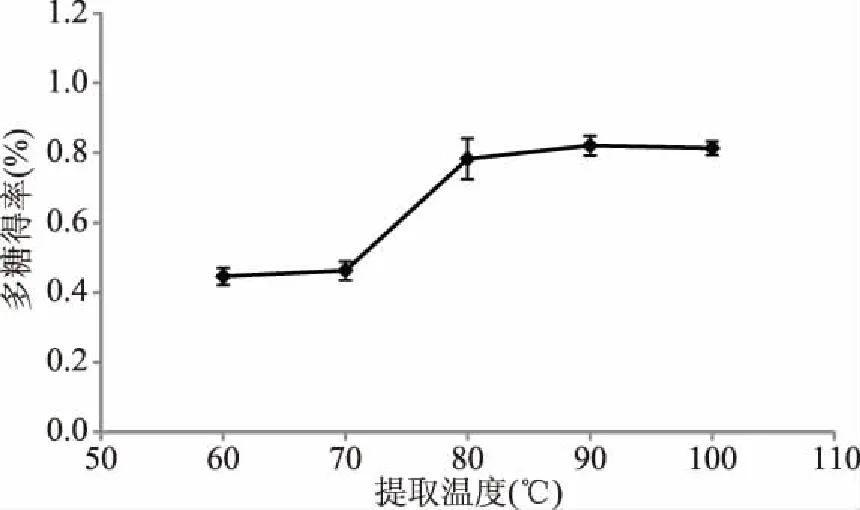
图3 提取温度对多糖得率的影响
2.1.4 提取次数对多糖得率的影响 提取次数对多糖得率的影响见图4。由图4可知,随着提取次数增加,多糖得率有所上升,在提取次数为4次时达到顶峰1.13%。提取2次与3次差异较小,考虑实际生产效率与成本,后续响应面试验提取次数固定为2次。

图4 提取次数对多糖得率的影响
2.1.5 醇沉浓度对多糖得率的影响 醇沉浓度对多糖得率的影响见图5。由图5可知,随着醇沉浓度增加,多糖得率有所上升,在醇沉浓度为80%时达到小高峰0.82%,醇沉浓度为90%时达到顶峰1.06%。但考虑实际生产效率与成本,后续响应面试验醇沉浓度固定为80%。

图5 醇沉浓度对多糖得率的影响
2.2 响应面试验
2.2.1 响应面试验结果 试验设计及结果见表2。

表2 响应面设计及结果

方差分析结果见表3。回归模型的P<0.05,说明该模型的可信度水平大于99.50%;失拟项P>0.05,不显著,说明该模型与实际实验值拟合良好,回归方程可近似替代实验真实点[21]。同时由对多糖得率的回归系数检验值F的大小可知,在试验范围内,各因素对多糖得率影响的大小顺序依次为:X3(提取温度)>X1(料液比)>X2(提取时间)。

表3 方差分析和显著性检验
该二次回归模型的决定系数R2为0.9467,说明试验结果和回归方程有94.67%的拟合;矫正决定系数AdjR2为0.8781,表示该模型可以解释87.81%响应值的变化;预测决定系数PredR2为0.7906,表示该模型预测值的能力良好;信躁比Adeq Precision为14.4905,表明该模型是可取的,可以应用于工艺优化[22]。
将数据利用Design-Expert 8.0.6.1 进行3D图形绘制,做出料液比(X1)、提取时间(X2)以及提取温度(X3)对多糖得率影响的响应曲面图及等高线图,见图6。曲面图可以预测和检验变量的响应值,确定变量间相互关系。响应面坡度越陡,表示各因素间的交互作用对响应值的影响越显著,坡度越缓,表示各因素间交互作用对响应值的影响不显著;等高图可以反映变量交互效应的强弱。等高线越密集,表示二者交互作用对响应值的影响越显著,等高线越稀疏,表示二者交互作用对响应值的影响不显著[23]。

图6 不同交互作用对多糖得率的响应面图
通过响应面的陡峭程度可以发现,提取温度对蓝刺头多糖得率的影响最大,其次是提取时间和料液比。由图6A可知,当提取温度一定时,料液比与提取时间的响应曲面曲率均变化不大,说明两者对响应值的影响不大。其等高线图显示两因素呈非明显的椭圆形状,两者交互作用不显著[24]。由图6B可知,当提取时间一定时,料液比使得响应面坡面变化较缓,响应值受到料液比的影响较小[25],而提取温度的变化使得坡面曲率变化较大,其对响应值的影响较大,料液比与提取时间之间的交互作用不显著。由图6C可知,当料液比一定时,提取时间的变化对响应值的影响较小,而提取温度的变化对响应曲面的坡面曲率影响较大,提取时间与提取温度之间的交互作用不显著。
通过软件分析,料液比为1∶20 g/mL、提取时间为2 h、提取温度为100 ℃为最佳提取条件,预测多糖得率为1.19%。
2.3 验证实验
在料液比1∶20 g/mL、提取时间2 h、提取温度100 ℃、提取次数2次、醇沉浓度80%的条件下进行三次平行验证实验,测得多糖得率平均值为1.191%,与理论得率值相近。该值与预测值相近,表明回归模型可靠。
2.4 抗氧化活性测定结果
2.4.1 ETP对二苯代苦味酰基自由基(DPPH·)清除能力的测定 最大半效应浓度EC50计算结果显示,VC(0.0061 mg/mL)<多糖(0.0259 mg/mL)。从图7A可以看出,在0.001953~0.125 mg/mL的多糖浓度范围内,多糖的清除率由15.91%上升到93.69%。在试验浓度范围内,VC的清除能力高于多糖。
2.4.2 ETP对羟自由基(·OH)清除能力的测定 EC50计算结果显示,多糖(0.1207 mg/mL)
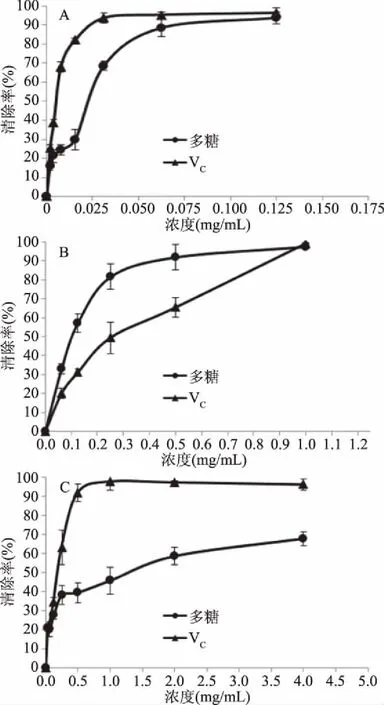
图7 ETP对三种自由基的清除作用
3 讨论与结论
本研究在单因素实验的基础上,比较各影响因素,分析三个影响效果显著的因素及影响程度,结合Box-Behnken分析,建立优化水提醇沉法提取蓝刺头多糖的数学模型[26]。研究得出水提醇沉法提取蓝刺头多糖的最佳工艺条件,为进一步深入研究蓝刺头多糖提供了参考依据,该方法在提高得率的同时,有效保护了多糖的抗氧化活性,研究结果为蓝刺头多糖作为功能性原料用于食品工业提供了技术支持和理论数据。
