流苏子多糖的提取分离、理化性质及体外α-葡萄糖苷酶抑制活性
2020-12-09马天晓尹震花张翠利刘会利张金香郭玮玮
马天晓,尹震花,张翠利,刘会利,张金香,郭玮玮,陈 林,*
(1.黄河科技学院,郑州市天然产物合成生物学重点实验室,河南省小分子新药研发国际联合实验室,河南郑州 450063;2.黄河科技学院附属医院药学部,河南郑州 450063)
多糖(Polysaccharide)是由10个以上的单糖通过糖苷键连接而成的。在自然界中,许多天然药物中的多糖具有较强的生物活性,如抗氧化活性[1]、抗血栓[2]、抗免疫活性[3]、抗糖化活性[4]、抗肿瘤活性[5]、改善便秘[6]等活性。
流苏子为木犀科(Oleaceae)流苏树属(Chionanthus)植物,产于甘肃、陕西、山西、河北、河南以南至云南、四川、广东、福建、台湾。生长于海拔100~1450 m处的山地或丘陵的林中或灌丛中。朝鲜、日本也有分布[7]。目前对流苏的研究主要在栽培技术和园林绿化上[8],对于流苏的药用价值和化学成分研究主要集中在流苏花及其根皮部。化学成分主要含有黄酮类、木脂素、三萜类、甾醇类等成分[9-13]。目前还未见对流苏子多糖的研究,其药理活性成分尚不明确。
本实验采用水提醇沉法从流苏子中提取粗多糖,再经Sevage法除蛋白和DEAE-52纤维、Sephadex G-100凝胶进行分离纯化,冻干得到精制多糖CRp-1,采用化学和仪器分析方法研究其理化性质,并通过体外实验研究其对α-葡萄糖苷酶的抑制活性,为其进一步研究开发利用提供基础。
1 材料与方法
1.1 材料与仪器
流苏种子 于2016年8月~9月采集于太行山区,由河南农业大学林学院刘震教授鉴定为木犀科流苏树属流苏树(Chionanthusretusus)的种子,标本存于黄河科技学院;石油醚、无水乙醇 天津市津东天正精细化学试剂厂;浓硫酸 开封方晶化工厂;苯酚 天津凯通化学试剂有限公司;D(+)-葡萄糖(Glc)、D(+)-木糖(Xyl)、L(+)-阿拉伯糖(Ara)、L(+)-鼠李糖(Rha)、D(+)-甘露糖(Man)、D-半乳糖(Gal) 德国Dr Ehrenstorfer GmbH公司;DEAE-52纤维素 赛谱锐思(北京)科技有限公司;Sephadex G-100 瑞典GE Healthcare Bio-Science AB公司;α-葡萄糖苷酶 Sigma-aldrich有限公司;对硝基苯-α-葡萄糖吡喃苷、三氟乙酸、硼氢化钠 阿拉丁试剂(上海)有限公司;超纯水 实验室自制。
日立U-4100型紫外可见分光光度计 Thermo公司;LL-1500型冷冻干燥仪器、TRACE 1310气相色谱仪 美国Thermo公司;Waters 2698高效液相色谱(high performance liquid chromatography,HPLC)仪 沃特世科技(上海)有限公司;Thermo Scientific Nicolet iS5傅里叶变换红外光谱仪 美国Nicolet公司;EnVision多标记微孔板检测系统 美国PerKinElmer公司;SQP分析天平 赛多利斯科学仪器(北京)有限公司;FEI Quanta 250 FEG场发射扫描电子显微镜 美国FEI Quanta 250 FEG公司。
1.2 实验方法
1.2.1 流苏子多糖的提取和纯化 取流苏种子2000 g粉碎,用石油醚浸泡脱脂2次,每次2 d,提取2次,回收石油醚,残渣挥发至无醚味,用70%乙醇浸泡2次,每次2 d,回收乙醇,残渣挥发干至无醇味,以纯水为提取溶剂,80 ℃加热提取2次,每次4 h,合并滤液,浓缩至一定体积后,加入无水乙醇调至乙醇浓度为70%±2%,4 ℃静置过夜,4 000 r/min离心10 min,收集沉淀,沉淀复溶,冷冻干燥,得到流苏子粗多糖。
采用Sevage法除蛋白[14],重复5次除蛋白,蛋白基本上除完;除蛋白后的多糖经DEAE-52纤维素柱色谱(60 cm×2.5 cm)分离,分别用0.00、0.05、0.15、0.25 mol/L的NaCl溶液进行梯度洗脱,采用苯酚-硫酸法[15]检测洗脱液中的含糖量,在490 nm处测定洗脱液的吸光度(A),绘制洗脱曲线,同一洗脱峰合并,浓缩,透析袋透析48 h除去小分子杂质;再经Sephadex G-100柱色谱(100 cm×1.5 cm),超纯水洗脱,同样采用苯酚-硫酸法检测洗,490 nm处测定A值,合并、浓缩,冻干得到精制多糖。
1.2.2 流苏子多糖的理化性质
1.2.2.1 流苏子多糖的一般理化性质 以葡萄糖为标准品,采用苯酚-浓硫酸法测定多糖CRp-1的总糖含量[15];采用考马斯亮蓝染色法测定蛋白质含量[16];测定多糖CRp-1在水中以及乙醇、正丁醇、丙酮、氯仿、石油醚等有机溶剂中的溶解度,观察溶解性;进行斐林试剂反应、三氯化铁反应、碘-碘化钾反应[17]。
彩色铅笔的笔芯和普通铅笔是不一样的,它没有使用黏土制作,而是将能涂出颜色的颜料、能使书写更顺滑的滑石粉或蜡、起凝固作用的黏合剂等和水一起充分混合,最后制造出五颜六色的彩色铅笔芯。由于没有经过普通铅笔芯的高温烧烤过程,彩色铅笔芯更加柔软。
1.2.2.2 紫外全波长扫描 取适量精制多糖配制成0.3 mg/mL溶液,在190~760 nm波长下进行紫外全波长扫描。
1.2.2.3 相对分子量测定 采用高效凝胶排阻色谱法[18]测定相对分子质量、分子半径及分散系数(Mw/Mn),检测器为示差折光检测器,色谱柱为The Shodex OHpak SB-806M HQ(300 mm×8.0 mm,i.d.),流动相为0.9% NaCl,体积流量0.5 mL/min,柱温30 ℃,进样量100 μL。
1.2.2.4 单糖组成分析 参考文献[19]报道的方法,略作修改,进行单糖组成分分析。多糖10 mg在110 ℃下用3 mL 4 mol/L三氟乙酸水解3 h,得到水解产物,水解产物与10 mg盐酸羟胺和0.5 mL吡啶在90 ℃反应30 min,再用0.4 mL乙酸酐在90 ℃乙酰化30 min得到乙酰化产物。采用气相色谱法进行单糖检测。标准单糖也用同样的方法衍生得到乙酰化产物。
1.2.2.5 红外光谱分析 取适量精制多糖加入玛瑙研钵中,加入适量溴化钾,混合研磨均匀后压制成透明薄片,使用红外光谱扫描仪从4000~400 cm-1进行扫描,记录扫描图谱,绘制红外光谱图像[20]。
1.2.2.6 刚果红实验 采用刚果红法测定多糖CRp-1的构象结构[21]。多糖CRp-1用超纯水配制成1 mg/mL的溶液。取CRp-1溶液1 mL,加入等体积的100 μmol/L刚果红试剂,通过加入1 mol/L的NaOH溶液调节混合物的不同NaOH浓度(0~0.5 mol/L)。用紫外在300~600 nm波长范围内进行扫描,测定了混合物在不同NaOH浓度下的最大吸收波长。
1.2.2.7 微观结构分析 将多糖CRp-1固定在铜根上,去掉一些没有固定到铜根上的多余样品,喷金。在15 kV加速电压下用扫描电子显微镜对多糖进行表面形貌观察,分析其微观结构[19]。
1.2.3 体外α-葡萄糖苷酶抑制活性筛选 依据参考文献[22]报道的方法,提高样品的溶液浓度,稍作修改,于405 nm波长下测吸光度,进行多糖CRp-1抑制α-葡萄糖苷酶活性筛选。阿卡波糖为阳性对照,样品初筛浓度为8 mg/mL,阳性对照初筛浓度为2 mg/mL。每个样品平行测定3次,取均值。
1.3 数据处理
2 结果与分析
2.1 流苏子多糖的提取分离
流苏子经石油醚脱脂,70%乙醇除去小分子极性成分,热水提取乙醇沉淀,除蛋白等处理后,得到除蛋白质后流苏子粗多糖,得率为0.21%。
流苏子粗多糖经DEAE-52色谱柱,超纯水和不同浓度的NaCl溶液洗脱,得到2个含量高的主峰,洗脱曲线见图1,分别合并命名为CR-1和CR-2。CR-1和CR-2经Sephadex G-100凝胶色谱柱进一步纯化,洗脱曲线见图2,CR-1纯化后得到1个主峰,且含量高,浓缩、透析、冻干得到白色粉末,命名为CRp-1;CR-2纯化也得到1个主峰,但其含糖量低,在此不做研究。

图1 流苏子粗多糖经DEAE-52纤维素柱色谱洗脱曲线

图2 CR-1经Sephadex G-100凝胶柱色谱洗脱曲线
2.2 多糖CRp-1理化性质
2.2.1 多糖CRp-1的一般理化性质 多糖CRp-1的理化性质如表1所示。CRp-1为白色粉末,易溶于水,不溶于甲醇、乙醇、正丁醇、丙酮等有机溶剂。CRp-1的总糖含量为97.12%,蛋白质含量为1.65%。Fehling试剂反应和三氯化铁反应均为阴性,表明CRp-1不含单糖和多酚;I-KI反应为阴性,说明CRp-1不是淀粉多糖。

表1 多糖CRp-1的一般理化性质
2.2.2 多糖CRp-1的紫外全波长扫描 多糖CRp-1的紫外可见全波长扫描光谱如图3所示。从图3可以看出,在190~200 nm显示多糖的特征吸收,在260和280 nm处均无明显吸收,表明多糖CRp-1中的核酸和蛋白质基本已除尽[19]。

图3 CRp-1紫外全波长扫描图
2.2.3 多糖CRp-1的相对分子量 采用高效凝胶排阻色谱法对多糖CRp-1进行分子量测定,结果如图4所示。从图4可以看出,CRp-1其峰形基本对称,CRP-1的相对分子量(Mw)为223200 g/mol,分布系数(Mw/Mn)为1.774。

表2 CRp-1的单糖组成成分

图4 CRp-1高效凝胶排阻色谱洗脱曲线
2.2.4 多糖CRp-1的单糖组成成分分析 CRp-1经酸水解、乙酰化后得到乙酰化衍生物,进行GC分析,与标准混合单糖乙酰化后的GC图谱进行对比,结果如图5和表2所示,从CRp-1中鉴定出6 种单糖,鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖和半乳糖,其摩尔比为1∶5.381∶1.146∶10.804∶6.953∶11.908。

图5 标准混合单糖(A)和CRp-1(B)衍生化后的气相色谱图
2.2.5 多糖CRp-1的红外光谱分析 CRp-1的FT-IR图如图6所示,主要吸收峰归属如下[23-24]:在3385.20 cm-1附近的峰主要是多糖O-H的伸缩振动峰,2933.60 cm-1为C-H的伸缩振动峰,1646.72 cm-1为C-OH的弯曲振动,1417.11 cm-1为 C-O伸缩振动,1062.71 cm-1附近有两个峰,表明含有呋喃糖苷,峰873.22和814.37 cm-1提示含有甘露糖,这与单糖组成成分一致。

图6 CRp-1的红外光谱图
2.2.6 多糖CRp-1的三空间构象 刚果红在不同的碱性溶液中与三螺旋多糖反应,可使最大吸收向长波方向移动。CRp-1在不同NaOH浓度(0~0.5 mol/L)下的螺旋-线圈跃迁分析如图7所示。刚果红试剂的最大吸收波长随着NaOH浓度的不断增加而减少,而CRp-1溶液的最大吸收波长由474 nm移至483 nm,并在0.35 mol/L NaOH溶液中出现最大吸收波长,以上表明多糖CRp-1已与刚果红形成了三螺旋络合物,可见,多糖CRp-1具有三股螺旋结构。
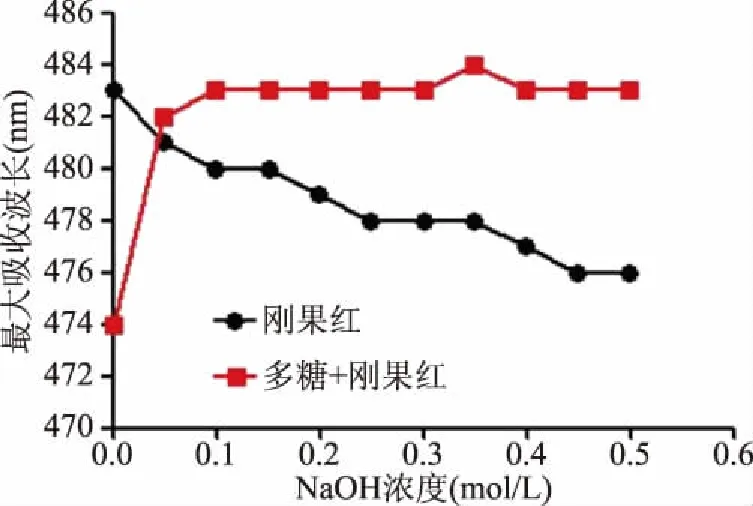
图7 刚果红-CRp-1络合物最大吸收波长变化
2.2.7 多糖CRp-1的微观结构 多糖CRp-1的扫描电镜图像如图8所示。可以看出,多糖CRp-1具有三维多孔结构,带有一定的圆形颗粒。来源不同、纯化工艺不同会导致多糖的表面结构不同,如从巴楚蘑菇中分离得到的两个多糖HLP1-1和HLP2-1,HLP1-1为细孔胶束结构,HLP2-1为集体块状结构[17];如从补骨脂中分离得到的两个多糖PCp-I和PCp-II,均经过冷冻干燥处理,但是PCp-I具有不规则的多孔结构,PCp-II呈片状、不规则弯曲[25],其结构的差异可能与纯化工艺、电负性等有关。

图8 CRp-1的扫描电镜图
2.3 体外α-葡萄糖苷酶抑制活性
多糖CRp-1对α-葡萄糖苷酶的抑制活性结果如图9所示。在实验浓度范围内(0~8 mg/mL),CRp-1表现出一定的α-葡萄糖苷酶抑制活性,具有浓度依赖性。与阳性对照阿卡波糖(IC50=0.72±0.08 mg/mL)相比,CRp-1(IC50=6.93±0.13 mg/mL)对α-葡萄糖苷酶抑制活性相对低。先前的文献报道表明多糖具有抑制α-葡萄糖苷酶的活性,多糖对α-葡萄糖苷酶的抑制活性主要与分子量、单糖组成、构型等有关[26-28]。陈庆等[29]发现从刺梨中得到的两个多糖RSPs-40和RSPs-60均具有抑制α-葡萄糖苷酶活性的作用,分子量大小分别为228.298和124.144 kDa,RSPs-40主要由阿拉伯糖、半乳糖、葡萄糖、果糖和半乳糖醛酸组成,而RSPs-60主要由阿拉伯糖、半乳糖、葡萄糖和半乳糖醛酸组成;莲雾多糖也具有抑制α-葡萄糖苷酶活性的作用,分子量为49.9 kDa,主要由鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖,分子量为49.9 kDa[30]。可见,多糖CRp-1对α-葡萄糖苷酶的抑制作用可能与其单糖组成和分子量等有关。

图9 不同质量浓度的CRp-1对α-葡萄糖苷酶抑制活性的影响
3 结论
以流苏子为原料,通过水提醇沉法提取多糖,Sevage法除蛋白,DEAE-52纤维和Sephadex G-100凝胶柱色谱进行分离纯化,得到多糖CRp-1。分析表明,多糖CRp-1外观为白色粉末,三股螺旋结构,且表面为三维多孔结构,并带有一定的圆形颗粒。不含单糖和多酚,不属于淀粉多糖,具有多糖的溶解性,溶于水,不溶于有机溶剂。总糖含量为97.12%,蛋白质含量为1.65%,主要由鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖和半乳糖,其摩尔比为1∶5.381∶1.146∶10.804∶6.953∶11.908,相对分子质量分别为223200 g/mol;结构中含有糖醛酸和β-吡喃糖。体外活性显示,CRp-1可浓度依赖性的抑制α-葡萄糖苷酶活性。
