LAMP4在急性髓系白血病中的表达与功能分析*
2020-12-04黄巧娟何波赵鑫王文涛
黄巧娟,何波,赵鑫,王文涛
(1. 中山大学生命科学学院,广东广州510275;2. 中山大学孙逸仙纪念医院麻醉科,广东广州510120)
溶酶体相关膜蛋白(lysosome-associated membrane protein, LAMP)是溶酶体膜蛋白的主要组成部分,约占所有溶酶体膜蛋白的50%[1]。目前已经发现的LAMP 家族成员有:LAMP-1/CD107a、
LAMP-2/ CD107b、 LAMP-3/CD208/DC-LAMP、LAMP-4/CD68/Macrosialin 和LAMP-5/BAD-LAMP,它们共同由一个约200 个氨基酸的LAMP 结构域和几个N-糖基化位点以及O-糖基化位点组成[2]。LAMP4 又称GP110、SCARD1,更为熟知的名字是CD68,定位于17q13。LAMP4 在人的单核吞噬细胞系中高表达,包括单核细胞、巨噬细胞、小神经胶质细胞、破骨细胞和髓样树突细胞等,是巨噬细胞特异的表面分子标记物[3]。此外,在其他淋巴细胞系、巨核细胞、恶性造血细胞及非造血细胞系,包括脐带间充质干细胞、纤维母细胞、内皮细胞和多种肿瘤细胞中,LAMP4 亦有表达[4]。大多数的研究认为,在未活化的巨噬细胞中,LAMP4 定位于内膜系统,但在细胞表面也可以检测到少部分的LAMP4[5]。经炎症刺激,LAMP4 蛋白将在细胞表面大量富集,表明LAMP4 可能参与吞噬作用、细胞与细胞及细胞与病原体间的相互作用[5]。LAMP4 在多种癌症中差异表达,被广泛应用于癌症的诊断与预后研究。例如,高表达的LAMP4 可指示霍奇金淋巴瘤的独立预后[6]; 在肺癌和卵巢癌中,LAMP4 阳性巨噬细胞浸润密度与生存时间呈负相关[7];在鼻咽癌和结肠癌中,LAMP4 则对患者的总生存期起到积极的作用[8]。迄今为止,LAMP4 在炎症反应和致癌作用中的研究还不清晰。从这些分析可以看出,LAMP4 不仅仅是一个巨噬细胞细胞的表面标志物,还存在于各种癌症的发生过程中,但是,其作用方式和分子机制尚不清楚。此外,LAMP4 在不同类型白血病中的表达以及功能如何尚未见有报道。
目前认为,除了急性早幼粒细胞白血病(acute promyelocytic leukemia,APL)类型外,急性髓系白血病是较难治的恶性癌症之一[9-10]。主要是因为急性髓系白血病往往存在多种不同类型的基因突变、基因表达水平的变化和基因的转录修饰,造成了靶向治疗的复杂性;而且,这些遗传学异常通过干扰造血干细胞的正常增殖、分化和凋亡的过程导致治疗困难,对预后造成很大的影响[10-11]。在急性髓系白血病(acute myeloid leukemia,AML)的诊断与分类中,染色体异位、倒位、重复和缺失经常与AML 中特定的亚型相联系[10,12-13]。AML 中最常见的4 种染色体核型改变是t(8;21),t(15;17),inv(16)和11q23 重排,分 别 产 生 了RUNX1-ETO[14]、PML-RARα[10]和CBFβ-MYH11[10,15]融合基因,以及引起MLL 融合基因[16],从而导致了不同亚型的急性髓系白血病。因此,深入研究急性髓系白血病发生机制及治疗靶点仍是重要课题。
本文以急性髓细胞性白血病为研究材料,检测分析了LAMP4 在临床标本以及细胞性中的表达,在此基础上研究了其在细胞调亡及分化方面的功能,同时研究了AML 分化过程中,LAMP4 的溶酶体定位动态变化现象,以期为白血病的临床诊断提供新的分子标记和治疗靶点。
1 实验材料与方法
1.1 白血病细胞系及培养条件
本论文采用的细胞系:HEK-293T,THP1,NB4,HL60,Molm13,MV4; 11,Jurkat,CEM,RS4; 11 和SUP-B15。细胞均购于中国医学科学院血液研究所。HEK-293T 培养在伴有φ=10%胎牛血清的DMEM 培养基中;其他细胞培养在伴有φ=10%胎牛血清的RPMI 1640 培养基中。培养环境为37 ℃,φ=5%CO2。
1.2 寡核苷酸及电转体系
本论文中用到的siRNA 及其相应的阴性对照(si-NC)均购自苏州吉玛制药技术有限公司。si-LAMP4-1 正向序列:CGUCACAGUUCAUCCAACATT; si-LAMP4-1 反 向 序 列 : UGUUGGAUGAACUGUGACGTT。si-LAMP4-2 正向序列:CCCAGAUUCAGAUUCGAGUTT; si-LAMP4-2 反向序列:ACUCGAAUCUGAAUCUGGGTT。si-NC正向序列:UUCUCCGAACGUGUCACGUTT;si-NC反向序列:ACGUGACACGUUCGGAGAATT。电转采用Invitrogen 公司的neon 电转仪。电转条件为,每10 μL 体系0.1 nmol 的siRNA, 并在1 350 V,10 ms,4 plus条件下进行。
1.3 RNA提取及实时定量PCR
本研究采用Trizol 试剂(Invitrogen,美国)提取RNA。提取方法参照Trizol试剂盒提取方案。取400 ng 的总RNA,采用Takara 公司的PrimeScriptTMRT 试剂盒进行逆转录。反应条件为37 ℃20 min,85 ℃5 s。合成的cDNA 稀释一倍,保存于-20 ℃。随后,采用Takara 公司的SYBR® Green Mix 进行实时定量PCR 检测。反应条件:①95 ℃预变性30 s;②95 ℃反应10 s;③60 ℃采集荧光,30 s。其中,②和③进行40 个循环。实时定量PCR 采用Applied Biosystems 进行相对定量。GAPDH mRNA作为内参,实验采用2-△△CT的方法计算。
1.4 蛋白收集及Western Blot检测蛋白水平
本论文采用RIPA 裂解液(碧云天生物科技有限公司,中国)裂解细胞和收集蛋白。在蛋白裂解过程中,加入蛋白酶抑制剂PMSF,并置于冰上裂解30 min,中间吸吹几次,使蛋白充分裂解;随后,15 000 r/min,4 ℃,离心10 min,挑去粘稠状的核酸; 将上清转移到新的离心管中,加入5×loading buffer,95 ℃变性10 min;-20 ℃保存待用。Western Blot 流程采用上样,电泳,转膜,封闭,孵育一抗,孵育二抗,加入反应底物,然后显影的方法。GAPDH为内参蛋白。
1.5 细胞凋亡检测
本研究采用Annexin V-FITC 试剂盒(杭州联科生物技术股份有限公司,中国)检测细胞凋亡。首 先,利 用0.25 μmol/L ATO 处 理 转 入siRNA 的THP1 细胞24 h;随后,收集细胞悬液,并按照凋亡试剂盒的方法进行染色,最终采用BD FACSCalibur仪器检测凋亡率。
1.6 细胞分化检测
本研究首先将转入siRNA 小分子的THP1 细胞37 ℃培养48 h,加入10 ng/mL PMA 处理72 h;然后,细胞悬液转移到离心管中,1 000 r/min,3 min,弃上清,PBS 洗一次;30~50 μL PBS 重悬细胞,加入3 μL CD11b (ebioscience, 美国)及φ=0.5% 的小牛血清封闭液,37 ℃水浴15 min,上机前离心,并稀释后置于冰上。最终采用BD FACSCalibur 仪器检测分化情况。
1.7 免疫荧光检测LAMP4细胞中定位
本研究取对数生长的细胞(或经PMA 处理后的细胞),1 000 r/min,3 min 收集细胞,PBS 洗两次;固定:用φ=4%多聚甲醛(PA)重悬细胞,将固定液涂在载玻片上,每片50~100 μL,室温自然晾干;通透:待细胞悬液晾干后,1 mL PBS 洗3次,每次5 min,φ=1%Triton(PBS 稀释)通透5~15 min;封闭:PBS洗3次,每次5 min,φ=5%BSA封闭30 min;一抗采用LAMP1(溶酶体标志物),LAMP4,PDI(内质网标志物)结合:用免疫荧光一抗稀释液按适宜比例稀释一抗,室温孵育4 h 或4 ℃过夜;二抗结合:PBS 洗3 次,每次5 min。按合适比例稀释二抗,室温孵育1 h;封片:在细胞表面滴加抗荧光淬灭剂,盖上盖玻片,封片;保存:4 ℃保存。最终采用蔡司(ZEISS)LSM800 共聚焦显微镜检测。
1. 8 统计方法
本论文,所有统计学计算均采用GraphPad Prism 5 软件进行。所有的两组样本的比较均采用t检验,多组样品间的比较采用方差分析(analysis of variance,ANOVA),组内采用Tukey 检验。P<0.05 被认为具有显著差异。利用受试者工作特征(Receiver Operating Characteristic, ROC) 曲线研究白血病临床诊断的意义。
2 结果与分析
2.1 LAMP4在急性髓细胞性白血病中的表达
为了研究LAMP4 在急性髓系细胞白血病(Acute myeloid leukemia,AML)中表达情况,我们首先对GES13204[17]数据的2 096 个样品数据进行了分析。通过分析发现,相比较非AML(Non-AML)样品(n=1 554),LAMP4 在AML 样品(n=542) 中 特 异 性 高 表 达 (图1A)(t-test,P<0.001)。这意味着,LAMP4 可能在AML 中发挥着潜在功能。于此同时,我们收集了十种细胞系的RNA 样 品, AML: THP1, MV4-11, Molm13,HL60 和NB4; ALL: Jurkat, RS4-11, sup-B15和CEM;以及293T 细胞系。在这些细胞系中检测LAMP4 的表达量。如图1B 所示,LAMP4 在AML 细胞系中表达量均显著高于非AML 细胞系,这个结果与GES13204 样品检查是一致的。这些结果表明,LAMP4 在AML 细胞中高表达,可作为潜在的分子标志物。为了进一步验证这个假设,我们利用ROC 曲线对GES13204 数据的2 096 个样品数据中的LAMP4 表达水平进行了分子诊断评估。结果显示, LAMP4 mRNA 区分AML 和非AML 的AUC为AUC:0.747 0(P <0.001,95% CI: 0.723 ~0.771),截断点(cutoff)为0.356 2,其中,敏感性为72.88%,特异性为64.09%。这些结果预示着,LAMP4 mRNA 具有潜在区分AML 和非AML能力。
2.2 LAMP4在髓性白血病细胞系中的功能分析
2.2.1 在细胞中干扰LAMP4 的效率检测分析 急性髓性白血病是一种造血系统的疾病,以造血干细胞/祖细胞异常的增殖、凋亡抑制和分化受阻为特征[10],我们下面主要从凋亡和分化几个方面研究了LAMP4 在AML 中的功能。前期的研究表明,LAMP4 是一个巨噬细胞的表面标志物[18];但是,我们的结果显示,LAMP4 在AML 细胞高表达,这一结果提示,LAMP4 不仅仅是一个标志物,可能作为一个癌基因参与AML的调控。

图1 LAMP4在AML中高表达是潜在的标志物Fig.1 Highly expressed LAMP4 could be a potential biomarker for AML
为了研究LAMP4 在AML 细胞中功能,我们运用了RNA 干扰(RNA interfering, RNAi)的方法,设计与LAMP4 mRNA 序列同源的双链RNA(double-stranded RNA, dsRNA),dsRNA 特异性的核酸酶Dicer 将dsRNA 裂解成由21~25 个核苷酸组成的小干扰RNA (small interfering RNA, siRNA),然后siRNA 作为特异性地降解相同序列的LAMP4 mRNA, 从而阻断LAMP4 的表达(siRNA 序列见材料与方法部分)。为验证LAMP4 在THP1 中的敲低效果,我们用电转染的方法将小分子siRNA瞬时转入了AML细胞系THP4细胞中,同时转入了与目的基因无同源性的siRNA 作为阴性对照,37 ℃培养细胞48 h 后,收细胞提取RNA 和蛋白质,分别用实时荧光定量和Western Blot 检测LAMP4 mRNA水平和蛋白水平上的敲低效率。结果显示,两种siRNA 均对LAMP4 具有很好的敲低效果,可以进行后续实验。
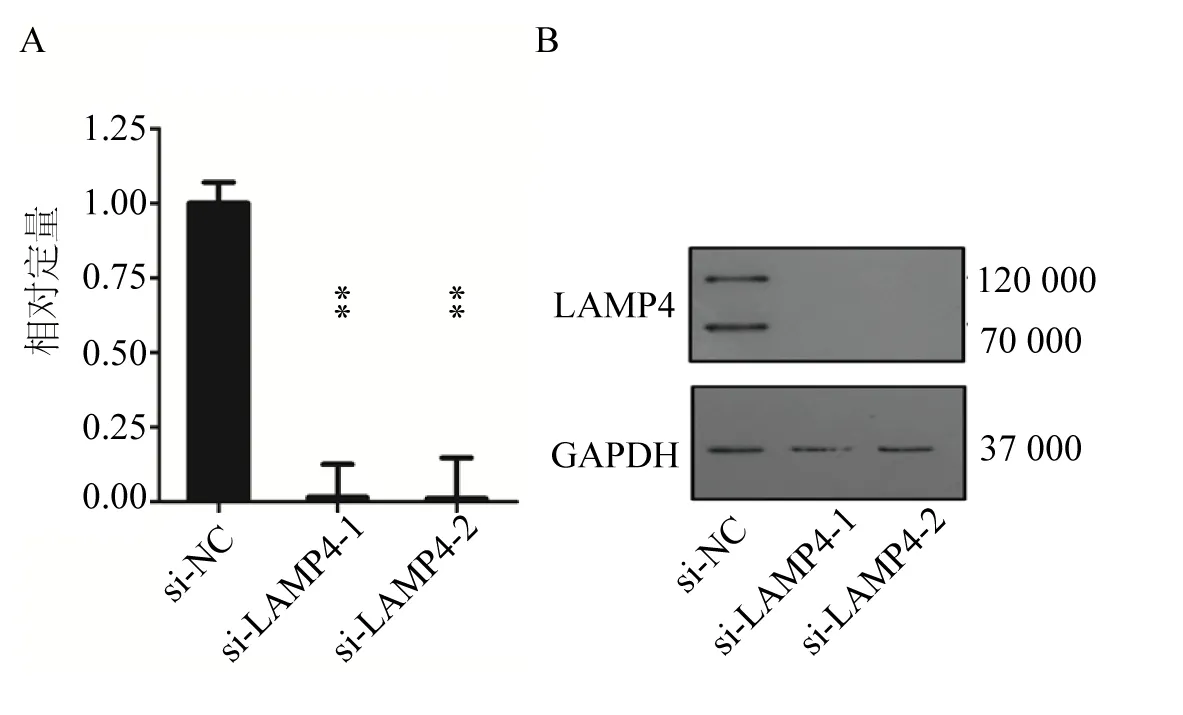
图2 THP1细胞中LAMP4 mRNA和蛋白水平的的敲低效率Fig. 2 mRNA and protein level knockdown efficiency of LAMP1 in THP1
2.2.2 LAMP4调控AML 细胞凋亡 我们进一步利用上述的siRNA 检测了LAMP4 对THP1 细胞凋亡的影响。用小分子siRNA 瞬时转染的方法将LAMP4的siRNA 转入THP1 细胞,37 ℃培养48 h,加入三氧化二砷(arsenic trioxide, ATO) 诱导细胞凋亡, ATO 是一种常用的促凋亡药物[19]。我们使用了0.25 μmol/L 的ATO 诱导THP1 凋亡,加药处理24 h 后,收细胞用Annexin V-FITC 凋亡试剂盒染色后流式细胞仪检测,结果见图3,LAMP4 显著促进THP1的凋亡。

图3 LAMP4调控AML细胞凋亡Fig. 3 LAMP4 regulated the apoptosis of AML cells
2.2.3 LAMP4 调 控PMA 诱 导 的AML 细 胞 分 化 急性髓系白血病(AML)是一种高度异质性的血液系统疾病,分化阻滞是其主要特征之一。通过药物诱导分化,白血病细胞的形态及生理特征等可向正常细胞方向转变,从而使疾病得到治疗。佛波酯(PMA)是PKC 通路激活剂,与细胞的增殖、分化和凋亡密切相关,在髓系白血病细胞THP1 中,PMA 可以打破细胞终端分化的阻滞,使细胞生长停滞,分化成贴壁的巨噬细胞表型[20-21],PMA 可能是AML 治疗的有效分化诱导剂,但其中具体的机制还不清楚。首先用10 ng/mL 的PMA 分别诱导THP1 细胞24、48 和72 h,从细胞的大小与贴壁性能等特征确定了THP1 细胞已向巨噬细胞方向分化(图4A);同时利用流式细胞术检测也发现髓系分化标志物CD11b 在PMA 诱导72 h 后明显高表达(图4B)。值得注意的,LAMP4作为一个巨噬细胞的标志物,其表达量在THP1 细胞巨噬化的过程中,随着时间的推移,呈现先升高后降低的趋势;而且与PMA 的浓度没有显著关系,这引起了我们的兴趣(图4C)。这个结果进一步暗示,LAMP4 不仅仅是一个巨噬细胞的标志物,还可能是AML 细胞的分化过程中的癌基因。为了验证这一假设,我们在10 ng/mL PMA 诱导的THP1细胞的情况下,同时敲低LAMP4,检测LAMP4 调控AML的分化能力。结果显示,在敲低LAMP4的THP1细胞中,髓系分化标志物CD11b 表达水平明显升高(图4D),这证实LAMP4 作为癌基因参与AML 的分化调控,可能是AML细胞分化抑制的重要分子。
2.3 LAMP4参与溶酶体调控通路
前期的研究表达,LAMP 家族的其他成员LAMP1,LAMP2 广泛定位于溶酶体中,并调控细胞的代谢,凋亡和分化过程。为了进一步探讨LAMP4 调控AML 细胞凋亡和分化的分子机制,我们利用免疫荧光的技术,探讨LAMP4的定位情况。根据免疫荧光的结果,LAMP4 在细胞内主要定位于溶酶体,而部分定位于内质网中(图5A)。那么,作为巨噬细胞表面分子标记,在PMA 诱导THP1 巨噬化的过程中,LAMP4 的定位是否会发生改变呢?我们分别用低质量浓度和高质量浓度的PMA 处理THP1细胞,即10 ng/mL的PMA 诱导24 h和10 ng/mL 的PMA 诱导72 h,然后用免疫荧光的方法检测LAMP4 在细胞内的定位情况。实验结果显示,在短时间诱导的情况下,LAMP4 的定位并没有发生改变,仍然主要定位于溶酶体(图5B);但是,在72 h 诱导的情况下,LAMP4 显著的从溶酶体中剥离(图5C)。前期的研究表达,溶酶体能够通过多种途径调控细胞的增殖、凋亡和细胞代谢[1,22]。这一结果说明,LAMP4 有可能通过溶酶体发挥调控AML 细胞的分化阻滞和凋亡抑制功能,其具体机制需要进一步研究。
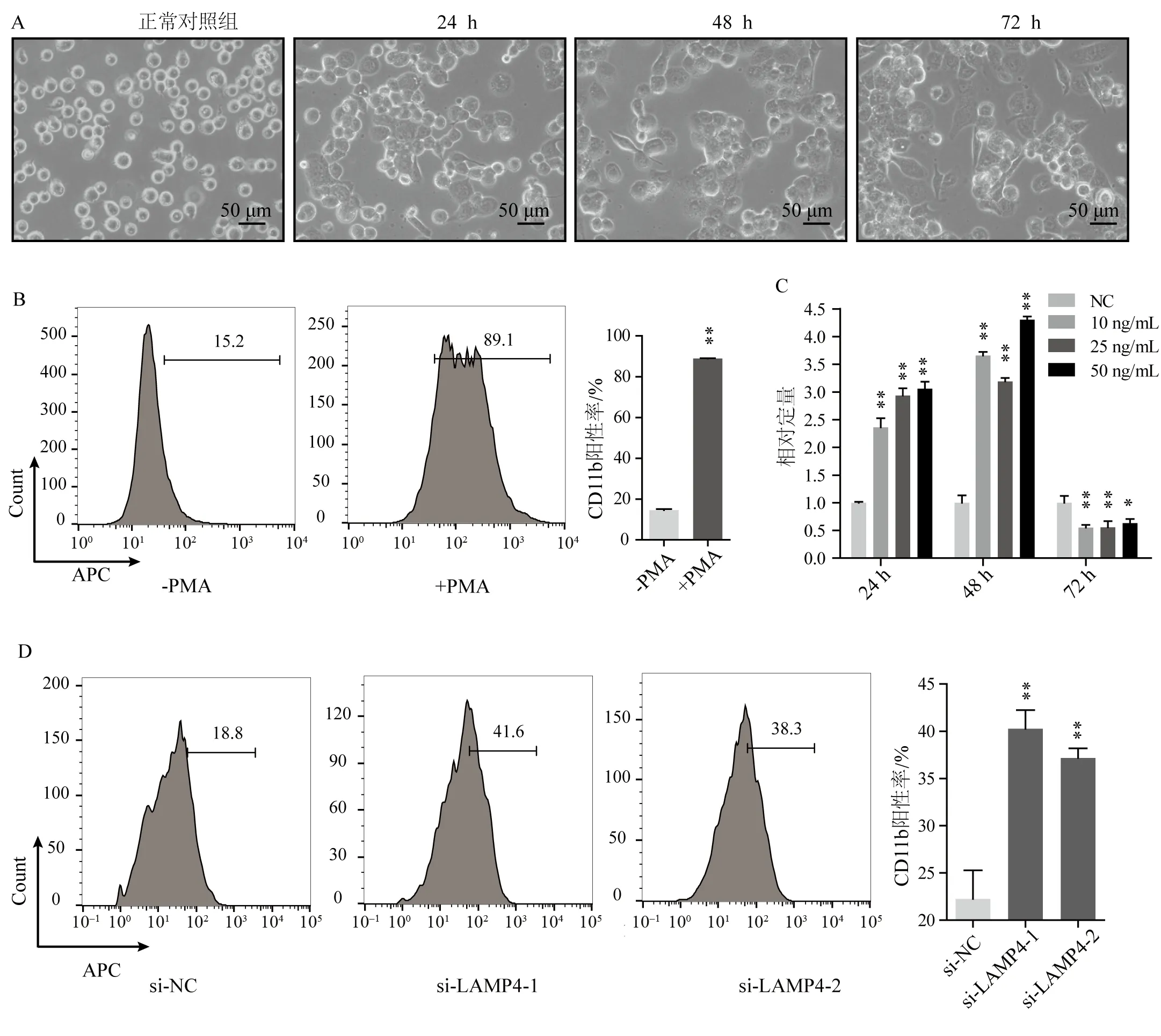
图4 LAMP4调控AML细胞分化Fig.4 Impact of LAMP4 on AML differentiation
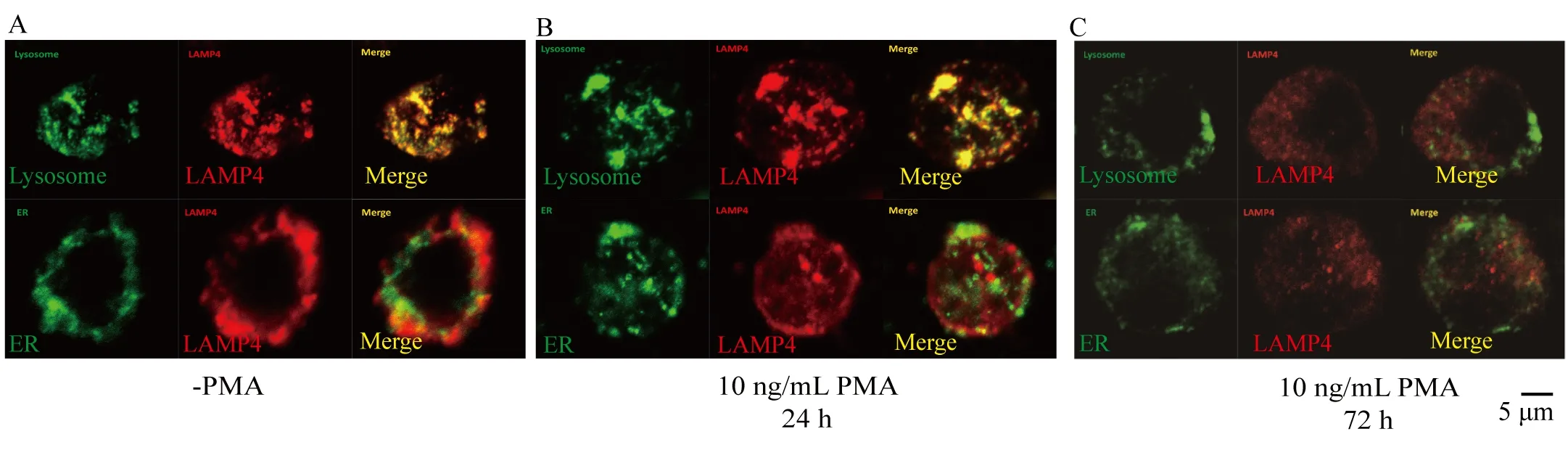
图5 免疫荧光检测LAMP4与亚细胞定位Fig.5 Immunofluorescence assay showing the subcellular localization of LAMP4
3 讨 论
溶酶体是细胞质中重要的细胞器,参与细胞的代谢、免疫、自噬等生理过程,与多种疾病的发生密切相关[22]。LAMP4 被报道在不同肿瘤发生过程中表达异常[4,18]。本研究中,我们发现LAMP4 在AML 白血病中呈现异常高表达,并且发现LAMP4 对AML 的发生起到抑制作用,功能初步研究表明,LAMP4 影响急性髓系白血病的分化和细胞凋亡过程。
溶酶体相关膜蛋白是位于溶酶体上的高糖基化的跨膜蛋白,LAMP 家族的五个成员结构类似[1];那么功能是否也参与了相似的途径,均参与溶酶体自噬相关的通路。我们前期报道的蛋白LAMP5也同样定位于溶酶体-自噬上,是一个自噬抑制分子[12]。而本文中发现的LAMP4 也定位于溶酶体上,当PMA 诱导后,LAMP4 剥离于溶酶体,说明LAMP4也有可能是溶酶体-自噬过程的抑制分子,与LAMP5 有同样的功能。此外,溶酶体是细胞自噬过程中重要的细胞器,在某些条件下,自噬和凋亡之间可以相互促进[23]。我们的研究发现,敲低LAMP4 调控AML 细胞凋亡与LAMP5 的功能一致。所以,家族成员LAMP4 与LAMP5 在溶酶体上可能具有相似的功能,这对于LAMP4 功能的深入研究具有借鉴作用。
目前研究发现,LAMP4 的高表达可作为霍奇金淋巴瘤的独立预后标记[6]。在乳腺癌中,CD68阳性细胞与人表皮生长因子受体-2(human epidermal growth factor receptor 2, HER2)、肿瘤直径、TNM 分期正相关[7]。LAMP4 在胃癌组织中高表达,而且与胃癌的肿瘤大小、淋巴结转移和TNM 分期密切相关[24]。CD68 阳性细胞的食管鳞状细胞癌患者总生存期较长,而且是该病患者早期诊断、预后及预测淋巴管及血管转移的分子指标之一[18]。我们的研究发现,LAMP4 在急性髓系白血病中特异性高表达,并发现其可做为潜在区分AML 与非AML 的标志物。这些结果说明,LAMP4 可能是恶性癌症的广泛标志物。
前期的研究普遍表明,LAMP4 作为一个巨噬细胞标志物在PMA 诱导THP1巨噬化过程中,呈现高表达[21]。我们的研究却表明,在短期PMA 诱导过程中,LAMP4 呈现高表达;但是在长期PMA 诱导分化过程中,其呈现低表达。这说明,LAMP4可能在癌症转变的不同时期,扮演者不同的功能。例如,在肺癌和卵巢癌中,CD68 阳性巨噬细胞浸润密度与生存时间呈负相关[7],鼻咽癌和结肠癌中,CD68则对患者的总生存期起到积极的作用[8]。我们的研究也表明,在长时间PMA 诱导的情况下,敲低LAMP4 后,AML 的分化更强,这一结果也表明,LAMP4 的癌性功能[5]。我们推测LAMP4 可能在癌症发展的不同阶段扮演者不同的功能,这一进程与AML 细胞的形成与分化息息相关。在AML分化早期,过多的LAMP4 蛋白可能诱发过量的细胞因子,这些细胞因子对AML 的发展不利;但是到分化后期,LAMP4 低表达维持分化末期AML 的细胞因子水平;但如果进一步下调LAMP4,将会破坏AML细胞的生长,进一步导致分化和死亡。
溶酶体被认为复杂的信号中心,控制细胞的生长、分裂和分化。例如,雷帕霉素复合体1激酶的主要调控靶点在溶酶体上被激活,以响应营养和生长因子的输入,同时调控相关组织的成长和分化。溶酶体也使自噬成为可能,这是一种“自食”过程,对质量控制和应激适应至关重要。溶酶体生长和分解代谢方案的错误执行导致各种癌症的发生,其中包括AML[2,22]。LAMP1 和LAMP2是溶酶体重要组成蛋白[1-2],是溶酶体调控生命活动的重要组成部分,几乎参与多种类型的细胞活化和分化的进程中[1]。本研究发现,在AML 细胞中LAMP4 主要存在于溶酶体上,说明LAMP4 可能也参与溶酶体的相关功能调控。在PMA 长期诱导的情况下,LAMP4 从溶酶体上剥离下来。这些表明,LAMP4 可能通过溶酶体信号通路调控AML 的分化及形成。
总之,我们的研究表明LAMP4 在AML 中高表达,并参与AML 细胞凋亡和细胞分化过程。我们还首次揭示LAMP4 主要定位于溶酶体上,在佛波酯的诱导下,LAMP4 能够从溶酶体上脱落下来,初步证明LAMP4 抑制细胞分化的癌性功能与溶酶体定位相关。这些发现表明LAMP4 可为AML 潜在的临床诊断分子标记物,并且是一个AML 治疗的潜在靶点。
