无花果隐头花序成熟期“糖溢化”的形态学观测
2020-11-21左兰馨沈元月
乔 菡,左兰馨,沈元月
(农业应用新技术北京市重点实验室/北京农学院 植物科学技术学院,北京 102206)
无花果(Ficuscarica)属于桑科(Moraceae)榕属植物。无花果果实营养丰富,且药用价值高,属于药食两用果品,近年来引起广泛的关注。随着需求量和市场的不断扩大,无花果被引入北京并进行设施栽培,具有较高的经济效益[1-6]。
尽管无花果属于呼吸跃变型果实,但无花果果实需要在树上完成成熟,这是因为无花果没有后熟现象。成熟期采摘的无花果保鲜期很短暂,目前缺乏有效的技术解决方案,这极大地限制了无花果的产业发展[7-8]。目前,北京无花果产业发展主要以鲜食为主,正处于起步阶段。为了采后保鲜,采摘普遍偏早,即在成熟之前采摘,但此时采摘的无花果并不能达到最佳的口感和品质[7-13]。无花果到达完熟之后果实软化并有粘稠糖液从花序中溢出,极大地提高果实口感和品质,这个时期处于最佳食用期。
无花果果实发育成双S曲线,有研究中指出无花果果实的糖运输始熟期后由共质体运输转变为质外体运输方式,有利于果实逆浓度快速积累可溶性糖[14,15]。果实成熟前期,尽管可溶性糖含量大幅上升,但并不伴随“糖溢化”现象。果实进入成熟后期,果实可发生“糖溢化”现象,此时期糖急剧增加;但这一生理现象实质的原因并不清楚。为了揭示这一现象的形态学机制,本研究以北京主栽品种‘玛斯义陶芬’(Masui Dauphine)为材料,首先对果实溢出的糖液进行可溶性糖含量检测,并与小花及果实的可溶性糖含量进行对比,然后通过体式显微镜、组织切片及扫描电镜观测小花的形态,分析成熟无花果果实 “糖溢化”现象的成因,为无花果的最佳鲜食时期的确定提供支撑。
1 材料与方法
1.1 试材选取
于2019年夏季,在北京农学院东大地6号温室进行。该温室常年可提供无花果试材(室温环境22~25 ℃,相对湿度50%~80%,光照时间10 h/d),试验条件稳定。选取3年生‘玛斯义陶芬’无花果用于试验。果树生长发育良好,果实产量高。石蜡切片的试材选取发育30、50、70、75、77、80 d果实的小花,体式显微镜和扫描电镜试材选取发育80 d的成熟的无花果的小花。
1.2 试验方法
1.2.1 可溶性糖含量 取发育80 d出现“糖溢化”现象的无花果果实,收集其果实内部流出的汁液,同时取花芽分化后77 d及80 d的小花和果实。小花和果实经干燥和粉碎后溶解于纯水中,之后进行脱色并稀释定容至50 mL。“糖溢化”汁液直接收集,使用脱色柱进行脱色后稀释。使用HPLC高效液相色谱仪(agilent 1220,美国)对样品进行葡萄糖、蔗糖、果糖含量的测定。试验重复3次。
1.2.2 石蜡切片观察 分别取发育30、50、70、75、77、80 d果实的小花,离体后立即浸入F.A.A固定液中,置于冰上带回实验室。使用浓度分别为30%,50%,70%,85%,100%的乙醇进行脱水,样品使用二甲苯、乙醇的等比例溶液、二甲苯依次浸泡进行透明,使用二甲苯、石蜡的等比例溶液、纯石蜡依次进行浸蜡,48 h后进行石蜡包埋。待蜡块完全凝固且硬度适宜时,进行切片,切片在染色后使用正置荧光显微镜(Olympus SZ2 ILST,日本)进行观察并拍照。试验重复3次。
1.2.3 体式显微镜观察 取发育80 d的果实和小花,置于冰上带回实验室,立即在体式显微镜(ZEISS-Axiocam 506 color,德国)下对样品的表面形态进行观察并拍照。试验重复3次。
1.2.4 扫描电镜观察 取发育80 d果实的小花,离体后立即浸入戊二醛固定液(电镜专用)中,置于冰上带回实验室。经梯度乙醇脱水后,使用叔丁醇升华的方法进行冷冻干燥,喷金之后进行扫描电镜(TESCAN5136,捷克斯洛伐克)镜检并拍照。试验重复3次。
2 结果与分析
2.1 无花果果实具有“糖溢化”现象
无花果果实在发育至80 d时可以达到充分成熟,此时果实高度软化,且在果实内部的小花上会有糖液溢出(图1)。“糖溢化”粘液的蔗糖含量为6.59 mg/g,果糖含量为93.90 mg/g,葡萄糖含量为95.48 mg/g;花芽分化后77 d时,果实中的蔗糖含量为5.89 mg/g,果糖含量为59.94 mg/g,葡萄糖含量为62.48 mg/g;小花的蔗糖含量为6.05 mg/g,果糖含量为65.70 mg/g,葡萄糖含量为67.31 mg/g;花芽分化后80 d时,果实中蔗糖含量为6.23 mg/g,果糖含量为66.13 mg/g,葡萄糖含量为68.39 mg/g(图2);小花的蔗糖含量为6.32 mg/g,果糖含量为70.12 mg/g,葡萄糖含量为72.41 mg/g。表明,无花果果实溢出的糖液比“糖溢化”前后的小花和果实中可溶性糖含量显著增加,并且无花果主要积累葡萄糖和果糖,蔗糖积累极低。
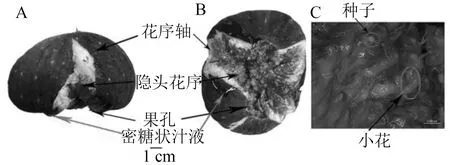
A.正视图 B.仰视图C.部分花序轴(小花簇)体式显微镜照片

注:星号表示差异显著(P<0.05)
2.2 无花果小花的发育过程
无花果果实的“糖溢化”现象发生在果实内部,由于果实内部被小花填充,因此,需要观察小花形态结构的动态变化,以揭示无花果果实“糖溢化”现象的成因。通过观察发育30、50、70、75、77、80 d的无花果小花的显微结构可以发现,无花果小花的形态在75 d之前都保持完整,且细胞排列致密;在接近成熟的75~77 d小花的细胞排列开始松散;到达80 d充分成熟出现“糖溢化”现象,此期小花形态不再完整,细胞排列不再致密,部分细胞壁缺失,细胞间出现明显的间隙(图3)。
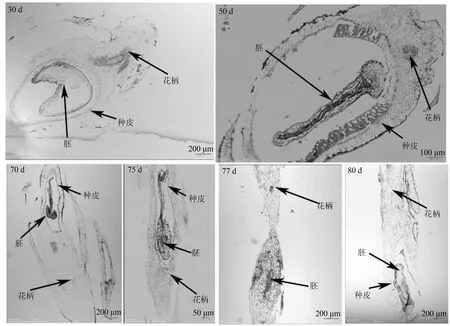
图3 无花果小花结构发育纵向解剖图
2.3 充分成熟期无花果小花的表面形态
取发育至80 d达到充分成熟的无花果果实,即在出现“糖溢化”现象后,通过体式显微镜观察小花,并通过扫描电镜进行进一步观察其表面形态。此时的小花细胞形态不再完整且呈现透明的状态 (图4-A),表皮细胞大量降解,结构极度松散(图4-B)。
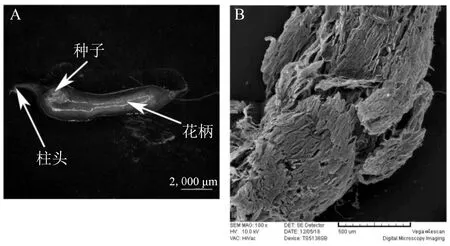
A.完熟无花果小花体式显微镜图; B.完熟无花果小花花柄扫描电镜图
3 讨 论
本试验研究结果表明:无花果果实在完熟过程中,由于细胞壁的降解,果实高度软化 (图4)。由于果实糖分的积累,小花膨胀破裂内部有高含糖量的粘稠汁液溢出,对此现象称之为“糖溢化”现象。在“糖溢化”现象发生的时期,果实内部小花呈半透明状态,在体式显微镜下可以观察到表面有粘稠的糖液(图4-A)。小花的细胞排列由初始的紧密变为极其松散,细胞间隙大,部分细胞壁降解 (图3)。通过扫描电镜可以观察到小花的表面不完整,几乎不存在表皮细胞(图4-B)。由此我们推断,无花果果实在完熟时期,由于细胞的衰老,导致小花形态的不完整,从而导致了无花果的“糖溢化”现象。
无花果果实由开始成熟到完熟时间非常短,而且后熟现象不明显。这导致无花果只能在树上完成成熟,而成熟前采摘下的无花果成熟进程将完全终止,不再进一步成熟[16,17]。但是无花果完熟时果实高度软化,且极易腐败严重制约了鲜食无花果的产业发展[18]。根据本试验的研究结果,“糖溢化”现象取决于小花的形态结构变化且伴随着果实的高度软化,质外体卸载的糖[15]不再进入细胞而直接“糖溢化”。在果实的可溶性糖含量和耐储运程度找到一个平衡点是产业发展重要的指标[19-20]。未来,揭示成熟期小花细胞破损的基因表达调控机制具有重要的理论和应用意义。
