近暗散白蚁β-葡糖苷酶基因RpBg7的克隆及其在毕赤酵母中的表达
2020-11-12苏丽娟肖元玺伍志伟赵鹏飞楚君鹏魏纪珍安世恒尹新明宋安东
苏丽娟, 肖元玺, 李 琰, 伍志伟, 赵鹏飞, 楚君鹏,魏纪珍, 安世恒, 尹新明, 宋安东,*
(1.河南农业大学生命科学学院, 郑州 450002; 2.河南农业大学植物保护学院, 郑州 450002)
木质纤维素是地球上最丰富和最广泛的生物能源,其结构组分包括β链接的聚合纤维素(β-linked polymeric cellulose)、半纤维素、酚醛聚合物木质素和其他一些小分子组件(Ragauskasetal., 2005; Sethietal., 2013)。这些组分通过半纤维素的分子黏合,作为支撑骨架包围并加固着纤维素和半纤维素,木质纤维素的这种复杂、致密的结构,导致其木质纤维素解聚效率低(Ragauskasetal., 2006; Lange, 2007; Anderson and Akin, 2008; Yang and Wyman, 2008)。由于白蚁可以消化摄入植物材料中高达99%的纤维素,白蚁和其肠道微生物是木质纤维素降解酶的宝贵资源,白蚁在消化木质纤维素方面受到越来越多的关注(Ohkuma, 2003; Scharf and Tartar, 2008; Scharf and Boucias, 2010; Ni and Tokuda, 2013; 曹慧芳, 2018; 杜娇等, 2019)。迄今为止,文献报道有110多种经过PCR扩增再经过异源重组表达的白蚁或共生的消化酶,这些酶来自于13种白蚁,主要有黄胸散白蚁Reticulitermessperatus(24%)、台湾乳白蚁Coptotermesformosanus(17%)、北美散白蚁Reticulitermesflavipes(15%)、中脉象白蚁Nasutitermescostalis(11%)、高山象白蚁Nasutitermestakasagoensis(9%)、恒春新白蚁Neotermeskoshunensis(6%)和黄翅大白蚁Macrotermesbarneyi(2%)等(杜娇等, 2019; 马玉俊等, 2019);这些重组消化酶中60%来源于细菌,29%来源于宿主白蚁,11%来源于共生原生物;这些酶的不同重组表达平台已经应用,其中细菌和酵母应用最多(分别为47%和34%),其次是杆状病毒/昆虫(11%)和真菌(8%)的表达系统。这110多种酶中,95%为糖基水解酶(glycosyl hydrolase, GH),3%是酚氧化酶/木质素酶,2%是酯酶。GH家族有几个关键家族组成,主要包括42% GHF9(内切葡聚糖酶),28% GHF5(纤维素酶),11% GHF7(内切葡聚糖酶/外切纤维素酶),9% GHF45(半纤维素酶),6% GHF1(β-葡糖苷酶),2% GHF11(半纤维素酶)和1% GHF8和GHF10(纤维素酶)(Scharf, 2015)。
白蚁的消化道可分为前肠(foregut)、中肠(midgut)和后肠(hindgut)3部分。前肠包括嗉囊(crop)和肌胃(gizzard),对白蚁取食的木块进行机械研磨;中肠是主要的消化酶分布和营养物质吸收场所;后肠是整个消化道最大的部分,为众多的肠道共生微生物提供生存环境,这些共生微生物包括细菌、古细菌和原生生物(Ni and Tokuda, 2013)。研究者普遍认为白蚁的木质纤维素降解体系由白蚁自身产生的纤维素酶与肠道共生微生物群(包括肠道共生原生动物和共生细菌)产生的酶系共同组成(Scharfetal., 2011; Scharf, 2015)。通过对白蚁纤维素酶、半纤维素酶和木质素酶的来源分析,可以推测出白蚁在摄食木材后,前肠在研磨食物时将纤维二糖水解酶(cellobiohydrolase, EG)和β-葡糖苷酶(β-glucosidase, BG)与食物混合,EG水解非结晶区的纤维素,BG从末端水解出葡萄糖,酶解作用主要在中肠进行;进入后肠后,低等白蚁的共生原生生物产生的GH5, GH7和GH45家族的EG酶、GH3家族的BG酶作用于结晶区的纤维素,高等白蚁则由后肠的共生原核生物产生的酶作用于结晶区的纤维素(Ni and Tokuda, 2013);半纤维素的降解则可能主要依靠共生菌群产生的半纤维素酶;对于木质素,白蚁几乎不能降解,大部分以粪便的方式排出体外(Geibetal., 2008; Brune, 2014)。
上述对白蚁木质纤维素酶的研究和开发在一定程度上丰富了工业中降解木质纤维素的混合酶资源的认识,但是目前能够投入生产应用的还远远不够,需要进一步研究和开发利用新的天然纤维素酶,因此,本研究根据前期蛋白组测序的结果,利用PCR结合RACE克隆了近暗散白蚁Reticulitermesperilucifugus的β-葡糖苷酶7(β-glucosidase 7)基因RpBg7,通过生物信息学软件分析了近暗散白蚁RpBg7序列,并对该基因进行了毕赤酵母Pichiapastoris表达,测定表达的β-葡糖苷酶7的酶活性,为丰富纤维素酶资源,构建新型、高效的木质纤维素转化技术体系提供理论依据和数据支持。
1 材料与方法
1.1 近暗散白蚁采集与鉴定
本研究所用的近暗散白蚁,采自河南省信阳市商城县金刚台(31°48′N, 115°2′E)。近暗散白蚁一般生活在未经开发的山林中,以枯木为食,采集白蚁时连同枯木一同带回,放入塑料箱内,置于阴暗处,保持温度20~35℃、相对湿度50%~70%。通过白蚁群体中兵蚁的外部形态特征(黄复生等, 2000)以及基于白蚁的线粒体16S rDNA和COII基因(NCBI数据库中的序列号分别为KX129973和KX290714)的分子鉴定结合来保证白蚁物种鉴定的准确和严谨。
1.2 近暗散白蚁β-葡糖苷酶基因的部分序列扩增
从采回的枯木中挑选成年工蚁置于干净平板内,平板置于冰上。按住白蚁头部,用解剖针从尾部轻轻将白蚁肠道拉出,解剖约100头后浸于Trizol试剂中,按Invitrogen的操作说明提取样品总RNA。参考One-Step gDNA Removal and cDNA Synthesis Kit(北京全式金生物科技有限公司)合成总cDNA;根据SMARTer® RACE 5′/3′Kit(TaKaRa Clontech, 日本)说明书合成5′RACE和3′RACE cDNA。
根据前期等重标签标记(isobaric tags for relative and absolute quantitation, iTRAQ)蛋白组测序的结果(未发表),设计近暗散白蚁肠道内的β-葡糖苷酶7基因的引物,F: 5′-CATTGGGATCTGCCACAGCCT CTAC-3′;R: 5′-GTTGTCAATTAGAGTCCACGCCG-3′。使用TransStart FastPfu DNA Polymerase(北京全式金生物科技有限公司)进行PCR扩增,反应体系: cDNA 1 μL, 正反向引物(10 μmol/L)各1 μL, 5×TransStart FastPfu缓冲液10 μL, dNTPs(2.5 mmol/L)4 μL, TransStart FastPfu DNA聚合酶1 μL, 无菌水补足50 μL。反应程序: 95℃预变性2 min; 95℃变性20 s, 55℃ 20 s, 72℃延伸1 min,循环35次; 72℃保温10 min。电泳检测后将之转入到pEASY-Blunt Simple克隆载体(北京全式金生物科技有限公司),转化筛选并提取质粒测序,得到部分序列。
1.3 RACE扩增近暗散白蚁β-葡糖苷酶基因的全长
由于用反转录扩增的蛋白序列不完整,仅有部分序列,因此使用5′RACE和3′RACE技术来获得该基因的全长序列。根据1.2节中得到的β-葡糖苷酶7基因的部分序列,设计该基因的5′RACE和3′RACE特异性引物。5′RACE引物序列: 5′-GCTAGAACAGGATTGGTCCATCCACC-3′; 3′RACE引物序列: 5′-CATTGGGATCTGCCACAGCCTCTAC-3′。以1.2节合成的近暗散白蚁肠道内容物RACE cDNA为模板,扩增其5′端序列和3′端序列。
5′RACE的反应体系(25 μL): 1.2节中制备的5′RACE cDNA 1 μL, 10×Buffer 2.5 μL, LATaq 0.25 μL, 5′RACE引物(10 mmol/L)0.5 μL, UPM 2.5 μL, 无菌水17.25 μL。PCR反应程序: 94℃预变性4 min; 94℃变性30 s, 68℃ 30 s, 72℃延伸3 min, 循环35次; 72℃保温10 min。3′RACE的扩增体系、反应程序与5′RACE基本相同,仅将模板和引物换为3′RACE cDNA和3′RACE引物。通过琼脂糖凝胶(1.2%)电泳(DYY-6C琼脂糖水平电泳仪,北京六一仪器厂)检测PCR产物,切割目的条带,送上海生物工程有限公司进行序列测定。测序成功后拼接序列,设计特异性引物BG-ORF-F: 5′-ATGG GGAGTGATAATTGGGCCACAGA-3′和BG-ORF-R: 5′-CTAAGAACTCTCGACACCCAGAAATTC-3′。以近暗散白蚁肠道内容物cDNA为模板,扩增其开放阅读框,PCR的反应体系和反应程序同1.2节。反应结束后,如上述方法检测并送测。
1.4 序列分析和系统发育树的构建
使用Blast工具在NCBI数据库中进行BLASTp同源序列分析,选取同源性较高的不同昆虫的β-葡糖苷酶,以黄粉虫Tenebriomolitor为外群,用MEGA 7(7.0.14)软件,选择Jones-Taylor-Thornton(JTT)模型,用最大似然法(maximum likelihood method)构建系统进化树进行聚类分析。在Swiss-Model网站(网址: https:∥swissmodel.expasy.org/)预测各个基因的3D模型;利用pyMOL(http:∥www.pymol.org)对蛋白进行单体的3D结构预测;在Expasy网站(molecular weight)和等电点(isoelectric point)(网址: http:∥web.expasy.org/compute_pi/)计算蛋白的分子量;用SignalP 4.1 Server(网址: http:∥www.cbs.dtu.dk/services/SignalP/)分析蛋白质的信号肽。
1.5 表达载体构建及毕赤酵母的电转化
用pPICZαA胞外表达载体(Invitrogen,美国),去掉信号肽和终止密码子,设计引物引入XhoⅠ和NotⅠ两个酶切位点,BG-P-F: 5′-CCGctcgagAAAA GAGCTTGGAACGAAGATGGTAAGGGCG-3′; BG-P-R: 5′-AAAAGGAAAAgcggccgcAGAACTCTCGACACC CAGAAATTCTACAGG-3′(小写字母为酶切位点)。PCR体系与程序同1.2节。空pPICZαA载体和回收后的RpBg7扩增片段用XhoⅠ和NotⅠ限制性消化酶(江苏愚公生命科技有限公司)进行双酶切,酶切体系:XhoⅠ 1 μL,NotⅠ 1 μL, 质粒DNA 1 μg/DNA片段200 ng,高纯水补足 20 μL。37℃水浴30 min,酶切后进行电泳和回收。用 T4 DNA 连接酶(NEB,美国)连接目的基因与空载体,连接体系: T4 DNA连接酶1 μL,用无菌水补足20 μL,37℃连接 30 min。连接体系转化入大肠杆菌EscherichiacoliDH5α感受态细胞中,挑选PCR结果正确的转化子,提取质粒并用双酶切验证,体系及条件同上。用StuⅠ(江苏愚公生命科技有限公司)线性化酶切处理融合质粒,电转入毕赤酵母X-33感受态细胞,电转条件:电压1.5 kV,电容25 μF,电阻200 Ω,电击时间5 ms。然后将转化后的液体涂布在博来霉素浓度为500 μg/mL的YPDS(酵母粉1%,胰蛋白胨2%,葡萄糖2%,琼脂粉2%和1 mol/L山梨醇)平板,挑选长势较好的单克隆进行验证。用酵母基因组DNA提取试剂盒(北京天根生化科技有限公司)提取转化子的基因组DNA(提取步骤详见说明书)。用5AOXI引物(5′-GACTGGTTCCAATTGACAAGC-3′)与基因下游引物BG-P-R进行PCR验证,反应体系: 酵母基因组DNA 50 ng, 2×Taq Mix 10 μL, 5AOX I(10 μmol/L)0.4 μL, BG-P-R(10 μmol/L)0.4 μL, 无菌水补足20 μL。反应程序: 94℃预变性4 min; 94℃变性30 s, 55℃ 30 s, 72℃延伸1 min, 循环32次;72℃保温10 min。
1.6 近暗散白蚁β-葡糖苷酶在毕赤酵母中的表达及检测
为了诱导表达β-葡糖苷酶表达,用博来霉素浓度为100 μg/mL的50 mL BMGY培养基培养1.5节获得的阳性转化子(为确保溶氧量,培养基体积最好不超过容器容积的10%),30℃过夜培养16~18 h。室温1 500 g离心5 min收集菌体。用博来霉素浓度为100 μg/mL的50 mL BMMY培养基重悬菌体,30℃培养。每24 h取样并补加甲醇至终浓度为1%诱导近暗散白蚁β-葡糖苷酶的表达,7 d后得到诱导表达菌液。对转化入空pPICZαA的X-33毕赤酵母进行同样的培养,作为后续实验的阴性对照。诱导表达菌液胞外分泌蛋白(extracellular secretion proteins)粗酶液的提取方法是,取50 mL的诱导菌液,4℃ 5 000 r/min离心5 min,分离上清和菌体沉淀。上清中分次加入固体硫酸铵,一边搅拌一边加入,直至硫酸铵达到饱和。4℃ 12 000 g离心10 min,取沉淀用10 mL 0.1 mol/L PBS溶解,用0.1 mol/L PBS进行透析,透析2次,每次3 h;透析后用PEG 20000浓缩至5 mL,即得到诱导表达菌液的胞外分泌蛋白粗酶液。菌体胞内蛋白(extracellular proteins)的提取方法为,用10 mL无菌水彻底悬浮菌体,吸取菌液,4℃ 5 000 r/min离心5 min,弃上清,重复3次;向离心管中加入650 μL山梨醇Buffer,再加入50 U酵母细胞破壁酶,30℃水浴1 h,室温4 000 r/min离心10 min,弃上清,收集沉淀,加入1 mL 0.1 mol/L PBS(pH 7.4)清洗菌体沉淀,重复3次,再加入0.8 mL 0.1 mol/L PBS(pH 7.4)收集沉淀,使用超声波细胞破碎仪破碎菌体,参数为功率35%,工作3 s,间歇3 s,破碎3 min,4℃ 10 000 r/min离心10 min,上清稀释至5 mL,即得到胞内蛋白粗酶液。
用10% SDS-PAGE电泳检测胞外分泌蛋白粗酶液和胞内蛋白粗酶液中目的蛋白的表达情况,并用4-硝基苯基-β-d-吡喃葡萄糖苷(4-nitrophenyl β-d-glucopyranoside, 4pNPG)作为底物测定β-葡糖苷酶7的粗酶活性,同样条件培养的空pPICZαA-X33毕赤酵母的胞外分泌蛋白粗酶液或胞内蛋白粗酶液作为阴性对照。粗酶活性测定体系总体积为200 μL,胞外分泌蛋白粗酶液或胞内蛋白粗酶液50 μL,50 μL底物,100 μL pH 4.8醋酸钠缓冲液,于50℃水浴反应10 min后加入3 mL 0.2 mol/L Na2CO3终止反应。在408 nm处测量吸光度A,根据公式A=εbc(A为反应体系在408 nm处测量吸光度,pNP的消光系数ε=1.74×10-4/mol·cm·mL,b为比色皿厚度,c为pNP的浓度)计算产物pNP的浓度,从而得到葡萄糖的浓度。酶活性测定重复3次。酶活力单位(U)定义为1 min内生成1 μmol底物所需的酶量为一个酶活力单位。
2 结果
2.1 近暗散白蚁β-葡糖苷酶基因序列及结构预测
PCR结合RACE克隆获得了近暗散白蚁的一个内源性β-葡糖苷酶7基因序列(GenBank登录号: MN944395),开放阅读框长1 485 bp,编码495个氨基酸残基,经Swiss-Model建模其3D结构,该基因编码的蛋白是一个(α/β)8-TIM桶装结构,在催化活性口袋内具有保守的碱性氨基酸残基Glu187和Glu394,这些是糖苷水解酶1(glycoside hydrolase 1, GH1)家族β-葡糖苷酶的典型特征,因此认为其属于GH1家族,将该基因命名为RpBg7。在Expasy网站预测RpBg7的分子量是57 kD,等电点5.51,不稳定系数为38.4,SignalP 4.1 Server分析RpBg7的信号肽位于第1-42位氨基酸。
使用Phyre2分析了蛋白的二级结构,发现该蛋白包含了19个α螺旋和14个β折叠。通过单体的3D结构预测并与恒春新白蚁的β-葡糖苷酶NkBg(GenBank登录号: AB073638.2)进行了结构对比,发现两者的3D结构完全重合,均含有GHF1 β-葡糖苷酶的典型(a/b)8-TIM桶形褶皱。在NCBI数据库中进行BLASTp同源序列分析,近暗散白蚁的内源性RpBg7的氨基酸序列与其他18种昆虫的序列同源性较高,其中RpBg7的氨基酸序列与栖北散白蚁Reticulitermessperatus的β-葡糖苷酶(GenBank登录号: AB915866.1)序列一致性最高(88.33%)。其次是与台湾乳白蚁(GenBank登录号:JN565079.1, 86.46%)、黑翅土白蚁Odontotermesformosanus(GenBank登录号:GU591172.1, 82.55%)和土垅锯白蚁Microcerotermesannandalei(GenBank登录号:KU170546.1, 81.66%),与其余的物种同源蛋白氨基酸序列一致性均在60%以下(图1)。结合序列比对的情况,我们推测第187和394位的谷氨酸(E)为其催化残基(图1中红色五角星号标注),催化酸/碱的TXNEP基序(X是疏水性氨基酸残基)位于β折叠6的末端,催化的亲核体I/VTENG基序位于β折叠11的末端,这也是典型的GHF1家族的特征;第39位的谷氨酰胺(Q)、第142位的组氨酸(H)、第143, 436和444位的色氨酸(W)、第186和441位的天冬氨酸(N)、第330位的苏氨酸(T)、第443和450位的谷氨酸(E)和第452位的苯丙氨酸(F)为糖苷的糖基结合囊(glycone-binding pockets)的残基(图1中绿色倒三角标注);第190和247位的缬氨酸(V)、第249位的精氨酸(R)、第331位的酪氨酸(Y)、第332位的丙氨酸(A)和第366位的色氨酸(W)为糖基配基结合囊(aglycone-binding pockets)的残基(图1中蓝色圆点标注)。
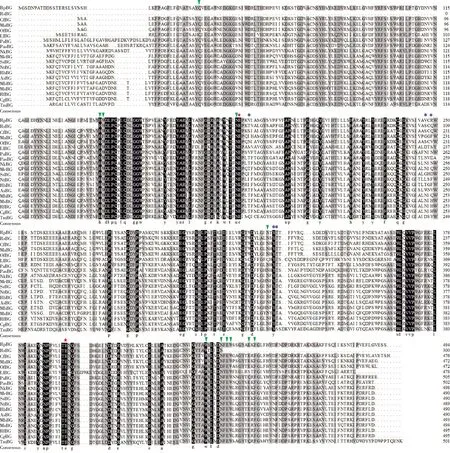
图1 近暗散白蚁与其他昆虫β-葡糖苷酶氨基酸的序列比对
2.2 近暗散白蚁β-葡糖苷酶基因RpBg7的系统进化位置
利用MEGA 7(7.0.14)软件,采用最大似然法进一步分析了近暗散白蚁β-葡糖苷酶基因RpBg7的进化位置。我们以黄粉虫Tenebriomolitor为外群,将近暗散白蚁RpBg7氨基酸序列与18种昆虫的相近基因进行了进化树分析结果表明(图2)。结果表明,近暗散白蚁RpBg7与栖北散白蚁的β-葡糖苷酶的进化关系最近,其次是与台湾乳白蚁。但是同为散白蚁属的美洲散白蚁Reticulitermesflavipes却与近暗散白蚁关系较远,与格斯特乳白蚁Coptotermesgestroi和黄翅大白蚁Macrotermesbarneyi进化关系比较近(图2)。这与上述氨基酸序列分析同源性较高结果一致。
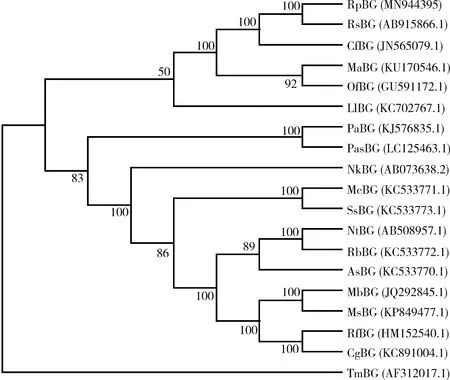
图2 最大似然法构建的基于昆虫β-葡糖苷酶氨基酸序列的系统进化树
2.3 近暗散白蚁β-葡糖苷酶RpBg7在毕赤酵母中表达及酶活性
从克隆载体pPICZαA上PCR扩增引入酶切位点的目的基因(图3),从图中可以看出扩增效果较好,无非特异性条带,可以切胶回收。构建的RpBg7-pPICZαA重组质粒双酶切验证(图3)显示载体已成功构建,经过测序显示无突变、移码和碱基增减等情况,确定连接成功,可以向毕赤酵母中转化。从图3可以看出融合表达质粒均被StuⅠ完全切开,浓缩之后使用电转化法转化入毕赤酵母X-33感受态细胞中,筛选阳性转化子进行诱导表达。
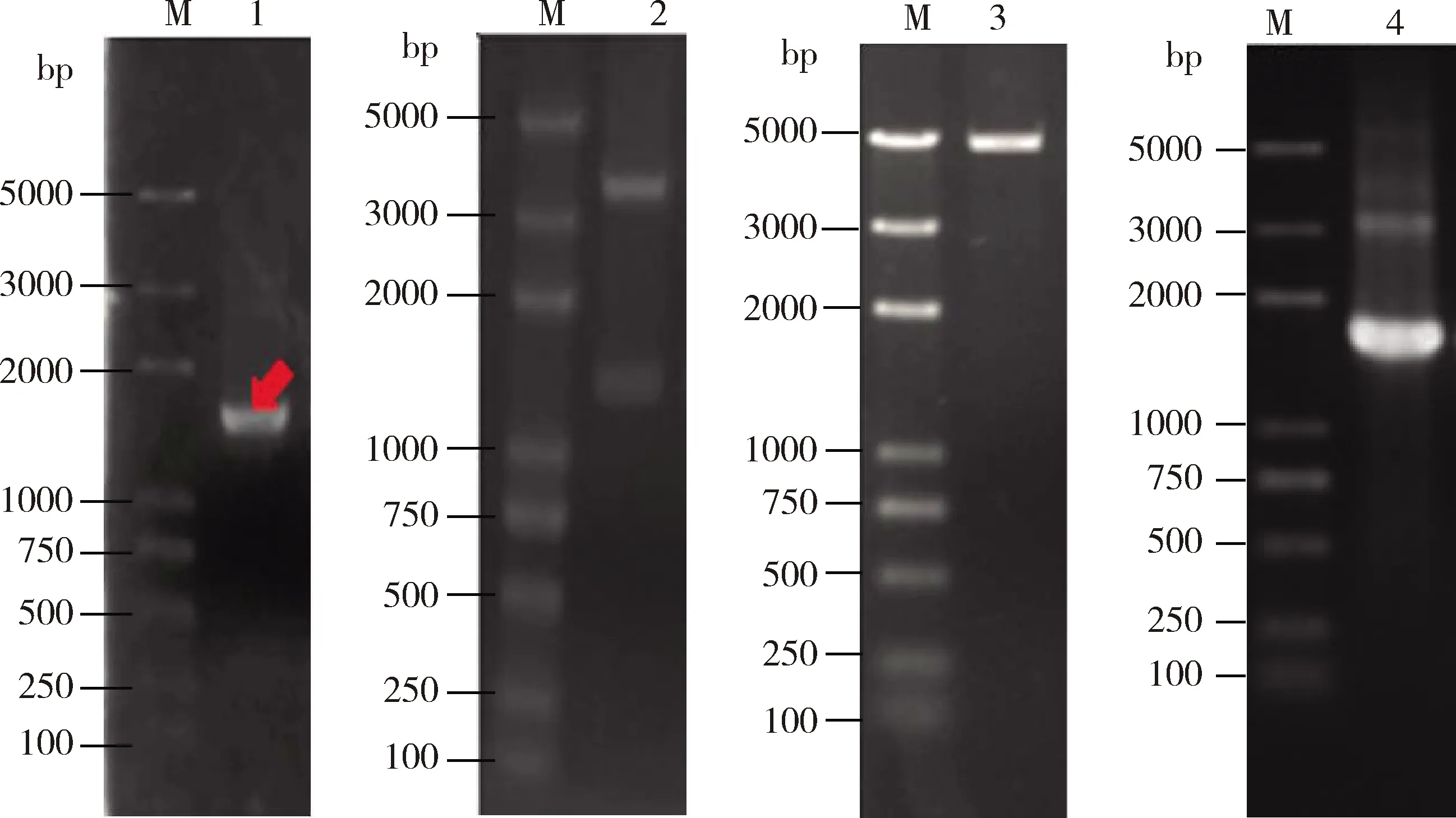
图3 毕赤酵母表达载体RpBg7-pPICZαA验证
使用10% SDS-PAGE电泳检测胞外分泌蛋白粗酶液和胞内蛋白粗酶液目的蛋白表达情况,发现胞内蛋白粗酶液在57 kD处有清楚的目的蛋白条带(图4,红色箭头所示),而胞外分泌蛋白粗酶液未检测到目的条带(文中未显示)。用pPNG检测RpBg7在胞外分泌蛋白粗酶液和胞内蛋白粗酶液的酶活性,均可以检测到酶活性。发现RpBg7在胞外分泌蛋白粗酶液中的酶活性为4.43 U,在胞内蛋白粗酶液中的酶活性为7.47 U。
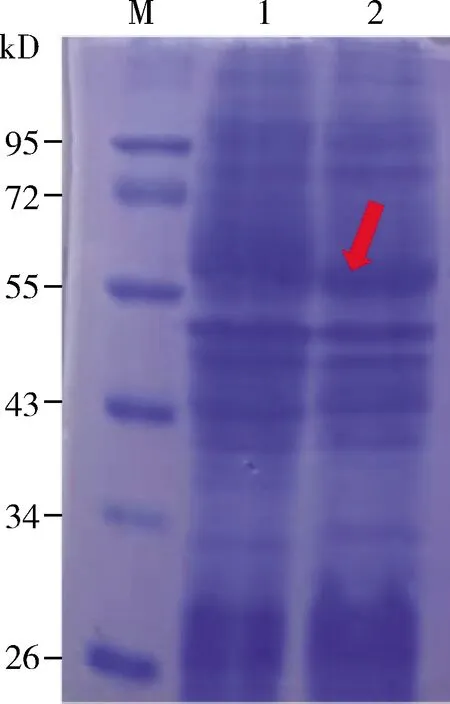
图4 RpBg7在毕赤酵母X-33中表达产物的SDS-PAGE鉴定结果
3 讨论
Cazy数据库(http:∥www.cazy.org)将目前发现的β-葡糖苷酶依据序列的一致性分成GH1, GH3, GH5, GH9, GH30和GH116共6个家族当中,目前发现的β-葡糖苷酶多属于GH1和GH3家族。β-葡糖苷酶GH1, GH5和GH30家族属于Clan A超家族,酶结构呈保守的(β/α)8桶状结构,催化通道呈口袋状。本实验克隆并表达了近暗散白蚁的内源性β-葡糖苷酶7基因RpBg7,通过其基因序列的生物信息学分析,发现该β-葡糖苷酶是典型的GH1家族基因,具有GH1 β-葡糖苷酶典型的(a/b)8-TIM桶形褶皱,即口袋状,GH1催化活性位点包含两个保守的Glu,靠近N端的Glu位于第4个β折叠片上,在催化反应时提供亲核基团,靠近C端的Glu位于第7个β折叠片上,在催化反应时提供质子(曹慧芳, 2018)。因此推测,近暗散白蚁β-葡糖苷酶RpBg7的催化位点是Glu187和Glu394,也具有典型的糖苷的糖基结合囊的残基和糖基配基结合囊的残基。而β-葡糖苷酶作用于纤维二糖在内的纤维寡糖,从非还原端切割产生单个的葡萄糖(Lyndetal., 2002; Liaoetal., 2011),在纤维素酶的协同作用过程中,纤维二糖的堆积常常会反馈抑制EG和CBH的酶活性从而影响整个酶系的水解效率(Holtzappleetal., 1990),所以β-葡糖苷酶是纤维素分解为二糖、再分解为单糖的酶解体系的关键限速酶。
虽然在碳水化合物活性酶(CAZy)数据库和蛋白质数据库中可以找到很多的β-葡糖苷酶,但是酶活性高、热稳定性好和葡萄糖耐受性强的却很少(Cantareletal., 2009; Cairns and Esen, 2010)。迄今为止,也有多种白蚁的内源性纤维素酶被表达,原始单酶活性均不高,比如黄翅大白蚁 β-1,4内切葡聚糖酶的酶活性为14.1 U/mL(杜娇等, 2019),在枯草芽孢杆菌Bacillussubtilis中表达的黄翅大白蚁β-葡糖苷酶活性为0.21 U/mL;另外也有白蚁内生菌的分离,包括坚强芽孢杆菌Bacillusfirms的纤维素内切酶(CMCase)活性是95 U/mL(马玉俊等, 2019),黑胸散白蚁Reticulitermeschinensis肠道内共生枯草芽胞杆菌的β-1,4内切葡聚糖酶活性为4.57 U/mL(王智伟等, 2018)。本研究克隆表达的β-葡糖苷酶7在毕赤酵母中表达的酶活性为7.47 U/mL(图4),作为生物质转化的工业应用还远远不够,但是它是来源于天然生物材料的纤维素酶,可以与其他的天然生物系统中的纤维素酶高度协同作用于天然底物,另外也应该具有天然酶的酶学性质,比如温度、pH值,尤其是对高糖底物的耐受性,都需要进一步研究以适应工业需要。
相对于白蚁的防御、生物材料、工程和进化方面的研究,目前人们理解最多的是白蚁的木质纤维素降解,包括白蚁的消化和肠道共生物的互作,及一些新的重组木质纤维素酶的重要应用。下一步对白蚁研究的焦点将集中在如下方面:一是白蚁自身消化的生物质预处理的进一步探索;二是预处理酶的开发,这些酶是针对于木质纤维素生物质的非纤维素成分(例如木质素和其他酚类成分),同时也包括混合酶的应用;三是在生物反应器中保护微生物和酶的抗氧化剂和解毒酶;最后是关于生物质消化的研究,最大的需求还是重组酶的应用策略,这包括淡化合成底物,而强调实际的木质纤维素物料,而且用更多测量底物消化的定量方法(Scharf, 2015)。
