鹅星状病毒重组Capsid蛋白亚单位疫苗的免疫效果
2020-11-06荣雪路魏荣荣王钜华李甜甜朱国强丁国伟
荣雪路,魏荣荣,王钜华,李甜甜,朱国强,丁国伟*
(1.扬州优邦生物药品有限公司,江苏 扬州 225000;2.扬州大学兽医学院,江苏 扬州 225000)
星状病毒主要引起鹅发生严重的内脏型痛风和关节型痛风[1]。该病毒主要侵害2~25日龄的雏鹅,鹅感染后临床症状表现为精神不振、采食减少、消瘦衰弱、呼吸困难、行动迟缓和排白色稀便。剖检可见:双肾肿大,有尿酸盐沉积,严重的呈大理石样;其他内脏被一层白色石灰样薄膜包裹,关节周围及关节腔有白色尿酸盐沉积[2-3]。发病时间多为每年的11月到次年的5月,这个季节是我国中东部种鹅产蛋高峰期,其他时间发病较少。感染鹅的病死率受感染日龄、继发感染等因素影响,发病率最高可达50%[4],该病已经成为危害养鹅业健康发展的一种重要传染病。目前,接种疫苗是预防、控制甚至消灭鹅星状病毒的主要措施之一。星状病毒的培养较为困难,限制了常规弱毒疫苗和灭活疫苗的研发。2009年,Sellers等[5]成功表达了鸡星状病毒的衣壳蛋白,用其免疫的鸡群产生了高水平的抗体,表明衣壳蛋白有可能作为星状病毒的亚单位疫苗。亚单位疫苗不含星状病毒的核酸物质,安全性较好,给鹅接种后不会发生持续感染或潜伏感染,产生的免疫应答可以与星状病毒的野毒株感染相区分,有利于疫病的控制和消灭。因此,研制一种生产成本低、生产效率高以及免疫效果好的鹅星状病毒亚单位疫苗的生产方法具有重要的现实意义。
本试验为有效预防鹅感染鹅星状病毒,通过制备鹅星状病毒重组Capsid蛋白亚单位疫苗,对种鹅进行接种,并对其所产鹅蛋孵出的雏鹅进行攻毒,研究该疫苗的保护效果,为鹅场鹅的健康和经济效益提供保障。
1 材料与方法
1.1 试验材料
1.1.1 种毒来源
分离并鉴定临床病料,将所得病毒命名为鹅星状病毒GoAsV-LH株,用鹅胚尿囊液传代,取F3代用于攻毒(尿囊液病毒含量104.03ELD50/0.2 mL)。
1.1.2 试验动物
试验所用动物为四季鹅。
1.1.3 主要试剂及仪器
琼脂购自Sigma公司,批号为WXBC9850V。生化培养箱购自上海一恒科学仪器有限公司,型号为LRH-150F。
1.1.4 试验用疫苗
鹅星状病毒重组Capsid蛋白亚单位疫苗由本公司提供,批号分别为rCapsid-001P、rCapsid-002P 和 rCapsid-003P,各批次疫苗抗原蛋白浓度为75 μg/mL。
1.2 疫苗性状检验和无菌检验
按现行《中国兽药典》[13]附录进行疫苗性状检验和无菌检验。
1.3 安全性检验
取3~5日龄雏鹅、7月龄开产种鹅各10羽,接种鹅星状病毒重组Capsid蛋白亚单位疫苗,雏鹅每羽胸部肌肉注射0.2 mL,种鹅每羽胸部肌肉注射1 mL,每组均另取10羽相同来源、相同日龄的鹅,作为对照组。接种疫苗后7 d、14 d和21 d,每组取3羽鹅进行剖检,检查注射部位疫苗吸收情况和病理变化。
1.4 免疫效力试验
将三批四季种鹅分为免疫组和对照组,在开产前5周,给免疫组种鹅接种三批鹅星状病毒重组Capsid蛋白亚单位疫苗中的一批疫苗,接种剂量为1 mL/羽,对照组的种鹅不接种疫苗。接种后第2周至第4周,各组随机取20羽鹅采集血液,采用琼脂扩散试验法检测GoAs抗体;收集接种疫苗后第4周至第5周种鹅所产鹅蛋,每组40枚,其中10枚采用琼脂扩散试验法检测GoAs抗体,余下的30枚放入38 ℃孵化箱中孵化。29 d~30 d后,各组任选20羽雏鹅,做好区分,饲养至 3日龄,采集雏鹅血液,分离血清,采用琼脂扩散试验法检测GoAs抗体。同时进行攻毒试验,用GoAsV-LH株F3代攻毒(尿囊液中病毒含量为104.03ELD50/0.2 mL),每羽雏鹅口服0.5 mL,颈部皮下注射0.5 mL,每组攻毒10羽,剩余为对照组。各组鹅均分别隔离饲养,观察14 d,记录发病、死亡及保护情况。
2 结果与分析
2.1 疫苗性状检验和无菌检验结果
三批疫苗均为乳白色油包水型乳剂。用清洁吸管吸取少量疫苗滴入冷水中,除第一滴外,均不扩散。将疫苗加入10 mL离心管中,以3 000 r/min离心15 min,管底析出水相未超过0.5 mL。无菌检验未发现菌落生长。
2.2 疫苗安全性检验结果
鹅群注射疫苗后,连续21 d,各组鹅的精神状况、饮水和进食量均良好;免疫后 7 d、14 d和21 d,触摸检查试验组鹅注射部位无红肿等局部注射反应;剖检注射部位,发现疫苗吸收良好,无病理变化。
2.3 鹅星状病毒重组Capsid蛋白亚单位疫苗的免疫效力
2.3.1 种鹅接种疫苗后血清抗体检测结果
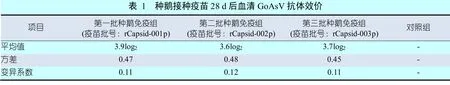
试验组鹅接种三批疫苗28 d后,用鹅星状病毒琼脂扩散法测得的抗体效价平均值均不低于3.6log2,对照组鹅的抗体均为阴性,具体结果见表1。
2.3.2 接种疫苗的种鹅4~5周内所产鹅蛋卵黄抗体检测结果
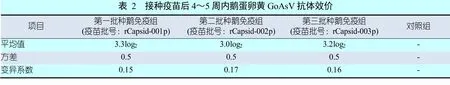
试验组鹅接种三批疫苗后4~5周内任取10枚鹅蛋,其卵黄琼脂扩散法GoAsV抗体效价平均值均不低于3.0log2,对照组的10枚鹅蛋卵黄琼脂扩散法GoAsV抗体均为阴性,结果见表2。
2.3.3 3日龄雏鹅血清抗体检测结果
接种三批疫苗被的试验组鹅所孵3日龄雏鹅的血清琼脂扩散法GoAsV抗体效价平均值均不低于2.7log2,对照组均为阴性,结果见表3。

2.3.4 3日龄雏鹅被动免疫攻毒试验
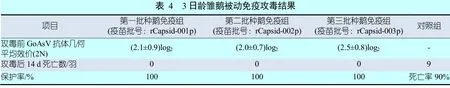
接种三批疫苗的试验组鹅所产种蛋孵出雏鹅在3日龄攻毒后采食、饮水和精神状态均正常,未出现鹅星状病毒临床感染症状,攻毒后14 d,每组均100%(10/10)健活。对照组鹅所产种蛋孵出的雏鹅攻毒后第3天开始出现精神沉郁、厌食、站立不稳、离群、排稀灰白色或黄绿色粪便等症状,攻毒后第5天死亡,攻毒后10 d共死亡5羽雏鹅。剖检病死鹅发现,跖、跗和趾关节肿大,皮下有大量尿酸盐;整个心脏和部分肝脏出现石灰样尿酸盐沉积;肾脏肿大,充血,表面布满石灰样尿酸盐沉积;肺脏表面散布尿酸盐沉积;腺胃散布尿酸盐沉积;脾脏出血严重,有灰白色坏死灶。被动免疫攻毒结果见表4。
3 讨论
3.1 鹅星状病毒感染及防疫措施
2017年以来,全国各地的鹅群广泛发生以内脏型痛风和关节型痛风为主要症状的传染性疾病,主要侵害2~25日龄的雏鹅,死亡率最高可达50%[4],已经成为危害养鹅业健康发展一种重要传染病。据文献报道,高钙高蛋白质型日粮或钙磷比例失调,可以导致鸡痛风发生[6],因此,在防治雏鹅痛风的问题上,有研究人员尝试降低饲料中的蛋白质含量[7-9]、添加青饲料等,但是收效甚微。姜晓宁等[10]在近期的研究中发现,新型鹅星状病毒是导致雏鹅痛风的主要原因,他们在采集的数百份病料中成功分离出星状病毒,且检出率高达96.5%[11]。目前,疫苗接种是预防、控制甚至消灭鹅星状病毒的主要措施之一。星状病毒的培养较为困难,限制了常规弱毒疫苗和灭活疫苗的研发。Sellers等[5]用杆状病毒表达系统表达了鸡星状病毒的衣壳蛋白,接种种鸡能够刺激机体产生高水平的抗体,并可经卵黄将抗体传递至后代维鸡[12]。亚单位疫苗中的类病毒样颗粒疫苗(Virus Like Particles,VLPs)不含星状病毒的核酸物质,安全性较好,接种后不会引发持续感染或潜伏感染,产生的免疫应答可以与星状病毒野毒株感染相区分,有利于疫病的控制和消灭。
3.2 鹅星状病毒重组Capsid蛋白亚单位疫苗的免疫效力
本试验克隆、扩增了Capsid蛋白全基因,利用昆虫细胞-杆状病毒表达系统构建表达该抗原蛋白的重组杆状病毒GoAsV/Bac株,在昆虫细胞HF中高效表达抗原蛋白;该蛋白经过提取纯化和二乙烯亚胺灭活后被加入佐剂乳化制成亚单位疫苗。疫苗性状检验、无菌检验、安全检验合格后,将所制疫苗分三批次接种种鹅。应用琼脂扩散试验法检测鹅血清中的GoAs抗体,收集接种后5周内所产的鹅蛋,再用琼脂扩散试验法检测鹅蛋卵黄中的GoAs抗体。种蛋孵化后收集雏鹅,饲养至3日龄,用琼脂扩散试验法检测雏鹅血清中的GoAs抗体,并攻毒。结果表明,三批疫苗接种后28 d,各试验组种鹅血清中GoAsV抗体效价平均值均不低于3.6log2,所产种蛋卵黄中GoAsV抗体效价平均值均不低于3.0log2,孵出的雏鹅血清GoAsV抗体效价平均值均不低于2.7log2;对照组种鹅血清和种蛋以及所孵出的雏鹅血清中抗体均为阴性。试验组雏鹅攻毒后一切正常,存活率100%,无不良临床症状。对照组雏鹅攻毒后第3天开始出现精神沉郁、厌食、站立不稳、离群和排稀灰白色或黄绿色等症状,存活率50%。死亡鹅剖检可见:关节肿大,关节内和内脏表面有石灰样尿酸盐沉积,肾脏肿大和充血,脾脏出血严重,有灰白色坏死灶。由此可见三批次疫苗对种鹅具有很好的免疫效果,雏鹅出雏时血清中含有较高水平的GoAsV抗体,可以有效抵抗鹅星状病毒的攻击。
4 结论
鹅星状病毒亚单位疫苗可以有效预防鹅星状病毒的感染,免疫效果良好。
