蛋白质组学在生鲜肉肉色变化机制研究中的应用
2020-10-21梁荣蓉许宝琛张一敏杨啸吟朱立贤毛衍伟张文华
梁荣蓉,许宝琛,张一敏,杨啸吟,朱立贤,毛衍伟,张文华,罗 欣※
(1. 山东农业大学食品科学与工程学院,泰安 271018;2. 国家肉牛牦牛产业技术体系中卫试验站,中卫 755000)
0 引 言
生鲜肉的肉色是影响消费者购买欲望的最直观因素,肉色的快速劣变会使消费者对肉的新鲜程度产生怀疑,进而影响购买欲。动物宰杀充分放血后,肌红蛋白(Myoglobin,Mb)成为肉的主要呈色物质。其含量的高低和所处的化学状态决定着肉的色泽。肌红蛋白在不同条件下呈现不同的化学状态,这使肉呈现不同的色泽。在无氧环境条件下,肌红蛋白常以脱氧肌红蛋白(Deoxymyoglobin,DeoxyMb)的状态存在,使肉呈现紫红色,易被氧化;在氧气比较充足的条件下,脱氧肌红蛋白与氧结合形成氧合肌红蛋白(Oxymyoglobin,OxyMb),使肉呈现鲜红色,易被氧化。这两种状态的肌红蛋白被氧化后形成高铁肌红蛋白(Metmyoglobin,MetMb)呈棕褐色,而MetMb 的积累导致了肉色的劣变[1]。肉色的稳定性自动物宰后就开始逐渐降低,最终出现肉色劣变。在肉类生产中,众多因素影响生鲜肉色的稳定性,如动物的营养状况、宰前管理状况和宰后肉的pH 值、脂质氧化、贮藏温度、包装方式等。这些因素会从不同的方面影响肉中肌红蛋白的状态和肉色稳定性。因而,在生产流通过程中,如何延缓肉色劣变是肉品行业面临的一大挑战[2]。
在肉色研究中,人们常用传统的肉色指标(CIE-L*a*b*,L*值表示肉色的亮度,a*值表示肉色的红度,b*值表示肉色的黄度值)和肉色稳定性评价指标(高铁肌红蛋白还原能力,Metmyoglobin Reductase Activity,MRA)指标等对肉色进行评价。但是,这些指标只能指征肉色的变化程度和变化趋势,并不能从深层次阐述肉色变化的原因。所以,学者对于肉色变化的生物学机制仍未完全了解。宰后肌肉中其他众多蛋白分子和诸多生化代谢与肌红蛋白的作用以及它们与肉色稳定性的关系仍知之甚少。事实上,人们感知到的肉色主要由颜色属性(a*值、b*值)和亮度(L*值)组成,颜色属性通常与肌细胞中的肌红蛋白、氧化还原酶类和代谢酶类等肌浆蛋白相关,亮度则与肌肉的微观空间结构有关[2]。动物宰后,肌细胞并不会立即死亡,其内部的代谢系统仍会继续工作以维持细胞稳态。这些代谢系统的变化则会对肉色产生影响,但传统的肉色研究方法不能反映这些内部蛋白质的变化。而蛋白质组学的出现则为深入研究肉色变化的分子机制和生化过程提供了新的可靠方法。Yu等[3]对宰后24 h 内牛背最长肌和腰大肌的肌浆蛋白质组进行了比较,发现了几种与肉色稳定性相关的蛋白,它们在宰后潜在影响肉的颜色。Yang 等[4]比较了不同包装方式下牛背最长肌的蛋白质组,结果表明代谢酶、抗氧化酶、结构蛋白等均与肉色存在相关性。所以,采用蛋白组学可以更深入从蛋白变化角度探究肉色形成的机制和外界因素影响肉色的途径。
目前,已有许多学者采用蛋白组学的方法在差异蛋白中鉴定出许多与肉色相关的生物蛋白标志物,并探讨了其影响肉色的可能机制。研究发现,在这些差异蛋白中,尽管一些蛋白和酶类与肉色没有直接的关联,但它们有的与肌红蛋白的转化过程间接相关,有的能对光的折射和散射产生影响,最终均影响了肉色。因此,学者将这些差异蛋白作为影响肉色的生物标志物[5-6]。虽然近年来已有采用蛋白组学对肉色进行不同的研究,也取得了较多成果,但目前尚未有文章系统总结分析该领域的成果和发展趋势。因此,本文从肉中的 2 类重要蛋白:结构蛋白(肌动蛋白、肌球蛋白、肌联蛋白)和肌浆蛋白(伴侣蛋白、代谢酶类、氧化还原酶、过氧化物酶)2个方面出发,综述了近年来采用蛋白质组学鉴定出的与肉色相关的差异蛋白及其与肉色和肉色稳定性的关系,探讨了肉色的变化机制,对仍然存在争议的差异蛋白进行了分析和阐述,对需要进一步深入研究的内容进行了展望,为今后进一步采用蛋白组学研究肉色变化机制和肉色控制措施的开发提供参考。
1 结构性蛋白对肉色的影响
结构性蛋白是指构成肌纤维微观结构的蛋白质,主要包括肌球蛋白、肌动蛋白、肌钙蛋白、原肌球蛋白和肌联蛋白等。当光线照射到肉的表面时,它可以被反射、吸收或散射,这3 种作用共同决定了肉的颜色[7]。其中,反射到消费者眼睛的颜色决定了消费者对肉品的感知程度,从而决定了消费者对肉品的接受程度。因此,通常使用分光光度计或色差计对反射到眼睛的光进行测量,并将得到的数据分为颜色属性和亮度。肉的微观结构变化会影响其对光的反射、吸收和散射程度。因此,构成肌肉超微结构的结构性蛋白的变化可能会影响肉色(图 1)。最近,Hughes 等[8-9]对不同牛种、不同部位肌肉的肌原纤维进行了研究,认为结构性蛋白的丰度变化影响了光线的吸收和散射,从而改变肉的颜色。同时,肌肉结构性蛋白还会与其他肌浆蛋白相互作用,从而影响光的吸收和散射,使肉色发生变化。因此,结构性蛋白的差异表达可能会影响到肉色。已有研究发现肌动蛋白、肌球蛋白和肌联蛋白会通过微观结构的收缩或界面的偏转而产生光散射,使不同分子结构和不同折射特性的肌肉呈现出不同的颜色[8],如表1 所示。
1.1 肌动蛋白
肌动蛋白(Actin)是一种高度保守的蛋白质,聚合后产生丝状体,在细胞质中形成交联网络,是构成肌原纤维结构中细微丝的主要组分。肌动蛋白以单体(G-肌动蛋白)和聚合物(F-肌动蛋白)的形式存在,这2 种形式在骨骼肌的收缩和舒张过程中起着重要作用[10]。研究发现,肌动蛋白可能通过改变光的散射影响肉色,使肉的L*值发生巨大变化[11]。
目前,α-肌动蛋白(α-Actin)是蛋白质组学研究中已经确定的与肉色相关的结构蛋白之一[11-12]。Gagaoua 等[13]对夏洛莱牛宰后背最长肌的蛋白质组进行了研究,发现α-肌动蛋白的含量与L*值呈正相关,而与a*值,b*值,
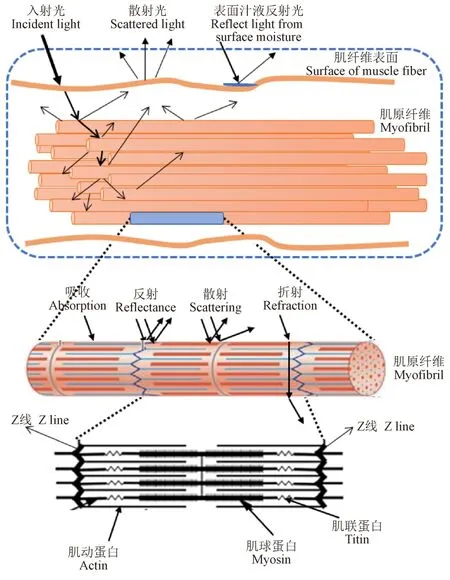
图1 结构性蛋白与光通过肌肉纤维时光特性的关系示意图Fig.1 Schematic representation of the relationship between structural proteins and the light properties when it passes through a muscle fiber
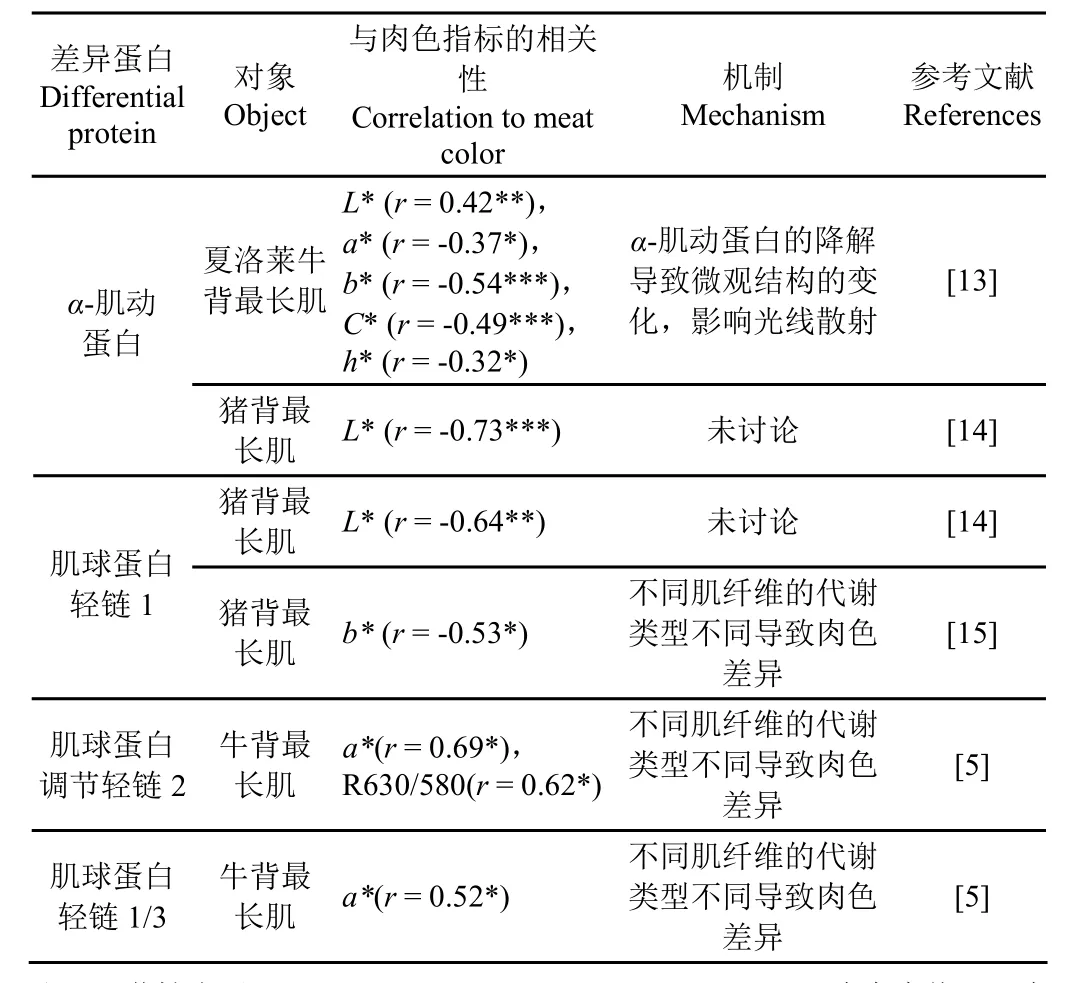
表1 主要差异性结构蛋白与肉色的关系Table 1 Relationship between differential myofibrillar proteins and meat color
C*值和h*值负相关,该蛋白在颜色苍白的肉中的表达量是在肉色较深的肉中的6.2 倍。他们认为,一旦肌原纤维蛋白被μ-钙蛋白酶和其他蛋白酶(如细胞凋亡酶)降解,肌纤维的微观结构就会发生显著变化,从而影响光的散射,进而影响肉色。而Hwang 等[14]发现猪背最长肌中α-肌动蛋白表达量与L*值呈显著负相关,但他们的研究对象为高pH 值的异常猪肉,因此结果可能与正常肉相悖。Hughes等[2]也认为光的散射程度会受到微观结构的影响,肌肉亮度的差异主要是微观结构对光线的散射不同造成的,包括肌丝晶格、肌原纤维之间及肌纤维之间的空隙等。因此,α-肌动蛋白在肉中的差异表达会影响光线的散射和折射,其表达量的增加可能会使肉色变暗。
1.2 肌球蛋白
肌球蛋白(Myosin)是调控肌肉收缩的分子马达,其六聚体分子由两个肌球蛋白重链(Myosin Heavy Chain,MyHC)和 4 个肌球蛋白轻链(Myosin Light Chain,MyLC)组成[16],是构成肌原纤维结构中粗微丝的蛋白组分。肌球蛋白重链末端通过折叠形成肌球蛋白的头部,两条重链的螺旋相互缠绕形成棒状螺旋线圈。每 1 条MyHC 结合 2 条不同的 MyLC 亚型,1 条为基本轻链(MELC,Myosin Essential Light Chain),另1 条为调节轻链(MRLC,Myosin Regulatory Light Chain)[17]。骨骼肌中MyHC 表达量较高,占肌肉蛋白的35%左右。
由于肌球蛋白亚型的表达量不同,导致不同类型、不同部位肉的肌纤维类型组成不同,近年来,有学者采用蛋白组学研究了肌纤维类型与肉色的关系[3,18-19]。Żelechowska 等[15]比较了 PSE(Pale,Soft,Exudative)猪肉和正常猪肉的蛋白质组,发现慢速氧化型肌纤维含有较多的肌球蛋白轻链 1,而肌球蛋白轻链 1 的含量与b*值呈负相关。而在骨骼肌中,快速酵解型肌纤维主要由肌球蛋白调节轻链 2 和肌球蛋白轻链 1/3 组成[20]。Hwang 等[14]发现,在猪肉中肌球蛋白轻链1 与L*值呈显著负相关,并将其选为与肉品质相关的生物标志物的候选蛋白,但并未对此作进一步解释。Canto 等[5]对托盘包装牛排的蛋白质组学进行研究,发现肌球蛋白调节轻链2和肌球蛋白轻链 1/3 与a*值呈正相关,肌球蛋白调节轻链2 与R630/580 呈正相关,并且相较于肉色稳定性差的牛排,肌球蛋白调节轻链2 和肌球蛋白轻链1/3 在肉色稳定的牛排中含量较多。因此,不同肌纤维类型中含有的肌球蛋白组成不同,从而导致了生鲜肉的肉色存在差异[5]。
1.3 肌联蛋白
肌联蛋白(Titin)是一种起串联作用的结构蛋白,锚定在Z 线和肌球蛋白之间,是肌肉产生弹性的主要来源[21]。Huff-Lonergan 等[22]认为,肌肉在宰后成熟过程中,肌联蛋白的降解使肌原纤维的收缩程度降低,增加了肌肉中的储水空间,进而对光的散射产生影响。Hughes 等[2,23]认为,肌联蛋白的降解,使肌原纤维的完整性遭到破坏,降低了肌肉的保水性。而蛋白质的降解和水的渗出均会影响肉的质地和光线的散射,使L*值增大。此外,Funatsu 在其早期研究中[24]发现肌联蛋白的某些区域能够与粗丝和细丝相结合,因此,横桥的旋转可能会导致肌联蛋白缠绕在细丝上,造成α-肌动蛋白产生扭转,从而影响肉的颜色。
因此从以上的蛋白质组学研究[11-13,15]中,可以看出结构性蛋白的表达量与L*、a*、b*值均存在相关性,表达量的变化也会改变光穿透肌肉结构的程度。并且,伴随着结构蛋白的降解,肌原纤维的空间结构会发生不同程度的改变,影响了肉品对光线的吸收和散射,进而对肉色产生影响。这些研究证实肉色不仅由肌红蛋白决定,还受肌肉微观结构和肌球蛋白分子组成等因素的影响。
2 肌浆蛋白对肉色的影响
肌浆蛋白由肌红蛋白和酶等可溶性蛋白组成,占骨骼肌总蛋白的30%[6]。其中,参与能量代谢的酶能够调控影响肉色稳定性的生化过程,而伴侣蛋白则通过对其他蛋白空间结构的保护维持肉色稳定,参与氧化还原过程的酶则通过维持肌肉细胞稳态来延缓肉色劣变[25]。此外,肌红蛋白与肌浆蛋白中其他蛋白之间的相互作用对肉色稳定性也起着至关重要的作用[25]。因此,肌浆蛋白一直是肉色领域的重点研究对象。为探究肌浆蛋白与肉色的关系,近年来已有许多学者采用蛋白质组学对其进行了研究,并取得了大量成果。为了研究肌浆蛋白在肉色稳定性中的作用,Joseph 等[6]比较了肉色稳定性不同的牛背最长肌和腰大肌中的肌浆蛋白质组差异,发现肉色稳定的背最长肌中氧化还原酶和伴侣蛋白的含量比肉色不稳定的腰大肌高。此外,氧化还原酶和伴侣蛋白与牛排的表面红度、颜色稳定性和MRA 呈正相关。还有学者发现,同一肌肉不同位置的肌浆蛋白质组也存在差异,如牛半膜肌外侧的肉色比内侧的更稳定,对于该现象,Nair 等[26]比较了牛半膜肌外侧与内侧的肌浆蛋白质组,发现半膜肌内侧中3 种糖酵解酶的丰度显著高于外侧(P <0.01)。除以上研究外,仍有大量学者对不同处理条件的肌肉肌浆蛋白进行了研究。基于目前的蛋白组学研究结果,根据差异蛋白功能的不同,将与肉色相关的肌浆蛋白分为伴侣蛋白、代谢酶类、氧化还原酶、过氧化物酶4 类[4,6,12]。
2.1 伴侣蛋白与肉色稳定性的关系
伴侣蛋白(Chaperone protein)是一种可以协助共价折叠或展开其他大分子蛋白的蛋白质,它的一个重要功能是防止新合成的多肽链聚合成为非功能性结构[18],维持蛋白质的稳定,减缓蛋白质的变性。目前蛋白质组学研究中发现的热休克蛋白家族、DJ-1 蛋白均属于伴侣蛋白,他们均可以通过维持其他蛋白质的稳定,减缓蛋白质的变性[27],从而维持肉色稳定。
2.1.1 热休克蛋白
热休克蛋白(Heat shock proteins,Hsps),又称热应激蛋白,是生物体在高温下为保护自身而产生或过量表达的一类蛋白[28]。动物屠宰放血后,细胞凋亡进程启动,机体的应激反应使肌肉中 Hsp 的含量增加。热休克蛋白通过发挥其保护肌原纤维和调控代谢的功能,维持蛋白质稳定和激酶活性,延缓蛋白质的水解和细胞凋亡的发生。由于肉对光线的反射受到蛋白质变性的影响,而氧化应激过程中热休克蛋白会推迟色素蛋白和肌原纤维结构的变化,因此热休克蛋白可以在一定程度上维持肉色的稳定[12]。同时,热休克蛋白可以维持整个细胞内氧化还原状态,有助于稳定肌红蛋白和结构蛋白的结构,进而保证光线的透过和散射不发生改变[19,29]。
热休克蛋白按其单体分子大小可分为五类。其中,分子量为60、70、90 和100 kDa 的热休克蛋白分别称为Hsp60、Hsp70、Hsp90 和 Hsp100;而分子量在 12~43 kDa之间的,统称为小热休克蛋白(Small Heat shock proteins,sHsps)[30]。动物屠宰后,小热休克蛋白参与了由肌肉向肉的转化过程和细胞凋亡过程[29]。作为分子伴侣的sHsps可以防止应激过程中蛋白质的不可逆聚集[31],它们的抗凋亡和伴侣作用有助于维持肉色的稳定。Hspb6(Hsp20)属于小热休克蛋白家族,它可以防止蛋白质的错误折叠,并减轻由于pH 值下降引起的蛋白质变性[32]。Zhang 等[33]比较了常规冷却和逐步冷却的牛背最长肌的蛋白质组,发现在肉色稳定性高的逐步冷却牛排中,Hspb6 表达量上调,该现象与 Gagaoua 更早的研究相一致[12],这说明Hspb6 可能会对酶代谢活性的变化和pH 值的下降做出反映,维持肌原纤维蛋白的结构,进而稳定肉色。Yu 等比较了背最长肌和腰大肌在贮藏过程中蛋白质组的变化,他们也发现在贮藏过程中,Hspb6 在a*值较高的背最长肌中丰度更高,这可能是因为 Hspb6 可以保护蛋白结构免受损伤,从而维持了较好的肉色稳定性[34]。虽然 Hspb6已经多次被鉴定为与肉色相关的差异蛋白,但其影响肉色稳定性的明确机制尚需要进一步确定。
蛋白质组学分析发现,大分子量的热休克蛋白与肉的颜色变化也存在相关性,其中,Hsp70 家族在蛋白质组学研究中多次被鉴定为差异蛋白[12,19,29]。Hsp70 通过保护由应激诱导的蛋白质变性而起到维持肉色稳定的作用。在此保护作用下,肌原纤维蛋白的结构变化和肌红蛋白的变性进程得到延缓,使肉色得到了一定程度的保护[35]。Hsp70 和μ-calpain 的相互作用也会对肉色产生影响。μ-calpain 具有水解结构蛋白的作用[13,36]。而 Hsp70 可以作为分子伴侣使结构蛋白免受μ-calpain 的降解,缓解由于μ-calpain 的活动而使肉色发生劣变的过程[12]。对于Hsp· 70 保护结构蛋白免受μ-calpain 降解的机制,Carbone等[37]认为,动物屠宰后,胴体中脂质过氧化的产物会引起Hsp70 的羰基化。而Sahara 等研究[38]发现,在猴海马神经元中,羰基化的Hsp70 是μ-calpain 的主要底物。因此,Gagaoua 等[12]推测,如果这种途径也存在于肌肉中,即肌肉中羰基化的Hsp70 也可被μ-calpain 降解,那么羰基化Hsp70 含量的增加将保护结构蛋白免受μ-calpain 的降解,从而延缓色素和肌原纤维蛋白结构的变化,进而改善肉色(表2)。
2.1.2 伴侣蛋白DJ-1
DJ-1 是一种与氧化应激有关的伴侣蛋白。内源性DJ-1 具有保护细胞免受氧化应激和阻止或延缓细胞凋亡的能力,可以减轻氧化应激产生的毒性[42]。在氧化条件下,DJ-1 通过其伴侣活性抑制α-突触核蛋白的聚集和变性,作为氧化还原的伴侣蛋白和氧化应激传感器在动物体内发挥作用[43-44]。有研究发现该蛋白的表达会对肉色产生影响。Yang 等[4]发现,在牛肉冷藏早期(5 d)时,相比于CO 气调包装,高氧气调包装牛肉中的DJ-1 表达量上调,这可能是高氧气调包装中的高浓度氧气造成的氧化应激使其表达量上调;而到贮藏10 d 时,相比于肉色稳定性更好的CO 气调包装牛肉,仅检测到1 种DJ-1蛋白在高氧气调包装中上调,而另外2 种DJ-1 蛋白却表达下调;而贮藏至15 d 时的相关性分析发现,高氧气调包装牛排中DJ-1 表达量与a*显著负相关,而与MRA 还原力呈正相关。而 Wu 等[39]对托盘包装的半膜肌牛排研究也发现,随着牛排成熟时间的延长,肌浆蛋白质组中DJ-1 的表达量与牛排的a*值和MRA 呈负相关,可以作为肉类贮藏后期肉色失色的一个潜在标记物。Yang 等[4]和杨啸吟等[45]则认为,虽然DJ-1 在氧化应激环境中表达量会上调,但它在对抗氧化损伤的同时也会被消耗,其最终表达量的变化趋势则由这种蛋白表达量的上调程度和自身被消耗的程度共同决定,所以可能会出现其表达量与a*值相关性不同的情况。而Sayd 等[27]对猪半膜肌的肌浆蛋白质组进行了分析,发现DJ-1 蛋白还在颜色较浅的猪肉中过量表达,认为这可能是猪肉在宰后受到较大氧化应激时,其对氧化应激的过度补偿,但他们没有检测其过量表达与a*值的关系。
2.2 代谢酶类与肉色稳定性的关系
家畜宰后能量代谢的速率和程度均可潜在地影响肌肉的pH 值和鲜肉的颜色[46]。代谢酶类可以通过降低pH值和催化复杂的生理过程(凋亡和自噬),在肉类成熟过程中发挥重要作用[47]。大量代谢产物,如乳酸、琥珀酸、苹果酸和丙酮酸等,会与线粒体及其酶系统相互作用,使烟酰胺腺嘌呤二核苷酸(Nicotinamide Adenine Dinucleotide,NADH)得到及时补充,将MetMb 还原,进而改善肉色[45]。宰后代谢酶类主要包括乳酸脱氢酶、醛脱氢酶、肌酸激酶和丙酮酸激酶等。
2.2.1 乳酸脱氢酶
乳酸脱氢酶(Lactate Dehydrogenase,LDH)是代谢过程中的重要酶,对维持肉色稳定起到重要作用。NADH 是一种抗氧化剂,可以作为氧清除剂与细胞中的活性氧反应,促进MetMb 的还原和pH 值的降低,使肉维持较好的肉色[48]。而乳酸脱氢酶参与乳酸-LDH 系统,能催化乳酸转化为丙酮酸盐,同时将 NAD+转化为NADH[49],在动物宰后对细胞内的NADH 进行补充,补充的NADH 可用于MetMb 的还原[50],从而改善鲜肉的颜色。Wu 等[39]通过研究贮藏期内鲁西黄牛半膜肌肌浆蛋白质组的变化,发现乳酸脱氢酶的含量与a*值和MRA 值呈显著正相关;但是,该酶的表达量随贮藏时间的延长呈现下降的趋势,这可能是由于在低温条件下乳酸脱氢酶稳定性较差,随着贮藏时间的延长逐渐失活导致[51]。
2.2.2 醛脱氢酶
醛脱氢酶家族(Aldehyde Dehydrogenase,ALDH)的某些成员可以保护细胞免受脂质氧化产物(如可溶性醛)毒性的影响[52]。氧化应激过程中,某些醛脱氢酶类可将脂质过氧化产生的 4-羟基壬烯醛(4-Hydroxy-2-Nonenal,4-HNE)和丙二醛(Malondialdehyde,MDA)等产物降解, 从而保护细胞其他成分。
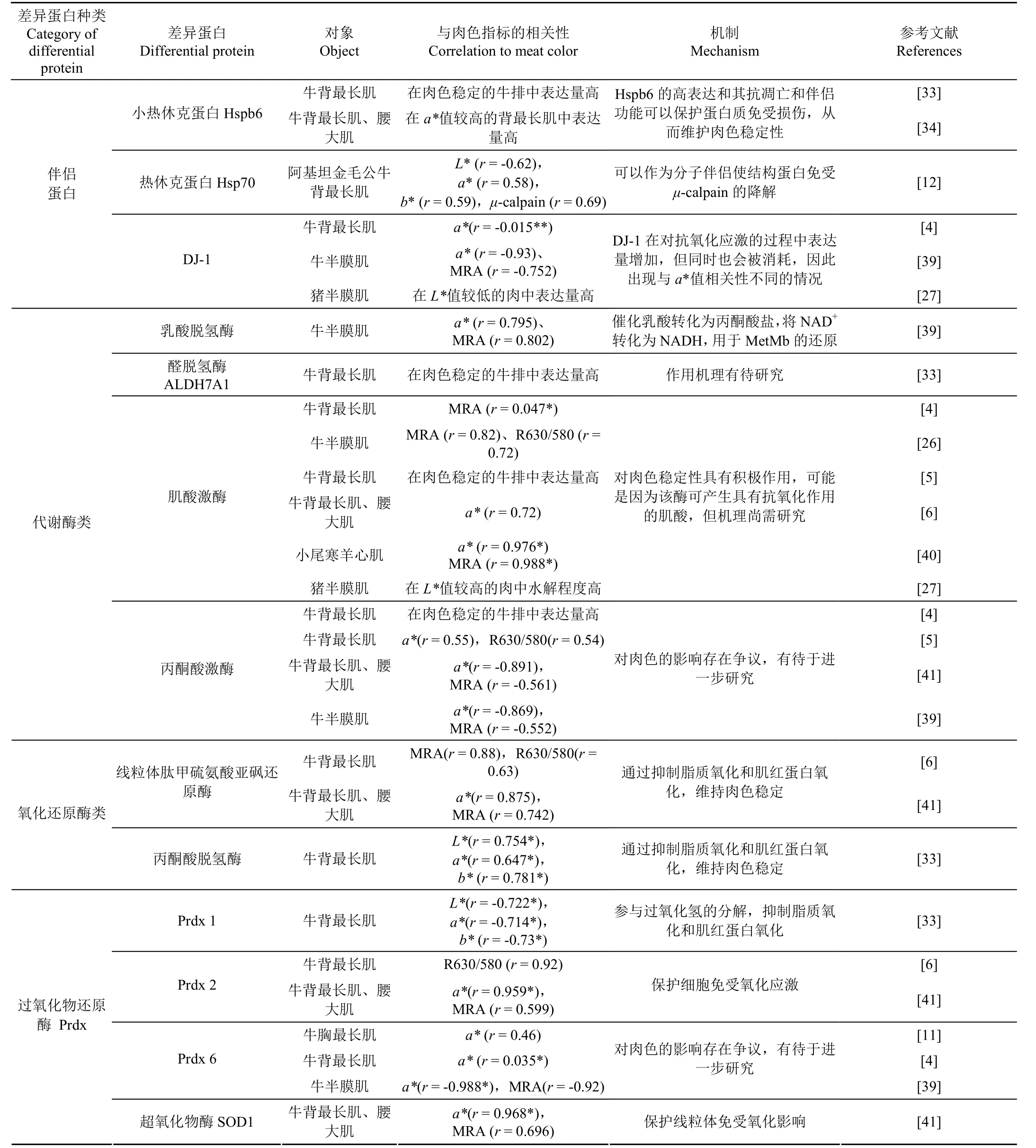
表2 主要差异性肌浆蛋白与肉色的关系Table 2 Relationship between main differential sarcoplasmic proteins and meat color
α-氨基-己二酸半醛脱氢酶(Alpha-Aminoadipic Semialdehyde Dehydrogenase,ALDH7A1)属于醛脱氢酶家族,它主要通过分解脂质过氧化衍生醛来保护细胞免受氧化应激,从而维持肉色稳定性。这种酶参与了从甜菜碱醛生成甜菜碱的亚路径,加速了NADH 的积累,促进了MetMb 的还原[53]。Zhang 等[33]比较了逐步冷却和常规冷却牛排的肌浆蛋白质组,发现在颜色稳定的逐步冷却牛排中,ALDH7A1 的表达量显著高于常规冷却牛排。但目前对肉色的蛋白质组学研究中,对 ALDH7A1 的分析较少,因此该酶对肉色的影响还有待进一步确定。
2.2.3 肌酸激酶
肌酸激酶(Creatine Kinase,CK)对维持ATP-ADP水平稳定起着重要作用。随着肌肉中ATP 的消耗,肌酸激酶会催化磷酸肌酸和ADP 转化为肌酸和ATP[54]。肌酸是公认的天然抗氧化剂,可以直接清除氧自由基[55]。而自由基在生物系统中会促进蛋白质氧化,导致肉类变色[56]。Lawler 等[57]利用骨骼肌的体外生物模型研究了肌酸的自由基清除能力,发现肌酸对离子自由基具有明显的猝灭作用,而对于不带电的自由基清除作用则不明显,这说明肌酸具有选择性的抗氧化作用。但是,肌酸激酶容易受到氧化而发生水解,Sayd 等[27]发现,在L*值较高的猪半膜肌中,肌酸激酶水解片段增多,这是由于宰后肌肉的氧化水平增加,导致肌酸激酶发生了水解。
细胞质中的肌酸激酶由 B(脑型)和 M(肌肉型)两种亚型组成,其中,M 型在骨骼肌中大量表达。在肉色相关的蛋白质组学研究中,肌酸激酶M 型已成为目前研究的重点。Yang 等[4]比较了高氧气调包装与 CO 气调包装牛排的蛋白质组差异,发现肌酸激酶M 型的含量与牛排的MRA 呈正相关,并且在颜色稳定的CO 气调包装牛排中含量更高,这说明肌酸激酶的表达量增加,有助于维持肌肉组织氧化还原状态的稳定,进而稳定肉色。不同部位肌肉中,肌酸激酶的含量有很大差异,Nair 等[26]比较了牛半膜肌外侧与内侧的肌浆蛋白质组,发现肌酸激酶M 型在肉色稳定的牛半膜肌外侧中丰度更高,并与MRA 和R630/580 呈正相关。Canto 等[5]也发现,肌酸激酶M 型在颜色稳定的背最长肌中含量较多。背最长肌主要由快速酵解型肌纤维组成,已有研究表明,快速酵解型肌纤维的肌酸激酶含量和磷酸肌酸浓度高于慢速氧化型肌纤维[58],较多的肌酸激酶可以产生更多的肌酸,从而减少肌红蛋白氧化,提高肉色稳定性。与之相似,Joseph等[6]报道了在颜色稳定的背最长肌中,肌酸激酶 M 型的丰度高于颜色不稳定的腰大肌,并且肌酸激酶M 型的含量与a*值之间呈正相关。Gao 等[40]对小尾寒羊的心肌进行了研究,发现肌酸激酶M 型与a*值和MRA 均呈正相关。在试验前期,肌酸激酶催化磷酸肌酸转化为肌酸,维持肌肉内氧化还原体系的稳定;而随着贮藏时间的延长,呼吸作用产生的活性氧逐渐增多,导致肌酸激酶被氧化,从而使肉色发生劣变。这说明肌酸激酶在维持肉色稳定性方面具有积极的作用,已逐渐成为人们关注的焦点。
2.2.4 丙酮酸激酶
丙酮酸激酶(Pyruvate Kinase,PK)是糖酵解途径中的最后一种酶,也是整个过程的限速酶,对ATP 的水解和ADP 的磷酸化均有重要影响。动物体内存在4 种具有特异性的丙酮酸激酶同工酶,每种同工酶都具有适应不同组织代谢需求的特殊动力学特性[59]。
目前已有研究发现丙酮酸激酶的表达量与牛肉的a*值相关,但目前的研究结果指向两个不同的方向。Yang等[4]对比了不同包装方式牛排的蛋白质组,发现相比于肉色稳定的CO 气调包装的牛排,肉色稳定性较差的高氧气调包装的牛排中丙酮酸激酶的表达量较低。同样地,Canto等[5]比较了同一部位肉的牛排在展示过程中的肉色变化,发现丙酮酸激酶M2 在肉色稳定的牛排中含量更丰富,并且与a*值和R630/580 呈正相关。这些研究说明丙酮酸激酶可能在维持肉色稳定性方面具有积极作用。然而,Wu等[41]对鲁西黄牛的不同部位肉的蛋白质组学进行研究得出相反的结论,其发现在背最长肌和腰大肌中,丙酮酸激酶同工酶的表达量均与a*值和MRA 呈负相关。Wu 等[39]的另一项研究也发现了类似结果,在牛排的贮藏过程中,丙酮酸激酶的表达量与a*值和 MRA 呈负相关,说明随着丙酮酸激酶表达量的增加,牛肉的肉色稳定性变差。因此,目前丙酮酸激酶对牛肉肉色的影响仍然存在争议,在今后的研究中,我们有必要开展更多的研究确定丙酮酸激酶对肉色的影响,并阐明其影响机制。
由上述内容可以看出,代谢酶类更多地是影响肉的a*值和MRA,但由于不同处理方式以及不同贮藏时间点对酶的表达量均有影响,因此某些代谢酶,如丙酮酸激酶,对肉色的影响尚未有明确的结论。因此未来可以以此为切入点,在统一处理方式的前提下,比较贮藏过程中某种代谢酶的动态变化与肉色的关系,从而更进一步地确定这些代谢酶与肉色的相关性。
2.3 氧化还原酶与肉色稳定性的关系
氧化还原酶可以通过参与细胞代谢、衰老、凋亡过程,减少氧化应激,维持细胞中的氧化还原状态的稳定,进而维持肌红蛋白结构的稳定[12,19]。研究发现该酶系的线粒体肽甲硫氨酸亚砜还原酶(Mitochondrial Peptide Methionine Sulfoxide Reductase,MSRA)和丙酮酸脱氢酶(Pyruvate Dehydrogenase,PDHB)的表达量与肉色密切相关。
MSRA 能催化蛋白质中甲硫氨酸亚砜还原为甲硫氨酸。在组织蛋白中,甲硫氨酸残基被氧化为甲硫氨酸亚砜会导致甲硫氨酸错位或以其他方式使蛋白质功能紊乱[60],造成多种蛋白质失去生物活性。作为一种修复酶,MSRA 可以作为活性氧清除系统的一部分来保护蛋白质免受氧化损伤,该系统在细胞抗氧化防御中具有重要作用[61]。Joseph 等[6]发现在背最长肌的展示过程中,MSRA与背最长肌的表面颜色稳定性(R630/580)和MRA 呈显著正相关。Wu 等[41]研究了宰后贮藏期间背最长肌样品中MSRA 的变化,发现它与a*值和MRA 呈正相关。此外,Stadtman 等[62]认为MSRA 还参与了过氧化还原蛋白清除活性氧的过程,该过程可抑制脂质氧化和肌红蛋白氧化,从而维持肉色稳定。因此,MSRA 的过量表达可以保护肉中与颜色稳定性相关的肌浆蛋白免受氧化损伤。
PDHB 能催化丙酮酸转化为乙酰辅酶A 和二氧化碳的进程,将糖酵解途径与三羧酸循环联系起来,共同增加NAD+的含量,NAD+可以促进NADH 的产生。作为一种抗氧化剂,NADH 与活性氧发生反应,减少了肌红蛋白氧化,有助于维持肉色稳定性[41]。Zhang 等[33]研究发现,在背最长肌逐步冷却的过程中,丙酮酸脱氢酶β亚型的表达量始终与L*、a*、b*值呈正相关,与MetMb 含量呈负相关。由此可见,PDHB 表达量的增加可以极大地减少由于肌内脂肪氧化诱导的肌红蛋白氧化,有利于NADH 的产生,使肉色得到改善。
2.4 过氧化物酶与肉色稳定性的关系
蛋白质氧化对于牛肉在贮藏期间的肉色稳定性具有较大影响[45]。目前,鉴定出的能够提高肉色稳定性的蛋白质大多具有抗氧化性。此外,Baron 等[63]还认为肌肉可以通过其内源性抗氧化酶和抗氧化维生素来抑制蛋白质氧化。抗氧化系统对清除过量的活性氧、保护细胞免受氧化应激非常有效。对于活体动物,当受到氧化应激时,细胞的解毒机制也可以自动调控活性氧含量,使体内的氧化还原恢复平衡。然而,在动物屠宰后的几个小时内,由于机体抗氧化能力的降低,自由基对肌肉细胞的破坏程度增加,导致肉色稳定性逐渐变差[64]。因此,维持动物宰后机体内的抗氧化体系对肉色的稳定性具有重要作用。
2.4.1 过氧化物还原酶
过氧化物还原酶(Peroxiredoxin,Prdx)对细胞具有保护功能,主要保护代谢过程,延缓蛋白水解和细胞凋亡的发生。肌细胞中,慢速氧化型肌纤维被称为过氧化物还原酶的贮存器[65],当细胞受到氧化应激时,会释放过氧化物还原酶清除过氧化物,保护细胞免受氧化损伤。过氧化物还原酶家族包括6 个成员Prdx 1、Prdx 2、Prdx 3、Prdx 4、Prdx 5 和Prdx 6。它们均作为介导过氧化氢信号的传感器,有助于减少氧化应激,在细胞的代谢、凋亡和衰老过程中均有参与[66]。
研究发现,过氧化物还原酶家族的大多数成员对肉色稳定性具有保护作用。Zhang 等[33]的研究表明,Prdx 1与Prdx 5 和过氧化氢酶相互作用,参与过氧化氢分解过程,这有利于肉中还原环境的形成,从而抑制脂质和肌红蛋白氧化,维持肉色稳定。Prdx 2 也对肉色稳定性有保护作用。Joseph 等[6]发现在牛排的展示过程中,Prdx 2在颜色稳定的牛排中含量较高,且与R630/580 显著正相关。与之相似,Wu 等[41]发现在背最长肌的成熟过程中,Prdx 2 与a*值呈显著正相关。这说明Prdx 2 在维持肉色方面可能具有积极的作用,这可能是由于Prdx 2 可以还原过氧化物,从而保护细胞免受氧化应激。同时Chevallet等[67]认为,在氧化还原过程中,Prdx 2 中的活性位点被氧化,但它可以被活性巯基(如硫氧还蛋白)再生,因此,硫氧还蛋白在肌肉中的过量表达也会增加Prdx 2 的数量,进一步增强了其保护细胞免受氧化应激的能力。Prdx 3 也属于过氧化物还原酶家族,是一种参与调节线粒体中活性氧产生并能保护细胞免受氧化的抗氧化酶[68],也是已知唯一一类催化硫氧还蛋白还原的酶,因此该酶是硫氧还蛋白系统的核心成分[69],该酶可能也会有助于肉色的稳定,但目前尚未见报道。
在目前关于肉色的研究中,许多研究发现Prdx 6 与肉色变化存在相关性,然而研究结果却指向两个不同的方向。Gagaoua 等[12]研究了牛宰后24 h 内的蛋白质组学变化与肉色的关系,发现Prdx 6 与a*值呈正相关。Yang等[4]发现Prdx 6 在肉色稳定的CO 气调包装牛排中表达量更高,这有助于肉中NADH 的形成和CO 气调包装中还原体系的维持,改善了该包装条件下的肉色稳定性。但也有学者发现了相反的结果,Wu 等[39]研究发现,中国鲁西黄牛半膜肌中Prdx 6 与a*值及MRA 呈负相关。此外,Wu 等[39]还发现 Prdx 6 的丰度与硫代巴比妥酸反应物(Thiobarbituric Acid-Reactive Substances,TBARS)呈正相关。这可能是因为氧化应激可诱导肉在后期贮藏过程中产生过氧化物还原酶,这些酶一方面可以减轻脂质氧化,另一方面可以与肌红蛋白竞争氧或氧化应激反应产物,降低肌红蛋白氧化的程度,从而减缓肉的变色过程[12]。因此,许多学者认为Prdx 6 表达量的变化是肉色稳定性下降的一个潜在指标,但两者的具体关系仍有待于确定。
综上所述,过氧化物还原酶可以通过清除过氧化物,抑制脂质氧化,从而减少脂质氧化诱导的肌红蛋白氧化,改善肉色稳定性[56]。
2.4.2 超氧化物歧化酶
超氧化物歧化酶(Superoxide Dismutase,SOD)属于保护性蛋白,在动物宰后贮藏过程中,起到维持肌肉肉色稳定性的作用[39]。肉色的变化与脂肪氧化密切相关,促氧化和抗氧化物质之间的平衡维持了肉色的稳定[70]。动物屠宰后,多不饱和脂肪酸的氧化可导致鲜肉颜色褐变,而SOD 能保护线粒体免受脂质过氧化物和活性氧的影响[12]。SOD1(Superoxide dismutase [Cu–Zn])存在于各类动物体内,分布于细胞质中,能够结合铜和锌离子,负责清除体内的超氧化物自由基,将其转化为氧分子和过氧化氢,避免肌红蛋白的氧化,维持肉色稳定性[71]。Wu 等[41]对比了背最长肌和腰大肌在成熟过程中的蛋白质组变化,发现SOD1 含量始终与a*值呈显著正相关,并且在颜色不稳定的腰大肌中SOD1 表达量下降。因此,他们认为可以将 SOD1 作为预测肉色稳定性的一个标志物。此外,Gagaoua 等[13]还推测SOD 可能与其他蛋白质(如热休克蛋白)共同保护细胞免受氧化应激,抑制肉色劣变。目前人们认为超氧化物歧化酶主要通过清除超氧化物阴离子保护肉色,是否有其他方面的影响还有待于进一步研究。
3 结论与展望
本文综述了近年来采用蛋白质组学技术发现的与红肉生鲜肉肉色相关的差异蛋白及其与肉色和肉色稳定性的关系。主要结论有:
1)蛋白质组学分析发现的与肉色相关的主要差异性结构性蛋白主要有肌球蛋白、肌动蛋白和肌联蛋白。这些蛋白表达量的变化会影响肌肉组织的微观结构,进而影响肌肉对光线的吸收、透射和散射,从而改变肉色。
2)蛋白质组学分析发现的与肉色相关的主要肌浆蛋白主要有伴侣蛋白、代谢酶类、氧化还原酶和过氧化物还原酶四大类。伴侣蛋白可以通过维持蛋白质的稳定,减缓蛋白质变性,从而有助于维持肉色稳定性;代谢酶类主要包括乳酸脱氢酶、醛脱氢酶、肌酸激酶和丙酮酸激酶等,它们更多的影响肉的红度值a*值和MRA,大部分酶类可在代谢过程中产生NADH,有助于MetMb 的还原,但是不同研究条件下结论不完全一致,需进一步研究;氧化还原酶类主要通过抑制脂质氧化和肌红蛋白氧化维持肉色稳定;过氧化物还原酶主要通过保护细胞、线粒体、脂质和肌红蛋白免受氧化,维护肉色稳定性。
因此,肉色不仅受肌浆蛋白中差异蛋白对肌红蛋白性质调控的影响,还受到结构性蛋白表达对肌肉微观结构改变的影响。然而,目前鉴定出的很多差异蛋白与肉色的相关性还存在争议,尚不能完全确定其与肉色的具体关系;同时,对于已鉴定出的差异蛋白,尚缺少后续验证试验以进一步确定其对肉色的影响机制。因此,今后在利用蛋白质组学找出差异蛋白后,需要针对差异蛋白设计验证实验,进一步确定其对肉色的影响及调控途径。并在此基础上,通过调控相关差异蛋白在肉中的表达,提高肉色稳定性,以达到改善肉色稳定性和延长肉色货架期的目的,这将是该领域未来研究的重点。鉴于目前蛋白组学在肉色领域研究发现的差异蛋白,今后通过调控结构蛋白中的α-肌动蛋白和肌球蛋白轻链等差异蛋白表达,以及调控肌浆蛋白中的伴侣蛋白、代谢酶类、氧化还原酶类和过氧化物还原酶类中的典型差异蛋白的表达来调控生鲜肉的肉色将是未来研究的重点。然而,目前尚未有通过调控以上差异蛋白表达来调控生鲜肉色的报道。因此,寻找适宜的差异蛋白调控方法调控将是今后研究的一个重要任务。当然,肉色形成机制复杂,影响肉色形成的原因可能不限于文中提到这些,还需要学者们今后不断深入研究。
